В организме существуют две относительно самостоятельные системы свертывания крови, благодаря которым происходит остановка кровотечения. Один из механизмов, коагуляционный, осуществляется с помощью биомакромолекул прокоагулянтных белков и завершается формированием фибринового тромба [1]. Второй механизм предполагает участие тромбоцитов крови, которые посредством реакций адгезии и агрегации образуют тромбоцитарную пробку. Эти системы тесно взаимосвязаны. Так, тромбоциты предоставляют свою поверхность для ускорения ключевых реакций коагуляционного гемостаза, а образующийся в результате этого тромбин значительно усиливает агрегацию и приводит к образованию сети фибрина, в которой застревают эритроциты и лейкоциты. Кроме того, тромбоциты играют важнейшую роль в заживлении и регенерации поврежденных тканей, так как выделяют факторы роста, способствуют привлечению клеток-предшественников в зоны повреждения сосудов [2]. Исследование способности тромбоцитов к активации, их структурных и функциональных изменений является важной проблемой, так как понимание механизмов, лежащих в их основе, расширяет возможности профилактики и коррекции нарушений в системе гемостаза, не только отягощающих течение заболевания, но нередко определяющих его исход.
Функциональная активность тромбоцитов, в свою очередь, определяется влиянием различных факторов прокоагулянтного и антикоагулянтного действия. Активации тромбоцитов способствуют различные биологически активные вещества, такие как АДФ, фактор активации тромбоцитов, серотонин, вазопрессин и другие, посредством взаимодействия со специфическими рецепторами на поверхности клеток [3]. Одним из факторов, модулирующих тромбоцитарную активность, является оксид азота (NO), играющий важную роль в регуляции различных физиологических процессов [4]. Разнообразие эффектов оксида азота обусловлено образованием его активных метаболитов и взаимодействием с различными молекулярными мишенями. Данные о характере и механизме влияния NO на сосудисто-тромбоцитарный гемостаз во многом противоречивы и неоднозначны. Большинство исследователей придерживается мнения об ингибирующем действии оксида азота на этапы сосудисто-тромбоцитарного гемостаза [5]. Однако существуют работы, доказывающие, что характер влияния оксида азота на процессы адгезии и агрегации тромбоцитов зависит от концентрации донатора этого вещества [6]. Также доказано существование функционально различных субпопуляций тромбоцитов в зависимости от их способности генерировать и реагировать на оксид азота в [7].
Цель исследования
Изучение морфофункциональных особенностей тромбоцитов, характеризующих уровень их активности in vitro в присутствии оксида азота у крыс.
Материал и методы исследования
Работа выполнена на базе научно-исследовательского центра ИвГМА и является частью комплексного исследования механизмов гемостаза. В экспериментах использовано 16 белых беспородных крыс-самцов массой 200-220 г. Животные содержались в условиях вивария с соблюдением основных зоогигиенических требований. Этические принципы обращения с животными соблюдались в соответствии с правилами работы с животными («Правила лабораторной практики в Российской Федерации» Приказ МЗ и СР РФ № 708н от 23.08.2010 г.) и «European Convention for the Protection of Vertebral Animals Used for Experimental and Other Scientific Purposes. CETS No. 123».
В экспериментах in vitro оценивалось изменение агрегационной активности тромбоцитов, их морфологии, интенсивности перекисного окисления липидов (ПОЛ) тромбоцитарной плазмы при инкубации с экзогенным донатором оксида азота (нитропруссидом натрия) в конечной концентрации 100 мкмоль/л [8].
Эвтаназия животных осуществлялась посредством дислокации шейных позвонков. Забор крови производился из левого желудочка после вскрытия грудной клетки. Кровь стабилизировали 3,8% раствором цитрата натрия в соотношении 9:1 по объёму. Для получения обогащенной тромбоцитами плазмы кровь центрифугировали в течение 10 мин. при 1500 об/мин. Бедную тромбоцитами плазму получали после 10-минутного центрифугирования оставшейся крови при 3000 об/мин. Плазму, богатую тромбоцитами, помещали в 2 пробирки (по 0,5 мл). В одну из пробирок добавляли 0,1 мл раствора нитропруссида натрия, в другую такое же количество физиологического раствора. Обе пробирки инкубировали в термостате при 37 °C в течение 15 мин.
Агрегационная активность тромбоцитов исследовалась турбидиметрическим методом (оптической агрегометрией) с помощью агрегометра Solar AP 2110 (Беларусь). В основе метода – измерение коэффициента светопропускания перемешиваемой и термостатируемой суспензии клеток (обогащенной тромбоцитами плазмы) против плазмы, бедной тромбоцитами, с выводом результатов на встроенный индикатор и записью агрегатограммы в течение 10 минут (рис. 1). В качестве индуктора агрегации использовался раствор динатриевой соли АДФ в конечной концентрации 5 мкмоль/л. В результате агрегации интенсивность ослабления светового потока уменьшается. Для оценки агрегационной активности тромбоцитов определялись следующие показатели: максимальная степень агрегации (Ст А, %), время максимальной степени агрегации (Вр А, с), скорость агрегации за первые 30 секунд (Ск А, % / мин).
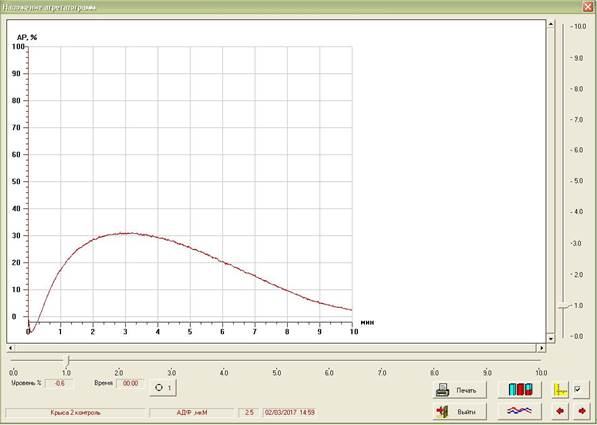
Рис. 1. Агрегатограмма, полученная при исследовании агрегационной активности тромбоцитов с помощью агрегометра Solar
Для морфологического исследования использовались фотографии мазков тромбоцитарной плазмы, окрашенных по Романовскому-Гимзе, полученные с применением иммерсионного объектива. Изображение анализировалось при помощи ImageJ – программы для анализа и обработки изображений. На основании результатов морфологического анализа определялся индекс омоложения тромбоцитов (ИОТр), представляющий собой соотношение количества молодых и старых тромбоцитов. Расчет производился на 500 клеток [9]. При окраске азур-эозином гранулы тромбоцитов имеют фиолетово-красный цвет. Доля структур красного цвета отражает насыщенность тромбоцитов гранулами. Увеличение количества структур, имеющих синюю окраску, указывает на появление большого количества молодых, активных форм тромбоцитов. В условиях гиперкоагуляции ИОТр увеличивается, что свидетельствует об увеличении количества «молодых» форм тромбоцитов и их функциональной активности. В условиях гипокоагуляции отмечается уменьшение этого показателя, следовательно, доля активных форм тромбоцитов уменьшается, что клинически подтверждается кровоточивостью.
Оценка активности процессов перекисного окисления липидов (ПОЛ) производилась посредством определения концентрации малонового диальдегида (МДА, нмоль/мл) в реакции с тиобарбитуровой кислотой [10]. Увеличение концентрации продуктов ПОЛ может свидетельствовать о повышении активности свободнорадикальных процессов, спровоцированном метаболитами оксида азота.
Статистическая обработка проводилась с помощью электронных таблиц Excel и программы Statistica. Для оценки нормальности распределения использовался критерий Шапиро-Уилка. Достоверность различий оценивалась на основании t-критерия Стьюдента, а также непараметрических критериев Колмогорова-Смирнова и Манна-Уитни.
Результаты исследования и их обсуждение
Результаты проведенного исследования показали, что экзогенный донатор NO (нитропруссид натрия) в концентрации 100 мкмоль/л вызывает снижение агрегационной активности тромбоцитов in vitro. Так, достоверно уменьшается степень агрегации (таблица). Скорость агрегации имеет отчетливую тенденцию к снижению.
Изменение агрегационной активности тромбоцитов при инкубации
с нитропруссидом натрия
|
Показатель |
Контроль |
Опыт |
Достоверность различий |
|
Степень агрегации (%) |
15,47 ± 3,55 |
4,91 ± 2,49 |
p<0,05 |
|
Время максимальной степени агрегации (с) |
131,71 ± 19,24 |
130,75 ± 20,85 |
p>0,05 |
|
Скорость агрегации (% / мин) |
16,00 ± 3,79 |
8,2 ± 3,24 |
p>0,05 |
Способность оксида азота и NO-генерирующих соединений угнетать агрегацию тромбоцитов связана с торможением вызванного агонистами накопления в клетках свободных ионов кальция. Большинство физиологических эффектов NO реализуется посредством активации растворимой гуанилатциклазы [11], которая катализирует биосинтез цГМФ из гуанозинтрифосфата (ГТФ). Этот внутриклеточный мессенджер модулирует активность протеинкиназы G, протеинфосфатазы, цГМФ-фосфодиэстеразы, ингибирует фосфолипазы A2 и С. Все это приводит к изменениям конформации белков плазматической мембраны и, как следствие, состояния ионных каналов. Снижается кальциевая проницаемость, и уровень свободного кальция в клетках падает, что является основной причиной уменьшения агрегационной способности тромбоцитов. В условиях снижения активности фосфолипазы C не происходит мобилизации внутриклеточного кальция из депо.
Тромбоциты периферической крови имеют форму диска или пластины. Диаметр их составляет 2,8–3,4 мкм, толщина 0,8–1,2 мкм, объем 5,7–8,9 мкм3. В циркуляции они представлены главным образом зрелыми клетками диаметром 2–3 мкм. Присутствует небольшой процент молодых форм размером более 3 мкм (макротромбоциты), а также старых – менее 2 мкм (микротромбоциты). Клеточная структура тромбоцитов образована такими компонентами, как мембрана, цитоскелет, гранулы и тубулы. Активация тромбоцитов проявляется превращением их из дисковидных в сферические с псевдоподиями, выбросом кальция из тубулярной системы, изменением фосфолипазной и киназной активности, реакцией фосфорилирования. Вследствие этих процессов освобождается содержимое гранул, формируются микровезикулы.
Морфологический анализ мазков тромбоцитарной плазмы выявил снижение ИОТр с 1,65 ± 0,15 до 0,43 ± 0,13 (p<0,05) в результате инкубации с нитропруссидом натрия (рис. 2). Это свидетельствует об уменьшении количества «молодых» форм и снижении функциональной активности тромбоцитов, что указывает на угнетение тромбоцитарного компонента гемостаза.
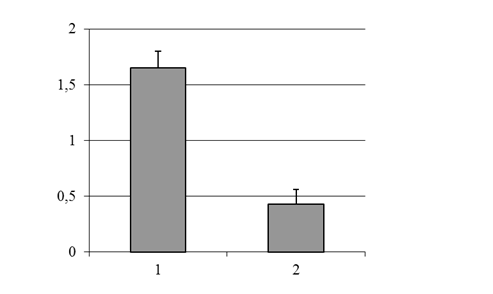
1 – контроль, 2 – опыт
Рис. 2. Изменение ИОТр при инкубации тромбоцитарной плазмы с нитропруссидом натрия
Негативное действие оксида азота состоит не только в нарушении функционирования внутриклеточных кальций-транспортных систем, но и в индукции оксидативного стресса. Метаболиты NO инициируют реакции свободнорадикального окисления с образованием повреждающих факторов и, как следствие, структурно-функциональные изменения, в том числе преждевременное старение и гибель клеток. Одним из наиболее часто определяемых продуктов ПОЛ является МДА, повышение концентрации которого является ранним признаком метаболических нарушений.
Тем не менее при использовании в качестве донатора NO раствора нитропруссида натрия в концентрации 100 мкмоль/л содержание МДА практически не изменяется (рис. 3). Известно, что в физиологических концентрациях NO выступает в роли антиоксиданта, тормозит развитие радикальных окислительных реакций, связываясь с ионами Fe2+ и ингибируя разложение перекисей. С другой стороны, тромбоциты способны продуцировать NO, хотя и в меньших концентрациях, чем, например, эндотелиальные клетки [12]. Концентрация кальция в клетке во многом определяет ее функциональное состояние и ферментативную активность. Кальций, присоединяясь к молекуле NО-синтазы, способствует активации фермента и синтезу оксида азота. В условиях дефицита внутриклеточного кальция продукция NO в тромбоцитах, вероятно, несколько снижается.
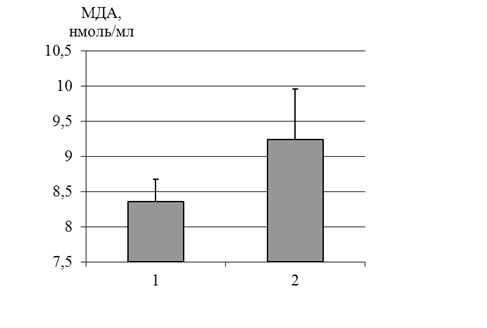
1 – контроль, 2 – опыт
Рис. 3. Изменение содержания МДА в плазме крови при инкубации с нитропруссидом натрия
Таким образом, уровень функциональной активности тромбоцитов in vitro определяется их агрегационной способностью, которая зависит от содержания «молодых» клеток, характеризующегося индексом омоложения тромбоцитов. Эти параметры могут быть использованы в качестве критериев при исследовании тромбоцитарного компонента гемостаза в экспериментах in vitro с применением различных модулирующих факторов.
Влияние оксида азота в концентрации 100 мкмоль/л на морфофункциональное состояние тромбоцитов in vitro проявляется уменьшением степени их агрегации и индекса обновления, что отражает снижение функциональной активности тромбоцитов и, как следствие, угнетение механизмов сосудисто-тромбоцитарного гемостаза.



