Травма шейного отдела позвоночника в 20–30% случаев сопровождается повреждением спинного мозга (СМ) [1]. Вследствие травмы СМ развивается жизнеугрожающее состояние, обусловленное прерыванием нисходящей симпатической импульсации из вышележащих отделов ЦНС. Причинами таких повреждений в 46,5% случаев являются дорожно-транспортные происшествия, в 24% падение с высоты, в 12,2% криминальная травма, в 9,5% спортивная травма. Как правило, пострадавшими являются трудоспособные лица, средний возраст которых составляет 38,1 года. Процент пострадавших мужского пола превалирует и варьируется от 62,5 до 76,5% [2; 3]. Возникающие вследствие травмы грубые функциональные нарушения сопровождаются высокой вероятностью развития неблагоприятного исхода. Летальность, в зависимости от тяжести повреждения СМ, на догоспитальном этапе достигает 37%, в стационаре колеблется в пределах от 8 до 58,3% [4].
Анатомическое или функциональное повреждение СМ характеризуется развитием нейрогенного и спинального шока. Клинически это состояние проявляется полной утратой двигательных, чувствительных и вегетативных функций [1; 5]. Большинство пострадавших сразу после получения травмы, вследствие выключения дыхательной мускулатуры, испытывают выраженный дыхательный дискомфорт – затрудненное поверхностное дыхание, невозможность откашливания мокроты. Далее развивается острая дыхательная недостаточность (ОДН). При этом степень тяжести ОДН зависит от характера позвоночно-спинномозговой травмы (ПСМТ) таким образом, что высокие шейные и грудные повреждения имеют высочайший риск. Развитие ОДН требует проведения искусственной вентиляции легких (ИВЛ). Выявлена зависимость длительности ИВЛ от тяжести повреждения СМ: у пациентов с повреждением ASIA А средняя длительность проведения ИВЛ составила 27,6±21,1 суток, с повреждением ASIA В – 17,8±15,3 суток [5; 6]. Нарушение дренажной функции легких приводит к присоединению патогенной флоры и развитию инфекционных осложнений. В 86% случаев именно инфекционные респираторные осложнения являются ведущей причиной неблагоприятных исходов у данного контингента пациентов. Проведение адекватной заместительной респираторной терапии достоверно снижает риск развития легочных осложнений и показатели летальности [7; 8]. Однако сама ИВЛ может стать причиной развития ассоциированной с ИВЛ пневмонии, которая осложняла течение ПСМТ в остром периоде у 81,3% больных с повреждением СМ ASIA А и у 62,5% с повреждением СМ ASIA В [5].
Наряду с проведением мероприятий интенсивной терапии, при поступлении в стационар подавляющему большинству пострадавших требуется выполнение декомпрессивно-стабилизирующих хирургических операций [9]. Из сведений, приведенных в монографии Колесова С.В., Пташникова Д.А., Швец В.В., становится очевидным, что на данном этапе отсутствует единое мнение об оптимальных сроках проведения хирургического лечения. Авторы, анализируя ряд экспериментальных и клинических исследований, показывают, что проведение раннего хирургического лечения предотвращает развитие вторичных повреждений СМ, улучшает восстановление неврологических функций, уменьшает количество осложнений со стороны дыхательной системы, длительность нахождения пациентов в ОРИТ и общую длительность госпитализации. Вместе с тем авторы монографии отмечают, что вопрос безопасности выполнения декомпрессивно-стабилизирующих операций в ранний период травмы и применение ранней хирургической тактики на частоту развития осложнений у этой категории пациентов, остаются предметом дискуссий [10; 11]. Таким образом, нерешенность и спорность некоторых положений указывает на актуальность настоящего исследования.
Цель исследования
Определить влияние фактора времени проведения декомпрессии спинного мозга от момента повреждения на течение осложненной травмы шейного отдела позвоночника.
Материал и методы
Настоящее исследование был спланировано как нерандомизированное ретроспективное контролируемое сравнительное, в параллельных группах, исследование результатов лечения 30 пациентов с ПСМТ на уровне С4–Th1 позвонков, находившихся на лечении в отделении реанимации и интенсивной терапии Новосибирского НИИТО в период с 2014 по 2017 год. Критерии включения: ПСМТ на уровне С4–Th1 позвонков, тяжесть повреждения СМ тип ASIA A и ASIA B. Критерии исключения: ПСМТ с тяжестью повреждения СМ ASIA С и ASIA D. Критерием формирования групп наблюдения явилась срочность выполнения декомпрессивно-стабилизирующих операций.
Тяжесть повреждения СМ оценивали по классификации ASIA/IMSOP, предложенной Американской ассоциацией по спинальным повреждениям и Международным обществом по параплегии (1992) [11] (табл. 1).
По срочности проведения декомпрессии СМ пациенты разделены на две группы: группа I – 15 пациентов, у которых декомпрессия СМ выполнена в первые восемь часов с момента получения травмы; группа II – 15 пациентов, у которых декомпрессия СМ выполнена в период времени от восьми до 72 часов с момента травмы. В группе II, в силу объективных причин (нахождение пациентов в других стационарах; травма, полученная в отдаленных районах области), оперативное вмешательство выполнялось в более поздние сроки.
Таблица 1
Классификация тяжести повреждения СМ (ASIA – American Spinal Injury Association, IMSOP – International Medical Society of Paraplegia)
|
Степень |
Повреждение спинного мозга |
Проявления |
|
А |
Полное |
Полное отсутствие моторных и сенсорных функций до сегментов S4–S5. |
|
B |
Неполное |
Чувствительность сохранена ниже уровня повреждения вплоть до сегментов S4–S5. Моторной функции нет |
|
С |
Неполное |
Парез ниже уровня повреждения (<3 баллов), моторная функция сохранена |
|
D |
Неполное |
Парез ниже уровня повреждения (>3 баллов), моторная функция сохранена |
|
E |
Отсутствует |
Моторные и сенсорные функции сохранены |
В ходе исследования анализировались следующие данные: возраст, пол, тяжесть состояния пациентов, неврологический статус, длительность ИВЛ, сроки нахождения в отделении реанимации и интенсивной терапии (ОРИТ), общая длительность госпитализации, частота развития пневмонии, летальность (табл. 2). Как видно из представленных в таблице 2 данных, выделенные группы были сопоставимы по основным изучаемым характеристикам.
Для объективизации степени тяжести состояния пациентов и выраженности органных дисфункций использовали шкалы APACHE II (Acute Physiology And Chronic Health Evaluation) и SOFA (Sequential Organ Failure Assessment). Оценку проводили: при поступлении, на первые, третьи, седьмые и 10-е сутки послеоперационного периода.
Все пациенты были госпитализированы в острый период травмы. При поступлении всем пациентам выполнен комплекс диагностических мероприятий, включающий: анамнестическое, общеклиническое, неврологическое, рентгенологическое обследование, магнитно-резонансное и компьютерно-томографическое исследование. С момента поступления и на этапе обследования пациентам проводились неотложные мероприятия интенсивной терапии, направленные на поддержание респираторной функции и гемодинамики. Респираторная поддержка осуществлялась инсуфляцией через лицевую маску увлажненного кислорода с потоком 5–7 литров в минуту под контролем газового состава артериальной крови с расчетом индекса оксигенации.
Таблица 2
Характеристика выделенных групп наблюдения
|
Оцениваемые параметры |
Группа I (n=15) |
Группа II (n=15) |
|
|
Тяжесть повреждения СМ |
ASIA А |
12 (80%) |
13 (86,7%) |
|
ASIA В |
3 (20%) |
2 (13,3%) |
|
|
Пол |
Мужской |
14 (93,3%) |
15 (100%) |
|
Женский |
1 (6,7%) |
0 (0%) |
|
|
Этиология ПСМТ |
Травма «ныряльщика» |
14 (46,7%) |
|
|
Кататравма |
9 (30%) |
||
|
ДТП |
4 (13,3%) |
||
|
Прочее |
3 (10%) |
||
|
Средний возраст, года |
36,5±12,6 |
39,2±13,8 |
|
Сведения о тяжести повреждения СМ в исследуемых группах при поступлении представлены в таблице 3.
Таблица 3
Характеристика групп в зависимости от неврологического дефицита
|
Группы наблюдения |
Тетраплегия |
Тетрапарез |
Верхний парапарез, нижняя параплегия |
Верхняя параплегия, нижний парапарез |
Трипарез, нижняя моноплегия |
|
Группа I |
1 (6,7%) |
0 (0%) |
12 (80%) |
0 (0%) |
2 (13,3%) |
|
Группа II |
2 (13,3%) |
1 (6,7%) |
5 (33,3%) |
2 (13,3%) |
3 (20%) |
Учитывая то обстоятельство, что проявлением нейрогенного шока у всех поступивших пациентов являлась артериальная гипотония на фоне развития состояния относительной гиповолемии, требовалось поддержание адекватного перфузионного давления. Целевые показатели АДср – 85–90 мм рт. ст. достигались путем проведения инфузионной терапии сбалансированными растворами кристаллоидов и симпатомиметиками. Объем инфузионной терапии на предоперационном этапе проводили из расчета 15-20 мл/кг идеальной массы тела пациента. Выбор препарата для проведения симпатомиметической терапии осуществляли на основе данных импедансной кардиографии. При регистрации нормальных значений СИ (3,5–4 л/мин/м2) препаратом выбора являлся допамин или норадреналин. При значениях СИ < 3,5 л/мин/м2 с целью поддержания инотропной функции сердца использовали добутамин. Регистрация АДср < 70 мм рт. ст. и значений СИ < 3,5 л/мин/м2в являлась показанием к использованию комбинации средств вазопрессорной и инотропной поддержки: норадреналин + допамин или норадреналин + добутамин. Дозы препаратов для проведения симпатомиметической терапии были вариабельны и составили: для норадреналина (0,02%) 0,05–0,5 мкг/кг/мин, для допамина (0,5%) или добутамина (0,5%) от 1,0 до 10,0 мкг/кг/мин.
После завершения обследования всем пациентам были выполнены декомпрессивно-стабилизирующие операции в условиях общей анестезии с ИВЛ (севофлуран, фентанил, эсмерон). Интраоперационно с целью поддержания адекватного перфузионного давления продолжалась симпатомиметическая терапия. Основными направлениями интенсивной терапии в послеоперационном периоде являлись: респираторная терапия и поддержание гемодинамики. Адекватный газообмен достигался путем проведения ИВЛ с целевыми значениями: SaО2 96, РаСО2 35-45 мм рт. ст., РаО2 > 65 мм рт. ст., рН 7,35-7,45. При проведении ИВЛ предпочтение отдавалось вентиляции с управлением по давлению. С целью обеспечения эффективной санации трахеобронхиального дерева и дыхательного комфорта пациента на 1–3-и сутки послеоперационного периода выполнялась трахеостомия. Проводилась профилактика вентилятор-ассоциированной пневмонии, включающая: использование бактериальных фильтров, одноразовых контуров, закрытых аспирационных систем, постоянную аспирацию из области надманжеточного пространства, подогрев и увлажнение дыхательной смеси. С целью микробиологического мониторинга выполнялись посевы биологических жидкостей (мокрота, моча) 2–3 раза в неделю. При подозрении на катетер-ассоциированную инфекцию, бактериемию или сепсис проводился забор крови для идентификации патогенной флоры. Обязательным компонентом бактериологических исследований являлось определение чувствительности к антимикробным препаратам.
Проведение настоящего исследования было спланировано в соответствии с гипотезой о «статистическом равенстве» (equality) по основной переменной исследования - продолжительности проведения ИВЛ пациентам групп исследования и сравнения. Размер выборки был оценен в режиме post hoc, в основу расчета выборки были положены количественные апостериорные значения времени продолжительности пребывания пациентов на ИВЛ. По имеющимся данным, дисперсии для времени продолжительности пребывания пациентов на ИВЛ в группе исследования и группе сравнения были равны σT0=7.1, σR0=18.6, откуда среднеквадратическое отклонение объединенной выборки (формула Коэна) составило:
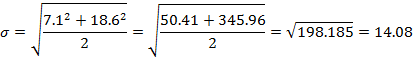
Разность средних значений в группе исследования и сравнения составила:
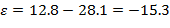
Учитывая дизайн исследования, а также тип и характер основной переменной (сравнительное исследование в параллельных группах), при условии равенства групп, размер каждой группы может быть оценен по формуле [12 (формула 3.2.2, стр. 58)]:
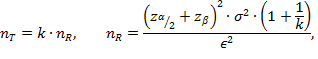
где nT и nR – численность в группе исследования и сравнения соответственно, k – соотношение численностей групп, zα/2, zβ – квантили нормального распределения.
При условии равенства групп, критического уровня значимости 0,05 при тестировании нулевой гипотезы, среднеквадратического отклонения объединенной выборки в 14.08, и заданной мощности 0,8 размер минимально достаточной выборки в таком случае составит:
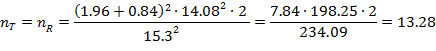
То есть в каждую группу должно быть включено не менее 14 участников, или всего не менее 28 участников в обе группы, вместе взятые.
С учетом малого размера групп пациентов анализ проводили непараметрическими методами. Для интервальных переменных были рассчитаны параметрические и непараметрические описательные статистики, в статье представленные в виде статистик для нормального распределения – средней и стандартного отклонения (M±SD), учитывая, что в масштабе генеральной совокупности анализируемые параметры обладают нормальным распределением. Межгрупповые сравнения интервальных переменных проводили методом Манна-Уитни, при этом различия считали статистически значимыми при достижении уровня значимости менее установленного критического значения альфа в 0,05. Корреляционный анализ проводили непараметрическим методом Спирмена, критический уровень альфа был принят равным 0,05. Статистический анализ проводили с использованием программного обеспечения IBM SPSS Statistics (версия 19.0).
Результаты и обсуждение
Основной причиной ПСМТ шейного отдела позвоночника в выполненном исследовании явилась травма «ныряльщика», которая составила 46,7% от общего количества пациентов. Это не вполне согласуются с данными, представляемыми другими авторами, которые в качестве ведущей причины ПСМТ рассматривали дорожно-транспортные происшествия (ДТП) [9; 11]. Обратить внимание на причину возникновения травмы у поступивших пациентов нас побудило то обстоятельство, что травма «ныряльщика», сопряженная с утоплением, всегда сопровождается риском развития аспирационной пневмонии. В нашем исследовании факт утопления был зарегистрирован только у девяти пациентов: у четырех в I группе, у пяти во II группе.
При определении тяжести состояния пострадавших при поступлении согласно шкале APACHE II нами не выявлено статистически значимых различий между группами. Тяжесть состояния составила 8,00±2,39 балла в I группе и 8,80±2,91 балла во II группе (Р=0,471). При оценке выраженности органных дисфункций по шкале SOFA достоверных различий между группами также не получено. Выраженность органных дисфункций составила 1,93±1,91 балла в I группе и 2,33±1,84 балла во II группе (Р=0,502).
Все поступившие пациенты нуждались в неотложном хирургическом лечении в объеме декомпрессии СМ и стабилизации повреждённого отдела позвоночника. Интраоперационный период во всех случаях протекал без осложнений. Продолжительность выполненных операций в группах составила: 237±68,0 мин (I), 227,1±59,6 мин (II). Объем кровопотери – 240,4±101,9 и 221,4±117,2 соответственно. После завершения хирургической операции все пациенты переводились в отделение реанимации и интенсивной терапии (ОРИТ) для динамического наблюдения и проведения комплекса мероприятий интенсивной терапии.
Состояние всех пациентов в послеоперационном периоде расценивалось как тяжелое. Динамика тяжести состояния и выраженности органных дисфункций в выделенных группах представлена в таблице 4.
Как видно из представленных в таблице 4 данных, статистически значимые различия между группами по тяжести состояния и выраженности органных дисфункций были зарегистрированы только на 10-е сутки послеоперационного наблюдения. Однако, несмотря на отсутствие достоверных различий, в I группе на всех этапах наблюдения зарегистрированы более низкие показатели оценки в баллах по сравнению с группой II.
Таблица 4
Динамика тяжести состояния и выраженности органных дисфункций в группах наблюдения
|
Шкалы оценки |
Группы наблюдения |
Р |
||
|
I (n=15) |
II (n=15) |
|||
|
APACHE II, баллы |
1-е сутки |
7,6±2,29 |
9,67±4,55 |
0,201 |
|
3-и сутки |
7,27±1,62 |
9,2±4,26 |
0,265 |
|
|
7-е сутки |
7,53±2,9 |
9,4±3,14 |
0,058 |
|
|
10-е сутки |
6,93±1,91 |
8,6±2,67 |
0,049 |
|
|
SOFA, баллы |
1-е сутки |
4,07±1,71 |
4,93±1,22 |
0,11 |
|
3-и сутки |
4,13±1,6 |
4,93±1,58 |
0,09 |
|
|
7-е сутки |
2,67±1,35 |
3,53±2,0 |
0,2 |
|
|
10-е сутки |
1,53±1,3 |
2,6±1,84 |
0,015 |
|
Далее нами был проведен анализ частоты развития осложнений, которые, по нашему мнению, могли влиять на длительность интенсивного наблюдения и терапии (табл. 5).
Таблица 5
Частота развития осложнений в группах наблюдения
|
Осложнения |
Группы |
|
|
I (n=15) |
II (n=15) |
|
|
Трахеобронхит |
15 (100%) |
15 (100%) |
|
Пневмония |
8 (53,3%) |
12 (79,9%) |
|
ТЭЛА |
2 (13,3%) |
0 (0%) |
|
Парез кишечника |
8 (53,3%) |
10 (66,7%) |
|
Уроинфекция |
15 (100%) |
15 (100%) |
|
Сепсис |
0 (0%) |
2 (13,3%) |
Клинические проявления катарального трахеобронхита были отмечены у всех пациентов с первых суток нахождения в ОРИТ. На 3–5-е сутки послеоперационного наблюдения у пациентов отмечался переход катарального трахебронхита в слизисто-гнойный, что было подтверждено результатами лечебно-диагностических фибробронхоскопий.
Известно, что пневмония является наиболее распространенным осложнением у пациентов с ПСМТ шейного отдела. В нашем исследовании пневмония развилась у подавляющего большинства пациентов II группы. Частота же развития пневмонии у пациентов I группы была на 26,6% меньше. Полученные нами данные о частоте развития осложнений со стороны дыхательной системы совпадают с известными сведениями, что частота развития данного осложнения при ПСМТ может достигать 80% [5].
Тромбоэмболия субсегментарных и сегментарных ветвей легочной артерии (ТЭЛА) осложнила течение ПСМТ шейного отдела у двух пациентов I группы, что составило 6,6% от всех пациентов, включенных в исследование. В одном случае пациент уже находился на самостоятельном дыхании через трахеостомическую трубку и проведение ИВЛ не потребовалось. Во втором случае длительность ИВЛ составила 19 суток, что на семь суток больше среднего показателя в I группе. Полученные нами данные не противоречат сведениям, приведенным В.В. Крыловом с соавторами, которые сообщили о развитии ТЭЛА при спинальной травме в 4–13% случаев [13].
Парез кишечника также чаще наблюдался во II группе пациентов. При анализе выраженности пареза кишечника установлено, что в I группе парез I степени развился в 75% случаев, парез II степени в 25% наблюдений. Во II группе развитие пареза кишечника II степени наблюдалось у 50% пациентов. Полученные результаты согласовываются с исследованиями, рассматривающими роль пареза кишечника как в усугублении дыхательной недостаточности, так и в повышении риска развития инфекционных осложнений посредством транслокации микробной флоры через нарушенный кишечный барьер [14].
Параклинические признаки уроинфекции проявились на 5–7-е сутки нахождения в ОРИТ у всех пациентов, включенных в исследование, в последующем наличие инфекции мочевыводящих путей подтверждено результатами бактериологических исследований.
Сепсис развился у двух пациентов II группы, в первом случае катетер-ассоциированный сепсис был подтвержден на 37-е сутки нахождения в ОРИТ, во втором случае пульмоногенный сепсис манифестировал на девятые сутки нахождения в ОРИТ.
При анализе данных по длительности нахождения пациентов в ОРИТ и общей длительности госпитализации нами не установлено статистически значимых различий. При этом выявлены достоверные различия между группами по длительности проведения ИВЛ (табл. 6).
Таблица 6
Особенности течения ПСМТ
|
Сравниваемые показатели |
Группы |
Р |
|
|
I (n=15) |
II (n=15) |
||
|
Длительность проведения ИВЛ, сутки |
12,8±7,1 |
28,1±18,6 |
0,005 |
|
Длительность нахождения в ОРИТ, сутки |
20,9±8,9 |
34,9±22,4 |
0,079 |
|
Общая длительность госпитализации, сутки |
44,7±25,1 |
51,5±20,8 |
0,163 |
Установлена также тесная корреляционная зависимость между продолжительностью ИВЛ и сроками пребывания пациентов в отделении ОРИТ с коэффициентом Спирмена = 0,924.
Авторы монографии, посвященной травме позвоночника и СМ, проводя обзор опубликованных результатов как экспериментальных, так и ретроспективных клинических исследований, демонстрируют возможности ранней декомпрессии СМ для повышения вероятности регресса неврологических нарушений. Положительная динамика в неврологическом статусе на момент выписки из стационара была установлена нами у 33,3% пациентов в I группе: три пациента с исходным повреждением СМ ASIA B перешли в категорию ASIA С, и два пациента с исходным повреждением СМ ASIA А перешли в категорию ASIA B. Во II группе положительная динамика в неврологическом статусе отмечена только у двух (13,3%) пациентов с исходным повреждением СМ ASIA В, у которых регресс неврологических нарушений при выписке соответствовал категории ASIA С.
Неблагоприятных исходов среди пациентов, включенных в исследование, зарегистрировано не было.
Выводы
1. Проведение декомпрессии СМ в первые восемь часом от момента травмы снижает длительность ИВЛ на 54,5%, длительность нахождения в ОРИТ на 40,1% и общую длительность госпитализации на 13,2%.
2. Выполнение декомпрессии СМ в первые восемь часов с момента травмы приводит к более значимому снижению выраженности органных дисфункций к 10-м суткам.
3. Повреждение СМ ASIA В на фоне комплексной терапии, включающей максимально раннюю декомпрессию СМ и комплекс мероприятий интенсивной терапии, является благоприятным в отношении регресса неврологического дефицита.



