Течение сахарного диабета 2 типа (СД 2) часто сопровождается присоединением инфекций мочевых путей (ИМП), что существенно утяжеляет течение и ухудшает прогноз у больных СД 2.
С другой стороны, СД 2 – хронический иммуновоспалительный процесс, сопровождающийся развитием дисбаланса иммунной системы, что, в свою очередь, осложняет течение ИМП, снижает эффективность проводимой терапии [1-3]. Рост антибиотикорезистентности патогенной микрофлоры также снижает результативность терапии ИМП у больных СД 2.
В последние годы все большее внимание исследователей привлекает взаимодействие и взаимозависимость состояния иммунной и эндокринной систем. Особое место в этих процессах занимают цитокины, роль которых не ограничивается обеспечением адекватного иммунного ответа, активацией неспецифических защитных реакций и специфического иммунитета [4; 5]. Цитокины осуществляют интегративную функцию, обеспечивая ответ организма при попадании в него патогенного агента, путем вовлечения практически всех органов и систем [5].
В развитии СД 2, его осложнений, инсулинорезистентности, в прогрессировании воспаления при воздействии патогенных микроорганизмов существенная роль отводится провоспалительным цитокинам TNF-α и IL-1β [1; 5; 6].
TNF-α продуцируется макрофагами, Т- и В-лимфоцитами, фибробластами и др. [4]. TNF-α повышает функциональную активность мононуклеарных фагоцитов, участвует в координации воспалительного ответа [4]. TNF-α является первичным медиатором воспаления, опосредует развитие системного воспаления, вовлекается в патогенез большинства иммунопатологических процессов [4; 5].
IL-1β – один из важнейших цитокинов острого воспалительного ответа. IL-1β увеличивает активность лимфоцитов, антителогенез, активность NK-клеток [7]. Путем повышения продукции других цитокинов, в частности IL-8, IL-1β стимулирует активность нейтрофильных гранулоцитов. Также IL-1β оказывает прокоагулянтное действие, нарушает микроциркуляцию [6]. В условиях гипергликемии повышается продукция IL-1β, который способен запускать апоптоз β-клеток [8].
В процессе лечения необходимо контролировать уровень цитокинов, так как их повышение в острую фазу воспалительного ответа носит защитный характер, в то время как длительное и бесконтрольное повышение уровня цитокинов может приводить к необратимым нарушениям гомеостаза [4; 5].
Ключевую роль в развитии и течении воспалительного процесса играют нейтрофилы – клетки, участвующие в противоинфекционной защите организма, участвующие в процессах иммуногенеза, противоопухолевой резистентности, а также в нейроэндокринной регуляции адаптационных реакций организма [9].
Нейтрофилы - клетки, крайне чутко реагирующие на изменение гомеостаза, что дает возможность использовать их для оценки состояния всей иммунной системы [9].
Длительность течения и низкая результативность стандартной терапии ИМП у больных СД 2 в условиях дисбаланса иммунной системы обосновывают необходимость использования иммуномодуляторов в комплексной терапии ИМП у больных СД 2.
В качестве иммунокорректора нами был выбран отечественный препарат полиоксидоний (Пд) – физиологически активное высокомолекулярное соединение, которое относится к классу водорастворимых производных гетероцепных алифатических полиаминов, является сополимером N-окси 1,4-этиленпиперазина и (N-карбоксиэтил)-1,4-этиленпиперазиний бромида.
Полиоксидоний оказывает стимулирующее влияние на факторы неспецифической защиты организма, гуморальный и клеточный иммунитет [10-12]. Важной особенностью полиоксидония является его активирующее воздействие на противоинфекционную резистентность организма [10]. Препарат обладает также антиокислительным, мембраностабилизирующим и дезинтоксикационным действием [10]. Полиоксидоний стимулирует антимикробную активность гранулоцитов, цитотоксичность NK-клеток, антителогенез [12]. Рядом авторов показано, что включение полиоксидония в комплексную терапию острых и хронических инфекций существенно повышает эффективность лечения [11; 12].
В связи с этим целью исследования явилась оценка влияния полиоксидония на уровень провоспалительных цитокинов и функциональное состояние нейтрофилов у больных СД 2 с ИМП.
Материалы и методы исследования
В исследование вошло 158 человек, которые были разделены на 5 групп: 1 группа – «здоровые» (35 человек), 2 группа – «СД 2» (31 человек), 3 группа - «ИМП» (35 человек), 4 группа – «СД 2 + ИМП», 5 группа – «СД 2 + ИМП + Пд» (27 человек).
Пациенты, больные СД 2, не отличались по полу, возрасту, индексу массы тела (ИМТ) (таблица). Пациенты получали стандартную сахароснижающую терапию.
Больные ИМП получали лечение в соответствии с российскими клиническими рекомендациями [13]. Группа «СД 2+ИМП+Пд» дополнительно получала полиоксидоний в дозе 6 мг 1 раз в сутки в течение 10 дней (НПО «Петровакс Фарм» ООО, Россия).
Характеристика обследованных групп
|
№ № |
Группы |
Кол-во |
Пол |
Возраст (лет) |
ИМТ |
|
|
М |
Ж |
|||||
|
1. |
Здоровые |
35 |
11 (31,43%) |
24 (68,57%) |
43,0 [39,0-50,0] |
24,80 [22,50-25,80] |
|
2. |
СД 2 |
31 |
14 (45,16%) |
17 (54,84%) |
60,0 [53,0-63,0] |
29,60 [27,40-34,90] |
|
3. |
ИМП |
35 |
15 (42,86%) |
20 (57,14%) |
56,0 [47,0-63,0] |
27,05 [23,50-28,60] |
|
4. |
СД 2 + ИМП |
30 |
10 (33,33%) |
20 (66,67%) |
56,50 [50,0-61,0] |
32,0 [28,60-33,50] |
|
5. |
СД 2 + ИМП + Пд |
27 |
3 (11,11%) |
24 (88,89%) |
61,0 [50,0-67,0] |
30,00 [26,70-32,90] |
Диагноз сахарного диабета, типа и степени тяжести заболевания устанавливался согласно «Алгоритмам специализированной медицинской помощи больным сахарным диабетом» (8-й выпуск, 2017 г.). Критериями включения в исследование явились: возраст - от 18 лет, предварительно подтвержденный диагноз СД 2, удовлетворительный контроль СД 2 (гликемия натощак<7,0 ммоль/л; гликемия постпрандиальная<19,0 ммоль/л; HbA1<7%); верифицированный диагноз ИМП (пиелонефрита), письменное информированное согласие пациента на проведение исследований и соблюдение этических принципов.
У всех обследованных определяли уровень цитокинов: фактор некроза опухолей-альфа (TNF-α) и интерлейкин-1бета (IL-1β) (тест-системы ЗАО «Вектор-Бест», г. Новосибирск) в день обращения. У пациентов групп «СД 2 + ИМП» и «СД 2 + ИМП + Пд» содержание цитокинов определяли также через 2, 4 и 8 недель лечения (на 2, 3 и 4-й визиты). Также исследовали интенсивность кислородзависимого метаболизма (спонтанный (НСТсп) и индуцированный (НСТинд) НСТ-тест) и фагоцитарную активность нейтрофилов (ФАН) [14].
Статистическая обработка данных проводилась с использованием методов вариационной статистики [15], пакета прикладных программ Statistica 8.0 на персональном компьютере. Показатели представлены в виде медианы (Ме) и квартилей (Р25%; Р75%). Дисперсионный анализ проводили с помощью Н-критерия Краскела-Уоллиса, для множественных сравнений использован Q-критерий Дана. Результаты считались статистически значимыми при р<0,05.
Результаты исследования и их обсуждение
В группе «СД 2» отмечено увеличение уровня TNF-α в 2,3 раза по сравнению с группой здоровых лиц (p=0,000001) и в 1,5 раза - с «ИМП» (p=0,02399) (рис. 1). Также отмечено увеличение IL-1β в 2 раза по сравнению со здоровыми (p≤0,00001) и почти на 40% по сравнению с группой «ИМП» (p=0,00189) (рис. 2).
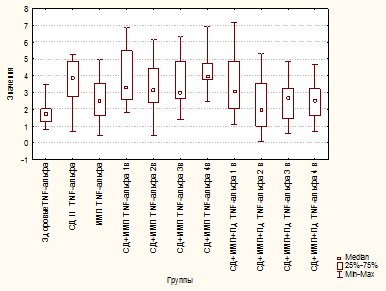
Рис. 1. Уровень TNF-α (пг/мл) у здоровых, больных сахарным диабетом 2 типа, больных инфекцией мочевых путей, больных сахарным диабетом 2 типа и инфекцией мочевых путей, больных сахарным диабетом 2 типа и инфекцией мочевых путей
и получающих полиоксидоний
Также у пациентов этой группы было установлено снижение ФАН в 5 раз по сравнению с группой «здоровые» (p≤0,00001) и в 3,2 раза - с группой «ИМП» (p≤0,00001) (рис. 3).
Наблюдалось 2-кратное подавление оксидантного метаболизма нейтрофилов в спонтанном и индуцированном НСТ-тесте по сравнению как с группой здоровых лиц (p≤0,00001 и p≤0,00001 соответственно), так и с группой «ИМП» (p≤0,00001 и p≤0,00001 соответственно). Это свидетельствует о том, что СД 2 является хроническим иммуновоспалительным процессом с формированием глубокого дисбаланса иммунной системы и снижением противомикробной защиты и согласуется с данными других авторов [3].
При присоединении ИМП у больных СД 2 сохранялся высокий уровень провоспалительных цитокинов без тенденции к снижению к окончанию лечения. Так, уровень TNF-α к 4-му визиту (p=0,000030), а IL-1β - на протяжении всего периода наблюдения были достоверно выше, чем у больных ИМП в острый период заболевания (p=0,00217, p=0,00145, p=0,00017 соответственно на 2, 3 и 4-й визиты) (рис. 1, 2).
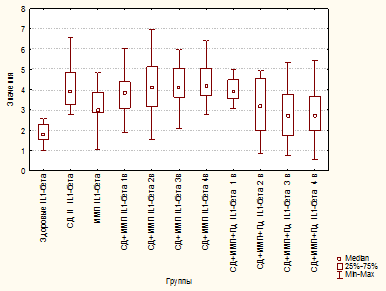
Рис. 2. Уровень IL-1β (пг/мл) у здоровых, больных сахарным диабетом 2 типа, больных инфекцией мочевых путей, больных сахарным диабетом 2 типа и инфекцией мочевых путей, больных сахарным диабетом 2 типа и инфекцией мочевых путей
и получающих полиоксидоний
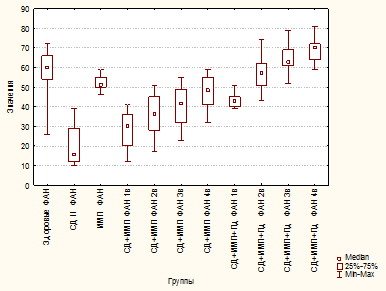
Рис. 3. Фагоцитарная активность нейтрофилов у здоровых, больных сахарным диабетом 2 типа, больных инфекцией мочевых путей, больных сахарным диабетом 2 типа и инфекцией мочевых путей, больных сахарным диабетом 2 типа и инфекцией мочевых путей
и получающих полиоксидоний
В группе «СД 2+ИМП» выявлено снижение ФАН на 50% по сравнению с группой здоровых лиц (p≤0,00001) и на 30% - с группой «ИМП» (p≤0,00001), однако на 30% выше, чем в группе «СД 2», что можно объяснить антигенной стимуляцией (рис. 3). К 4-му визиту уровень ФАН повышался до уровня группы «ИМП» (в острый период) и составил 80,83% (по отношению к уровню здоровых лиц). Аналогично показатели кислородзависимого метаболизма нейтрофилов в спонтанном НСТ-тесте не отличались от таковых в группе «СД 2» и лишь к 4-му визиту повышались до 84,44% (по сравнению с группой здоровых лиц) и были сопоставимы с таковыми у больных «ИМП» в острый период заболевания. В то же время в условиях индукции показатели активности нейтрофилов оставались крайне низкими и даже на 4-й визит составили лишь 69,79% (от уровня здоровых лиц), не достигая уровня больных группы «ИМП» в острый период. Полученные данные могут свидетельствовать об истощении резервных возможностей гранулоцитов, отсутствии адекватного ответа на воздействие патогенов, что, безусловно, способствует затяжному течению ИМП и низкой эффективности проводимой терапии.
Добавление Пд в комплексную терапию больных СД 2 с ИМП обеспечило статистически значимое снижение уровня TNF-α начиная со 2-го визита, и к 4-му визиту содержание TNF-α было ниже на 35% по сравнению с группой больных СД 2 (p=0,00472, p=0,02004, p=0,04111 на 2, 3 и 4-й визиты соответственно) и «СД 2+ИМП» (p=0,00007, p=0,00045, p=0,00097 на 2, 3 и 4-й визиты соответственно). На 1-м визите уровень TNF-α не отличался от такового от группы «ИМП» (p=0,14153) (рис. 1).
Аналогично применение Пд обеспечило достоверное снижение уровня IL-1β на 3-й и 4-й визиты по сравнению с больными СД 2 (p=0,01382 и p=0,00666 соответственно) и не отличалось от уровня у здоровых лиц (p=0,18964 и p=0,34263 соответственно) (рис. 2). Полученные данные свидетельствуют о выраженном противовоспалительном эффекте Пд и коррекции им иммунного дисбаланса в группе «СД 2 + ИМП».
Применение Пд у больных в группе «СД 2 + ИМП» обеспечило статистически значимое повышение ФАН по сравнению с группой «СД 2» (p≤0,00001 на 2, 3 и 4-й визиты) и группой «СД 2+ИМП» (p=0,00001, p≤0,00001, p=0,00001 на 2, 3 и 4-й визиты соответственно) (рис. 3). Уже со 2-го визита ФАН в группе «СД 2+ИМП+Пд» не отличалась от таковой в группе здоровых лиц (p=1,0000 на 2, 3 и 4-й визиты) (рис. 3).
Применение Пд не изменяло показателей интенсивности оксидантного метаболизма нейтрофилов в спонтанном НСТ-тесте, что можно объяснить антиоксидантной активностью Пд [12]. В то же время в условиях индукции было отмечено статистически значимое повышение активности нейтрофилов к 4-му визиту (на 30% по сравнению с группой «СД 2», p=0,02056), что не отличалось от показателей в группе «здоровые» (p=0,71529). Полученные результаты могут свидетельствовать о повышении Пд биоцидности нейтрофилов у больных СД 2 с ИМП, что способствует более эффективной элиминации возбудителей инфекции и повышению результативности проводимой терапии. Это согласуется с тем, что Пд активирует фагоцитирующие клетки, восстанавливает иммунные реакции при вторичных иммунодефицитных состояниях [10; 12].
Таким образом, применение Пд у больных СД 2 с ИМП обеспечило достоверное снижение уровня провоспалительных цитокинов (TNF-α и IL1β), повышение фагоцитарной активности и интенсивности кислородзависимого метаболизма нейтрофилов.
Результаты проведенного исследования свидетельствуют о том, что включение Пд в лечение больных СД 2 с ИМП оказывает позитивное влияние на дисбаланс цитокинов и функциональную активность нейтрофильных гранулоцитов.
Выводы
1. В группе «СД 2» выявлено значительное повышение уровня цитокинов TNF-α и IL-1β, подавление фагоцитарной и антимикробной активности нейтрофилов.
2. В группе «СД 2 + ИМП» при проведении стандартной терапии уровень цитокинов TNF-α и IL-1β сохраняется на высоком уровне, также отмечается снижение поглотительной и микробицидной способности нейтрофильных гранулоцитов.
3. Включение полиоксидония в комплексную терапию в группе «СД 2 + ИМП + Пд» снижает уровень цитокинов TNF-α и IL-1β, восстанавливает фагоцитарную активность и биоцидный потенциал нейтрофилов.



