В настоящее время с целью дифференциальной диагностики доброкачественных и злокачественных объемных образований яичников (ДОЯ и ЗОЯ) на амбулаторном этапе в дополнение к стандартному определению уровня опухолевого маркера СА-125 в сыворотке крови применяют анализ концентрации онкомаркера НЕ-4. Согласно ранее опубликованным данным возрастание концентрации СА-125 определялось у пациенток с ЗОЯ позже, чем статистически значимое повышение уровня НЕ-4 [1, 2], в связи с чем чувствительность НЕ-4 на ранних стадиях рака яичников (РЯ) значительно превышала таковой показатель для СА-125 (82,7% против 45,9% соответственно) [2]. Кроме того, в ряде исследований было показано, что уровень НЕ-4, превышающий границы референсных значений, выявлялся почти в 50% случаев РЯ с показателями СА-125, не превышающими дискриминационный уровень (ДУ) [1, 2].
НЕ-4 является продуктом гена WFDC2 (WAP four-disulfide core domain protein 2) и относится к семейству кислых белков с предполагаемыми свойствами ингибитора трипсина [3]. Исследования, посвященные гену WFDC2, единичны и разнородны по своей сути. В 2014 г. было продемонстрировано, что избыточная экспрессия WFDC2 в клетках эпителиальных ЗОЯ стимулирует опухолевый рост и прогрессирование заболевания [4]. В другом исследовании был замечен более высокий уровень экспрессии WFDC2 в высокодифференцированных карциномах яичников в сравнении с низкодифференцированными [5]. Таким образом, была установлена связь между повышенным уровнем экспрессии WFDC2 и более агрессивным клиническим течением заболевания [4, 5]. Ген WFDC2 значительно экспрессируется у пациенток с серозным эпителиальным раком яичников, что было установлено посредством интеграции данных полногеномных экспрессионных микрочипов [6]. При сравнении экспрессии гена WFDC2 в нормальной ткани яичника, неизмененных маточных трубах и образцах эпителиальных опухолей яичников, полученных во время первичных операций (до проведения химиотерапии), образцы эпителиальных ЗОЯ отличались значительно более высокой экспрессией по сравнению с нормальными яичниками (р=0,000016). Транскрипционная активность WFDC2 в образцах эпителиального РЯ и в нормальных маточных трубах была сопоставимой (р=1,00). Помимо этого, не было выявлено корреляции между повышенным уровнем НЕ-4 и высокой экспрессией гена WFDC2, несмотря на то, что оба показателя независимо коррелируют с неблагоприятным прогнозом и низкими показателями выживаемости, что стало неожиданным открытием, требующим дальнейшего анализа и объяснения [7]. Данные исследований о влиянии полиморфизмов гена WFDC2 на уровень опухолевого маркера в сыворотке крови, а также на развитие ДОЯ и ЗОЯ в отечественной и зарубежной литературе отсутствуют.
Цель исследования: выявить связь полиморфных вариантов (rs2239533, rs2072956) гена WFDC2 с наличием доброкачественных и злокачественных объемных образований яичников.
Материалы и методы исследования. Молекулярно-генетическое исследование было выполнено 95 женщинам европеоидного происхождения (55 пациенткам с объемными образованиями яичников (ООЯ) и 40 женщинам контрольной группы). В исследовании приняли участие 55 пациенток гинекологической клиники ФГБОУ ВО СибГМУ Минздрава России и ОГАУЗ «Томский областной онкологический диспансер», поступившие для хирургического лечения по поводу объемных образований яичников, а также 40 женщин, по результатам гинекологического осмотра и УЗИ ОМТ которых не было выявлено патологических изменений.
Протокол исследования одобрен Этическим комитетом ФГБОУ ВО СибГМУ Минздрава России (№ 4336 от 30.11.2015 г.), участниками исследования были подписаны информированные согласия.
Всем пациенткам проводились:
1) обследование согласно стандарту при объемных образованиях яичников (Приказ Министерства здравоохранения Российской Федерации (Минздрав России) от 01.11.2012 г. № 572н «Об утверждении Порядка оказания медицинской помощи по профилю “акушерство и гинекология” (за исключением использования вспомогательных репродуктивных технологий)»;
2) определение уровня онкомаркера НЕ-4 методом хемилюминесцентного иммуноанализа (ARCHITECT, Abbott);
3) выделение ДНК из цельной крови методом фенол-хлороформной экстракции по стандартной методике [8], определение полиморфизмов rs2239533 и rs2072956 гена WFDC2;
4) анализ результатов гистологического исследования операционного материала у пациенток основной группы;
5) статистическая обработка полученных данных с помощью компьютерной программы SPSS Version20.
Дизайн и синтез праймеров для молекулярно-генетического исследования осуществлялись компанией «ДНК-синтез» (г. Москва). Амплификация проводилась в автоматическом термоциклере Real-time CFX Connect (Bio-Rad) по программе для проведения ПЦР в «реальном времени» согласно инструкции производителя праймеров. Программа амплификации включала предварительную денатурацию при 95°С в течение 3 минут с последующими 40 циклами отжига при температуре 95°С (20 секунд), элонгации цепи при 55°С (30 секунд) и денатурации при 72°С (40 секунд).
С целью статистической обработки материалов исследования были сформированы базы данных в формате таблиц SPSS. Проверка данных на подчинение нормальному закону распределения проводилась с использованием критерия Шапиро–Вилка. Для описания количественных данных, имеющих нормальный закон распределения, использовалось среднее + стандартное (среднеквадратичное) отклонение (М ± σ). Описание данных, не имеющих нормальный закон распределения, проводилось с помощью медианы и квартилей (Мe [Q25; Q75]). Проверку соответствия наблюдаемых частот генотипов исследуемых полиморфизмов генов ожидаемым их частотам при соответствии равновесию Харди–Вайнберга проводили с помощью критерия χ2 с поправкой Йетса. Для сравнения частот аллелей и генотипов в группах исследования использовали χ2 или точный тест Фишера (в случаях, когда наблюдений по крайней мере в одной из ячеек таблиц сопряженности было менее 5). Для выявления межгрупповых различий применялся непараметрический критерий Манна–Уитни. Об ассоциации разных генотипов с наличием ДОЯ или ЗОЯ судили по величине отношения шансов (Odds Ratio (OR)) с расчетом 95%-ного доверительного интервала. При OR<1 судили об отрицательной связи между признаками, при OR>1 – о положительной их связи. Критический уровень значимости (р) при проверке статистических гипотез принимался равным 0,05. Чувствительность (SE) опухолевого маркера рассчитывалась по формуле: SE = TP / D– х 100%, где TP – истинно положительные результаты исследования, D– – количество больных. Специфичность метода (SP) рассчитывалась по формуле: SP = TN / D х 100%, где TN – количество истинно отрицательных результатов исследования, D – количество здоровых пациентов.
Результаты исследования и их обсуждение. Основную группу исследования составили 55 пациенток с объемными образованиями яичников в возрасте от 19 до 79 (48,5+2,2) лет. В репродуктивном периоде находились 27 (49%) участниц исследования, в постменопаузальном – 28 (51%). В основной группе по результатам гистологического исследования операционного материала было диагностировано 38 (69,1%) ДОЯ и 17 (30,9%) ЗОЯ. Преимущественное распространение (74,6%) в основной группе исследования имели эпителиальные опухоли яичников, помимо этого, были верифицированы опухоли стромы полового тяжа (3,6%), герминогенные опухоли (9,1%), а также опухолеподобные поражения и опухолевидные процессы яичников (12,7%).
Уровень опухолевого маркера НЕ-4 у пациенток основной группы исследования варьировал от 12,6 до 1500 (47,2 [36,0; 87,7]) пмоль/л. У пациенток репродуктивного возраста в сыворотке крови были определены концентрации онкомаркера НЕ-4 от 12,6 до 922 (40,4 [32,7; 68,0]) пмоль/л (ДУ – 70 пмоль/л), у женщин с ООЯ в постменопаузе – от 37,3 до 1500 (56,6 [43; 308,3]) пмоль/л (ДУ – 140 пмоль/л). В основной группе исследования значения НЕ-4 превышали верхнюю границу референсного интервала у 10 пациенток, у 9 из которых при гистологическом исследовании послеоперационного материала был подтвержден РЯ, у 1 женщины – фолликулярная киста яичника в сочетании с кистой желтого тела. Таким образом, чувствительность опухолевого маркера НЕ-4 в основной группе проведенного нами исследования составила 52,9% при специфичности 97,4%.
Ложноотрицательные результаты определения НЕ-4 были зарегистрированы у 8 (47,1%) пациенток с ЗОЯ, у которых были идентифицированы следующие типы опухолей: серозная карцинома в постменопаузе (n=4), муцинозная карцинома в репродуктивном возрасте (n=3), светлоклеточная карцинома в постменопаузе (n=1). В ранее опубликованных исследованиях уже было показано, что в сыворотке крови пациенток с эндометриоидными и светлоклеточными вариантами аденокарцином яичников, а также с муцинозным типом РЯ определяется низкая концентрация НЕ-4, что связано с источником происхождения вышеперечисленных опухолей [9–11].
В контрольную группу вошли 40 женщин в возрасте от 21 до 78 (50,5 [24,3; 60,0]) лет, из которых 20 (50%) – репродуктивного возраста, 20 (50%) – постменопаузального. Значения онкомаркера НЕ-4 в крови пациенток контрольной группы варьировали от 22,4 до 84,9 (40,2 [35,9; 52,3]) пмоль/л. Для пациенток репродуктивного периода были характерны уровни НЕ-4 от 22,4 до 50,2 (36 [31,6; 41,0]) пмоль/л, для женщин после наступления менопаузы – от 37,7 до 84,9 (51 [40,1; 57,8]) пмоль/л. Ложноположительных результатов определения НЕ-4 в контрольной группе исследования выявлено не было.
Для молекулярно-генетического анализа были выбраны полиморфные варианты гена WFDC2 (rs2239533, rs2072956), которые были изучены в двух выборках, дифференцированных по наличию/отсутствию ООЯ.
Частоты генотипов по обоим исследуемым нами полиморфизмам в основной и контрольной группах соответствовали равновесию Харди–Вайнберга (р>0,05).
При сравнительном анализе распространенности генотипов варианта rs2239533 гена WFDC2 нами выявлено статистически достоверное (χ2=4,671, p=0,031) повышение частоты встречаемости гомозиготного генотипа T/T (78,2%) и снижение частоты гетерозиготного генотипа T/С (20,0%) в основной группе по сравнению с контрольной группой (соответственно 57,5% и 42,5%) (рис. 1). По результатам расчета отношения шансов (OR) выявлено, что носительство генотипа T/T предрасполагало к наличию ООЯ (OR=2,649, (95% СI 1,081–6,487), p=0,042). Связи между генотипами и гистотипами ООЯ выявлено не было (p>0,05).
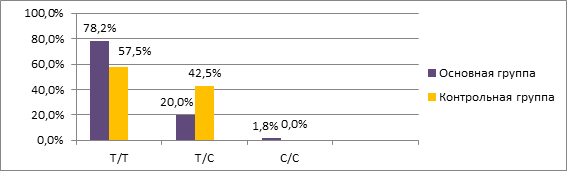
Рис. 1. Частота встречаемости генотипов полиморфизма rs2239533 гена WFDC2
у пациенток основной и контрольной групп
Распределение генотипов по варианту rs2072956 у пациенток основной группы было представлено в следующем порядке: максимальная частота регистрировалась для генотипа C/C-40 (72,7%), и по убыванию для генотипа С/G-14 (25,5%) и G/G-1 (1,8%). Среди пациенток контрольной группы генотип C/C встречался практически с той же частотой, что и в основной группе (72,5%, n=29), частота гетерозиготного генотипа C/G составила 27,5% (n=11) (рис. 2). Достоверных отличий при сравнении распределения частот генотипов по варианту rs2072956 гена WFDC2 между двумя группами выявлено не было (χ2=0,001, p=0,981), связи между генотипами и наличием ООЯ не обнаружено (OR=1, 011 (95% СI 0,406–2,521), p=0,466).
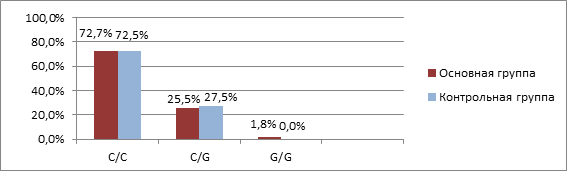
Рис. 2. Частота встречаемости генотипов полиморфизма rs2072956 гена WFDC2
у пациенток основной и контрольной групп
На втором этапе оценки влияния молекулярно-генетических факторов на развитие ООЯ основная группа была разделена на 2 подгруппы (1-я подгруппа – женщины с ДОЯ, 2-я подгруппа – пациентки с ЗОЯ).
Распределение генотипов для изученных полиморфных вариантов гена WFDC2 (rs2239533 и rs2072956) у пациенток с ДОЯ и ЗОЯ представлено на рисунках 3 и 4 соответственно.
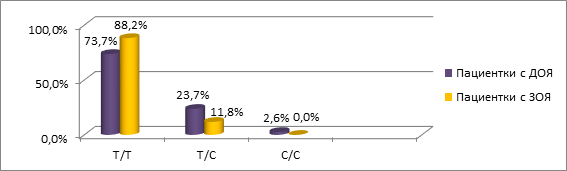
Рис. 3. Частота встречаемости генотипов полиморфизма rs2239533 гена WFDC2
у пациенток с ДОЯ и ЗОЯ
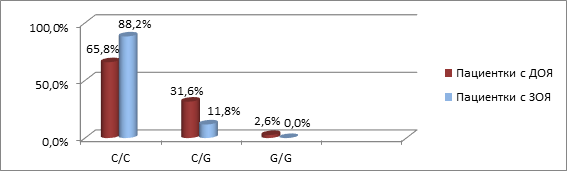
Рис. 4. Частота встречаемости генотипов полиморфизма rs2072956 гена WFDC2
у пациенток с ДОЯ и ЗОЯ
Статистически значимых различий при сравнении распределения генотипов у пациенток с ДОЯ и ЗОЯ не обнаружено (для rs2239533 χ2=1,458, р=0,228; для rs 2072956 χ2=2,983, р=0,085).
При сравнении частот генотипов варианта rs2239533 гена WFDC2 между подгруппами пациенток с ДОЯ/ЗОЯ и группой здоровых женщин выявлено повышение частоты генотипа T/T (88,2%) и снижение частоты генотипа T/С (11,8%) у женщин с ЗОЯ в сравнении с пациентками контрольной группы (57,5% и 42,5% соответственно; χ2=5,071, р=0,025). Генотип T/T полиморфного варианта rs2239533 гена WFDC2 являлся рисковым для развития ЗОЯ (OR=5,54 (95% СI 1,12–27,54), p=0,03).
Корреляций между уровнями онкомаркера НЕ-4 в сыворотке крови и генотипами по изученным полиморфизмам выявлено не было (p=0,153 для rs2239533, р=0,549 для rs2072956). Но было отмечено, что все пациентки, в сыворотке крови которых была выявлена концентрация опухолевого маркера НЕ-4, превышающая установленный ДУ, имели генотип T/T по полиморфизму rs2239533 и C/C по полиморфизму rs2072956.
Объем выборки проведенного нами исследования очень мал, однако полученные данные могут послужить толчком к дальнейшим более масштабным исследованиям, посвященным полиморфизмам гена WFDC2.
Заключение. В ходе молекулярно-генетического исследования было выявлено, что у пациенток с ООЯ в сравнении с группой здоровых женщин значимо преобладал генотип Т/Т полиморфного варианта rs2239533 гена WFDC2 (χ2=4,671, p=0,031). Последующий анализ, проведенный с разделением больных на подгруппы в соответствии с гистологическими вариантами ООЯ (доброкачественные/злокачественные), позволил выявить, что носительство генотипа Т/Т по варианту rs2239533 гена WFDC2 было ассоциировано с наличием злокачественных форм (OR=5,54 (95% СI 1,12–27,54), p=0,03). Полученные результаты требуют уточнения и дальнейшего изучения с увеличением объема выборки.



