Рак простаты (РП) является одним из самых распространенных онкологических заболеваний мужского населения в большинстве стран мира. В настоящее время населению доступны современные методы диагностики опухолей простаты, в связи с этим актуальность приобретает лечение местнораспространенных форм РП. Одной из таких методик является высокоинтенсивная сфокусированная ультразвуковая аблация простаты (HIFU - High Intensity Focused Ultrasound). Наравне с Hifu-терапией не теряет актуальность максимальная андрогенная блокада (МАБ), которая проводится орхэктомией или химической кастрацией. Для оценки эффективности проведенного лечения используют степень выраженности лечебного патоморфоза, то есть развитие стойких клинических и морфологических изменений в опухолевой ткани под воздействием лечения. Для оценки степени развития лечебного патоморфоза используют гистологическое и иммуногистохимическое исследование [1; 2]. Однако разные методы лечения аденокарциномы имеют свои особенности морфологических и иммуногистохимических изменений.
Цель: сравнить морфологические и иммуногистохимические изменения в аденокарциноме простаты после Hifu-терапии и МАБ.
Материалы и методы
Исследование проводили на материале, полученном от 90 пациентов с диагнозом ацинарная аденокарцинома простаты по Глисону 3+3=6 баллов, 3+4=7 баллов. 50 пациентам лечение аденокарциномы проводили МАБ, 40 пациентам - Hifu-терапией. МАБ осуществляли с помощью билатеральной орхэктомии или химической кастрации. До лечения пациентам проводили морфологическое и иммуногистохимическое исследование столбиков трансректальной биопсии простаты, после – материала, полученного при трансуретральной резекции простаты. Лечебный патоморфоз оценивали через 4-9 месяцев после лечения. Материал после фиксации в нейтральном формалине, проводки с этиловым спиртом и ксилолом заключали в парафин и окрашивали гематоксилином и эозином. Иммуногистохимические исследования проводили на срезах, с помощью стрептавидин-биотинового метода с использованием системы LSAB2 System, HRP (K0675) фирмы Daco. В данной работе мы использовали следующие антитела: Monoclonal Mouse Anti-Human Androgen Receptor Clone AR 441 - фирма Daco (разведение 1:50); Monoclonal Mouse Anti-Human Е cadherin Clon NCH-38 - фирма Daco (разведение 1:50); Monoclonal Mouse Anti-Human Ki67 Antigen Clone MIB-1 - фирма Daco (разведение 1:100); AMACR Rabbit Polyclonal Antibody RP 134 R - фирма Diagnoatic BioSystems (разведение 1:50); Monoclonal Mouse anti Bcl-2 oncoprotein - фирма Daco (разведение 1:50). Результаты реакций цитоплазматических и мембранных маркеров (AMACR, Вcl2, Ecad) оценивали полуколичественным способом по балльной шкале от 0 до 3 при помощи светового бинокулярного микроскопа MicrosMC100, с учетом выраженности реакции: 0 – отсутствие реакции, 1 – слабая реакция, 2 – умеренная реакция, 3 – выраженная реакция маркера. Результаты с ядерным антигеном (Andr) оценивали по системе подсчета histochemical score (Hs формула подсчета: histochemicalscore (Hs) = ∑ P (i) х i, где i - интенсивность окрашивания, выраженная в баллах от 0 до 3. P (i) – процент окрашенных клеток). Для определения индекса пролиферации экспрессии маркера Ki67 выполняли подсчет, учитывая процентное соотношение окрашенных/неокрашенных ядер клеток на 100 учтенных клеток в 10 репрезентативных полях зрения при увеличении х40.
Обработку данных проводили при помощи пакета программ статистической обработки результатов SSPS 13.0 for Windows. Тестирования полученных данных на нормальность распределения проводили тестом Колмогорова-Смирнова. При анализе результатов иммуногистохимической реакции для определения значимости различий между двумя зависимыми выборками (до и после лечения) мы использовали Т-критерий Вилкоксона.
Результаты
После лечения аденокарциномы Hifu-терапией преобладали фиброзные изменения. В течение первых 8 недель после лечения, в ткани простаты мы наблюдали обширные поля некроза и выраженную лимфоцитарную инфильтрацию, рис. 1А. Спустя 8 недель 70-90% всей площади материала занимала соединительная ткань, рис. 1Б. Среди соединительной ткани очагами располагались фрагменты железистой ткани. Железы чаще имели округлую форму и средний размер 80-120 мкм.
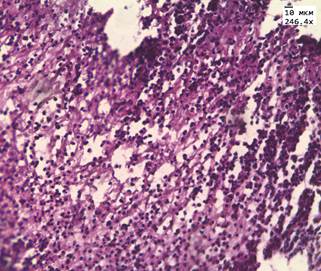 А
А 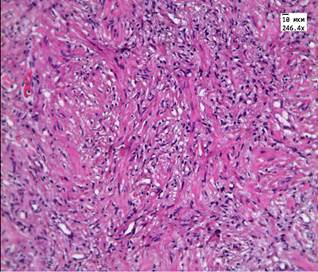 Б
Б
Рис. 1. А. Некроз и лимфоцитарная инфильтрация в аденокарциноме простаты через 14 дней после HIFU терапии. Окр. гематоксилин, эозин. (Ув. 250х) Б. Образование соединительной ткани в простате через 3 года после HIFU-терапии.
Окр. гематоксилин, эозин (Ув. х250)
У 10% пациентов (4/40) в строме наблюдали не специфическое гранулематозное воспаление с гигантскими многоядерными клетками. Эпителий желез во всех случаях был высоким, с неровным апикальным краем и дистрофическими изменениями в цитоплазме в виде розовой зернистости. В случаях, если до лечения у пациентов при гистологическом исследовании диагностировали простатическую интраэпителиальную неоплазию (ПИН), эпителий в железах после Hifu-терапии сохранял многослойное строение. Ядра в эпителии желез имели округлую форму, размер в среднем 7-13 мкм, ядрышки чаще визуализировались. По истечении 3 месяцев после Hifu-терапии в строме простаты появлялась лимфоцитарная инфильтрация, которая в 70% (28/40) носила очаговый характер, и в 30% (12/40) - диффузный.
У пациентов с ацинарной аденокарциномой простаты после МАБ при гистологическом исследовании материала с помощью окраски гематоксилином и эозином, в опухолевой ткани развивались следующие изменения: в цитоплазме - дистрофические изменения в виде розовой зернистости и оптически пустых вакуолей; размер ядра уменьшался (5-10 мкм), ядра становились гиперхромными, ядрышки не визуализировались. У 78% (39/50) пациентов опухоль теряла свое ацинарное строение и начинали преобладать участки солидного строения. У 98% (49/50) пациентов в строме была очаговая лимфоцитарная инфильтрация. В случаях, когда до лечения у пациентов при гистологическом исследовании диагностировали участки ПИН, через 4-5 месяцев после МАБ эпителий в большинстве участков терял свое многослойное строение за счет десквамации его в просвет желез.
При иммуногистохимическом исследовании с антителом к альфа-метилацил-КоА-рацемазе (AMACR) до лечения Hifu-аблацией у 30% (12/40) мы наблюдали выраженную цитоплазматическую реакцию данного маркера, у 70% (28/40) умеренную, слабая и отрицательная реакции отсутствовали. После Hifu-терапии у 27,5% (11/40) пациентов была выраженная реакция, у 25% (10/40) умеренная, у 25% (10/40) слабая, у 22,5% (9/40) пациентов реакция была отрицательной. При использовании Т-критерия Вилкоксона полученное эмпирическое значение T находится в зоне значимости. Таким образом, различия в уровнях выборок существенные.
До лечения МАБ у 68% (34/50) пациентов реакция данного маркера была выраженной, у 32% (16/50) умеренной, слабой и отрицательной не наблюдали. После лечения МАБ лишь у 6% (3/50) пациентов экспрессия оставалась на высоком уровне, у 38% (19/50) пациентов была умеренной, у 56% (28/50) реакция данного маркера была слабой. Сравнивая показатели групп до и после лечения МАБ, выяснили, что различия между группами существенны.
Для морфологической оценки пролиферативной активности опухолевых клеток мы использовали маркер Ki-67. До Hifu-терапии в аденокарциноме индекс пролиферации опухолевых клеток был во всех случаях на достаточно высоком уровне и колебался от 36% до 89% (медиана 60%). После Hifu-терапии индекс пролиферации снижался и находился в пределах от 0% до 20% (медиана 10%). Сравнивая показатели групп до и после лечения по критерию Вилкоксона, выяснили, что полученное эмпирическое значение T находится в зоне значимости, между группами существенные различия.
До лечения МАБ индекс пролиферации находился в пределах от 42% до 80% (медиана 62%). После МАБ индекс пролиферации также снижался и отмечался в пределах от 0% до 27% (медиана 15%). Сравнивая показатели групп до и после лечения, мы получили существенные различия.
При иммуногистохимической реакции с антителом к Всl-2 до Hifu-терапии у 60% (24/40) пациентов мы наблюдали выраженную цитоплазматическую реакцию, у 30% (12/40) умеренную и у 10% (4/40) слабую реакцию. После лечения Hifu-терапией данный показатель увеличивался: у 77,5% (31/40) пациентов реакция данного маркера была выраженной, у 22,5% (9/40) умеренной. Сравнивая показатели групп до и после лечения Hifu-терапией, определили, что различия в данных группах не существенные. До лечения МАБ у 55% (27/50) реакция данного маркера была выраженной, у 32% (16/50) умеренной, у 10% (5/50) слабой и у 4% (2/50) пациентов отрицательной. После лечения МАБ у 12% (6/50) пациентов экспрессия оставалась сильной, у 40% (20/50) пациентов была умеренной, у 36% - слабой (18/50) и у 12% (6/50) - отрицательной. Т-критерий Вилкоксона показал, что различия в уровнях выборок являются существенными (рис. 2).
Реакция антител к рецепторам андрогенов до Hifu-терапии у 70% (28/40) пациентов была выраженной (медиана Hs=189). Количество рецепторов к андрогенам после Hifu-терапии оставалось на высоком уровне (медиана Hs=145). По критерию Вилкоксона полученное эмпирическое значение находится в зоне незначимости. До МАБ показатели гистосчета у 68% пациентов были выше Hs100. Медиана гистосчета в этой группе составляла Hs=138. Через 4-6 месяцев после МАБ медиана Hs составила 86, показатель гистосчета колебался в пределах от 4 до 280. При анализе критерия Т полученное эмпирическое значение находится в зоне значимости, различия можно считать существенными.
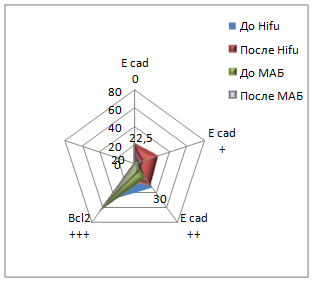
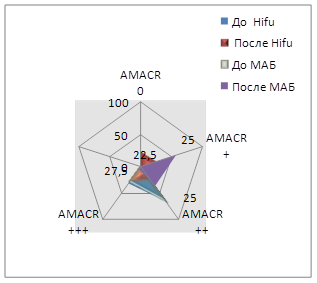
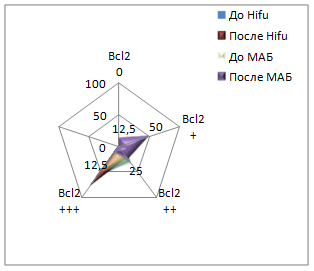
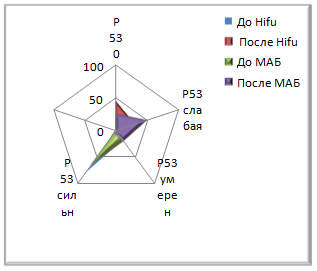
Рис. 2. Экспрессия иммуногистохимических маркеров до и после лечения
Обсуждение
Изучение лечебного патоморфоза аденокарциномы простаты при помощи обзорной окраски гематоксилином и эозином показало, что у всех пациентов после Hifu-терапии в ранние сроки преобладали поля некроза, а через 8 недель развивались выраженные фиброзные и дистрофические изменения опухолевых клеток, что согласуется с данными других авторов [3]. По схеме, предложенной Е.Ф. Лушниковым [4], данные изменения соответствуют 3 степени лечебного патоморфоза. После МАБ в аденокарциноме развивались дистрофические, атрофические изменения, вакуолизация цитоплазмы, однако практически во всех случаях сохранялась опухолевая ткань. У некоторых пациентов мы отмечали перестройку ткани опухоли, когда железистые структуры теряли свое ацинарное строение. Данные морфологические изменения соответствовали 0-1 степени лечебного патоморфоза. Другие авторы также выделяют сходные изменения в простате после МАБ [5; 6]. Таким образом, при обзорной методике окраски мы видим более выраженные морфологические изменения после Hifu-терапии, оценить данные изменения можно уже через 14 дней после лечения, тогда как после МАБ патоморфоз развивается в среднем через 4 мес. [7]. При иммуногистохимическом исследовании после Hifu-терапии существенно снижалась экспрессия онкомаркера простаты Amacr, маркера пролиферативной активности Ki67, определяющегося во всех фазах клеточного цикла, кроме G0 [8]; антитела к маркеру межклеточной адгезии Е-кадгерину. Первые два маркера указывают на выраженные структурные изменения в опухоли на фоне проведенного лечения, снижение агрессивности опухолевых клеток и подтверждают 3 степень лечебного патоморфоза. Снижение экспрессии маркера межклеточной адгезии увеличивает риск метастазирования и, вероятно, связан со специфическим действием высоких температур на межклеточные связи. После лечения аденокарциномы МАБ существенно снижалась экспрессия онкомаркера Amacr; регулятора апоптоза, антитела к Вс1-2; маркера пролиферации Ki67; антитела к рецепторам андрогенов. Снижение экспрессии онкомаркера Amacr и маркера пролиферации Ki67 указывает на снижение потенциала роста злокачественного новообразования, уменьшение экспрессии маркера Вcl-2, говорит о снижении выживаемости опухолевых клеток и снижении опухолевой прогрессии, снижение экспрессии антитела к рецепторам андрогенов указывает на снижение митогенного воздействия на окружающую строму и эпителиальные клетки. Таким образом, при иммуногистохимическом методе исследования лечебный патоморфоз после МАБ возрастает с 0-1 до 2-3 степени.
Заключение
Используя только базовую методику окраски, мы видим более выраженные морфологические изменения и лучший результат лечения после Hifu-терапии. Оценку патоморфоза и диагностику возможного рецидива рака после Hifu-терапии можно проводить в более ранние сроки, чем после МАБ. При изучении лечебного патоморфоза после Hifu-терапии, используя иммуногистохимическое исследование, мы подтвердили полученные нами морфологические изменения и выявили снижение потенциала роста аденокарциномы простаты. При иммуногистохимическом исследовании биопсийного материала после МАБ мы выявили существенное снижение потенциала роста и опухолевой прогрессии рака, уменьшение митогенного воздействия на окружающую строму и эпителиальные клетки. Таким образом, для оценки лечебного патоморфоза опухолей и эффективности проведенной терапии у пациентов после МАБ необходимо проведение иммуногистохимического исследования.



