В современных экономических условиях подготовка высококвалифицированных специалистов для промышленности приобретает особую актуальность. Направление подготовки «Энерго- и ресурсосберегающие процессы в химической технологии, нефтехимии и биотехнологии» является одним из приоритетных [1].
Учебный план направления 18.03.02 «Энерго- и ресурсосберегающие процессы в химической технологии, нефтехимии и биотехнологии» предполагает изучение студентами дисциплин химического блока в течение нескольких семестров. При этом освоение дисциплин формирует некоторые общие компетенции, такие как [2]:
ОПК-2: способность использовать основные законы естественно-научных дисциплин в профессиональной деятельности, применение методов математического анализа и моделирования, теоретического и экспериментального исследования;
ОПК-3: способность использовать основные естественно-научные законы для понимания окружающего мира и явлений природы.
Интегрированный подход к изучению дисциплин химического цикла позволяет формировать последовательно компетенции, получая при этом высокий образовательный результат [3; 4].
Сформированность этих общепрофессиональных компетенций позволяет в дальнейшем при изучении дисциплин профессионального блока способствовать лучшему освоению профессиональных компетенций, необходимых для осуществления производственно-технологической деятельности [5-7]:
ПК-2: способность участвовать в совершенствовании технологических процессов с позиций энерго- и ресурсосбережения, минимизации воздействия на окружающую среду.
Цель работы - продемонстрировать на примере дисциплин «Общая и неорганическая химия», «Физическая химия» и «Общая химическая технология» интегрированный подход к формированию компетенций различного уровня.
Материал и методы исследования
Общими разделами для этих дисциплин являются темы «Химическая термодинамика» и «Химическая кинетика». В рамках этих разделов демонстрируется принцип отбора задач для самостоятельной работы с постепенно повышающимся уровнем сложности и введением элементов профессионального контекста.
Результаты исследований и их обсуждение
При изучении курса «Общей и неорганической химии» в первом семестре студенты в разделе «Химическая кинетика» знакомятся с основными понятиями и кинетическими закономерностями: скорость гомогенной и гетерогенной реакций, константа скорости реакции, молекулярность реакции, закон действия масс, правило Вант-Гоффа. Решение задач по кинетике химических реакций является важной составляющей процесса обучения курса «Общей и неорганической химии». Предваряет решение задач проверка степени усвоения теоретического лекционного материала в форме входного контроля, который стимулирует самостоятельную подготовку студентов к занятиям [8]. На данном этапе обучения студенты решают задачи, в которых кинетические закономерности носят несколько упрощенный характер.
Пример 1. Во сколько раз изменится скорость прямой реакции
N2(г)+3Н2(г) = 2NH3(г), если давление в системе увеличить в 3 раза?
Решение.
1 этап – постановка задачи. Студент должен знать, что увеличение давления в системе или уменьшение объема системы приводит к увеличению концентрации всех реагирующих веществ во столько же раз. Студент анализирует уравнение реакции и определяет, что процесс гомогенный – концентрации всех реагирующих веществ входят в кинетическое выражение.
2 этап – поиск способов решения. По закону действия масс, до изменения давления скорость реакции выражалась уравнением: u1 = k•(С1(H2))3×С1(N2). При увеличении давления концентрация каждого из реагирующих веществ возрастет в 3 раза, Следовательно, теперь u2 = k (3·С1(H2))3×(3·С1(N2)) = 81k (С1(H2))3×С1(N2).
3 этап – поиск и анализ результатов. Находим отношение скоростей:
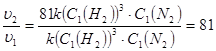 .
.
Ответ: при увеличении давления в системе в 3 раза скорость данной реакции увеличилась в 81 раз.
Задачи не являются сложными, но, несмотря на это, решение подобных кинетических задач позволяет приобрести и закрепить навыки постановки задачи, отыскания ее решения и анализа полученного решения. Полученные навыки в дальнейшем пригодятся при изучении курсов «Физическая химия» и «Общая химическая технология».
В разделе «Химическая термодинамика» в рамках дисциплины «Общая и неорганическая химия» студенты знакомятся с основами важнейшего раздела химии; вводятся новые понятия и функции: стандартная энтальпия, стандартная энтропия, энергия Гиббса, их изменение в ходе химических процессов. В расчетах термодинамических величин используется закон Гесса с допущением, что значения энтальпии и энтропии не зависят от температуры.
Пример 2. Определите, возможно ли при температуре 1500 К восстановление оксида железа (III) до свободного металла по схеме: Fe2O3(к)+3Н2(г) = 2Fe(к) +3Н2О(г).
Решение.
1 этап – постановка задачи. На этом этапе студент должен знать, что возможность или невозможность протекания той или иной химической реакции определяется знаком изменения энергии Гиббса ΔG.
2 этап – поиск способов решения. Студенты определяют с помощью таблицы термодинамических констант значение стандартных энтальпий и энтропий образований веществ реакции. По следствию из закона Гесса вычисляют значение
ΔН0298 и ΔS0298:
ΔН0298 = 3ΔН0298(Н2О) - ΔН0298(Fe2O3) = 3∙(-241,8) - (-882,2) = 156,8кДж
ΔS0298 = 2S0298(Fe) + 3S0298(Н2О) - S0298(Fe2O3) – 3S0298(Н2) = 2∙27,3 +3∙188,7 – 87,4 - 3∙130,5 = =141,8 Дж/К.
3 этап – поиск и анализ результатов. Температура не является стандартной, поэтому для расчета используется уравнение ΔG1500 = ΔН0298 – Т∙ ΔS0298, при этом зависимостью ΔН0и ΔS0 от температуры пренебрегают. Значение ΔS0298 выражаютв кДж/К:
ΔG1500 = ΔН0298 – Т∙ ΔS0298 = 156,8 - 1500∙0,1418 = - 55,9 кДж
ΔG1500< 0, поэтому восстановление оксида железа (III) до свободного металла 1500 К возможно.
В курсе «Физической химии» изучение разделов «Химическая термодинамика» и «Химическая кинетика» идет более расширенно. В разделе «Химическая термодинамика» в задачах на вычисление энтальпии реакции студент должен производить расчет по уравнению Кирхгоффа, в котором расчет теплового эффекта реакции проводится с учетом зависимости его от температуры.
Пример 3. Пользуясь табличными данными энтальпии образования веществ, вычислите тепловой эффект реакции 2H2 + CO → CH3OH при температуре 500 К, используя стандартные теплоты образования веществ и температурные коэффициенты теплоемкости.
Решение.
1 этап – постановка задачи. На этом уровне студент определяет: расчет энтальпии ведется с учетом зависимости теплоемкости от температуры или теплоемкость не зависит от температуры.
2 этап – поиск способов решения. На этом этапе студент производит поиск по справочникам или учебным пособиям [9], разработанным для дисциплины «Физическая химия», значений термодинамических данных заданной реакции, выписывает значения термодинамических коэффициентов. При этом он помнит, что значения необходимо брать с учетом фазового состояния вещества, для которого производится расчет. В зависимости от того, находится вещество в жидком, твердом или газообразном состоянии, итоговый результат может быть разным. Для удобства решения студенту рекомендовано составить таблицу 1, куда поместить все данные для расчетов, которыми впоследствии он будет пользоваться. При этом лучше в начале таблицы поместить продукты реакции, а затем исходные вещества.
Таблица 1
Термодинамические данные реакции получения метилового спирта
|
Вещество |
ΔH298 кДж/моль |
а |
в´10-3 |
с' ´105 |
с´10-6 |
|
Дж/К |
|||||
|
CH3OH |
-201,2 |
15,28 |
105,2 |
- |
-3,104 |
|
CO |
110,5 |
28,41 |
4,1 |
-0,46 |
- |
|
H2 |
0 |
27,28 |
3,26 |
0,502 |
- |
|
Δ |
-90,7 |
-67,69 |
94,58 |
-0,544 |
-3,104 |
3 этап – поиск и анализ результатов. Проводя анализ уравнений Кирхгоффа и поставленной задачи, студент выбирает уравнение Кирхгоффа в интегральной форме для решения.
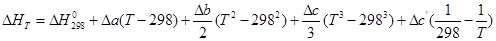
При этом изменения коэффициентов теплоемкости энтальпии в результате реакции можно сразу после расчетов записать в табл. 1. Далее полученные значения студент подставляет в уравнение и производит окончательные расчеты.
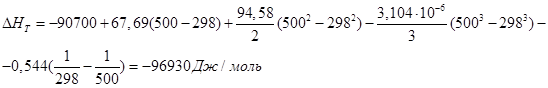
Решив поставленную задачу, студент может сделать вывод о том, что с увеличением температуры энтальпия реакции увеличивается.
В разделе «Химическая кинетика» согласно поставленной задаче студент второго курса, изучающий дисциплину «Физическая химия», имеет знания для определения порядка реакции. Он способен не только определить порядок реакции по молекулярности, но и двумя способами: интегральным и дифференциальным. Примеры таких заданий решаются студентами на практических занятиях, а также включены в контрольную работу.
Самостоятельная работа в курсе «Общая химическая технология» предусматривает решение задач по разделам «Химическая термодинамика» и «Химическая кинетика», содержание которых позволяет формировать не только общепрофессиональные, но и профессиональные компетенции, необходимые для осуществления производственно-технологической деятельности. В целом изучение данной дисциплины направлено на изучение важнейших закономерностей химико-технологического процесса, и, что не менее важно, должно дать навыки анализа и оценки химического производства, представление о способах управления химико-технологическими процессами, а задания для самостоятельной работы включают уже и профессиональный контекст.
В рамках задания студенту предлагают провести термодинамический анализ и построить кинетическую модель химической реакции, которая положена в основу реально существующего крупнотоннажного процесса в нефтехимической промышленности или промышленности основного органического синтеза.
Пример 4. Для реакции CH≡CH + HCl →CH2=CHCl рассчитать основные термодинамические функции и константу равновесия для заданного температурного интервала [10]:
Температурный интервал, °С: 0-300; шаг изменения температуры, °С: 30.
1 этап – постановка задачи. Проведение термодинамического анализа реакции заключается в расчёте основных термодинамических функций и константы равновесия для исследуемой химической реакции в заданном температурном интервале.
2 этап – поиск способов решения. При расчете используют формулы примера 3, а также следующие зависимости:
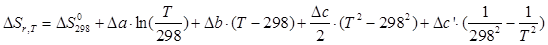
ΔGºr,T = ΔHºr,T - T·ΔSºr,T.
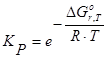
Приведенные закономерности уже знакомы студенту из предшествующих курсов, также им освоены навыки работы с таблицами стандартных термодинамических величин.
3 этап – поиск и анализ результатов. Результаты расчетов термодинамических функций и константы равновесия представляют в виде табл. 2.
Таблица 2
Результаты расчетов термодинамических функций и константы равновесия
|
Т, К |
ΔHºТ Дж/моль |
SºТ, Дж/(моль× К) |
ΔGºТ Дж/моль |
lnKp |
Kp |
|
273 |
-171528,99 |
-122,65 |
-138046 |
60,82 |
2,594E+26 |
|
303 |
-171736,87 |
-123,65 |
-134271 |
53,30 |
1,406E+23 |
|
333 |
-171831,52 |
-124,15 |
-130488 |
47,13 |
2,946E+20 |
|
363 |
-171809,83 |
-124,25 |
-126707 |
41,98 |
1,712E+18 |
|
393 |
-171668,65 |
-124,00 |
-122937 |
37,63 |
2,19E+16 |
|
423 |
-171404,84 |
-123,45 |
-119185 |
33,89 |
5,227E+14 |
|
453 |
-171015,26 |
-122,64 |
-115459 |
30,66 |
2,06E+13 |
|
483 |
-170496,76 |
-121,60 |
-111766 |
27,83 |
1,223E+12 |
|
513 |
-169846,20 |
-120,34 |
-108110 |
25,35 |
1,019E+11 |
|
543 |
-169060,42 |
-118,90 |
-104497 |
23,15 |
1,129E+10 |
|
573 |
-168136,29 |
-117,28 |
-100933 |
21,19 |
1,590E+09 |
Анализ полученных результатов заключается в следующем: студент делает вывод о том, является ли данная реакция в данном температурном интервале экзотермической или эндотермической, самопроизвольной или не самопроизвольной, увеличивается или убывает константа равновесия. Такая информация позволяет определить оптимальный температурный интервал для проведения этого процесса. Для данного примера реакция во всем температурном интервале является экзотермической (ΔНT<0); протекает самопроизвольно (ΔGT<0); с повышением температуры константа равновесия уменьшается, но при этом даже при высоких температурах составляет значительную величину. Следовательно, определить оптимальную температуру процесса, основываясь только на расчете термодинамических функций, нельзя. Для окончательного выбора температуры необходимо провести кинетические расчеты.
Кинетические расчеты осуществляют с целью получения кинетической модели изучаемой реакции. Полученная кинетическая модель используется для расчета химических реакторов. Исходя из зависимостей концентрации вещества от времени с=ƒ(τ) и константы скорости реакции от времени к= ƒ(τ), получают идеализированную кинетическую модель процесса в форме уравнения:
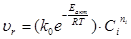
Для нахождения порядка реакции используют зависимость концентрации от времени. При этом применяют два метода: графический и интегральный. Для нахождения энергии активации Еакт используют графический и аналитический методы.
Подобные исследования являются неотъемлемым элементом при анализе и оценке химико-технологического процесса. Кроме того, делая вывод о полученных результатах, студент должен совокупно оценить влияние термодинамических и кинетических факторов на выбор оптимальных условий проведения процесса.
Заключение
В работе продемонстрировано, что интегрированный междисциплинарный компетентностный подход является одним из направлений повышения качества образования высшей школы. Такой подход позволяет получить знания, умения и навыки, необходимые в производственно-технологической деятельности, а также некоторых жизненных ситуациях.
Предложенный подход позволяет проектировать образовательные результаты целенаправленной подготовки студентов направления 18.03.02 «Энерго- и ресурсосберегающие процессы в химической технологии, нефтехимии и биотехнологии» в их профессиональной деятельности. Приобретенные знания и навыки позволят быть конкурентоспособными на рынке труда в современной экономической ситуации.



