Кишечная микрофлора является важнейшим составным компонентом сложной экологической системы организма человека. В настоящее время отмечается пристальное внимание к проблеме дисбиотических нарушений желудочно-кишечного тракта человека и способам их коррекции. Современные принципы восстановления нормального микробиоценоза включают широкий арсенал мероприятий, среди которых важная роль отводится применению биологических препаратов – пробиотиков [1, 2].
Лекарственные средства на основе лактобактерий находят широкое применение в составе комплексной терапии различных заболеваний и обеспечивают нормализацию микрофлоры кишечника. Устойчивость лактобактерий к действию ингибирующих факторов желудочно-кишечного тракта человека и антагонизм в отношении патогенных и условно-патогенных микроорганизмов, связанные с выработкой молочной кислоты, перекиси водорода, лизоцима и продуктов с высокой антибиотической активностью, определяют клиническую эффективность пробиотических препаратов на их основе [3].
Цель исследования
Оценка влияния иммобилизации на устойчивость к действию модельных сред, имитирующих условия пищеварения в желудке и кишечнике человека, и на антагонистические свойства лактобактерий.
Материал и методы исследования
В работе использовали производственный штамм лактобактерий Lactobacillus plantarum 8P-A3. В качестве сорбентов применяли гомогенат бурых водорослей, альгинат натрия, отруби пшеничные ферментированные, лигнин гидролизный, микрокристаллическую целлюлозу (МКЦ) и каолин. Для сравнения использовали препарат лактобактерин с неиммобилизованными клетками (АО НПО «Микроген», Россия).
Для проведения процесса иммобилизации раствор сорбента добавляли к нативной взвеси лактобактерий и перемешивали в течение 30 мин. После этого культуру иммобилизованных клеток выдерживали в течение 5 суток при температуре (5±3) °С и визуально оценивали полноту иммобилизации по характеру расслоения исследуемой взвеси с последующим определением количества живых бактерий в надосадочной жидкости. Расслоение взвеси на плотный осадок и прозрачную надосадочную жидкость свидетельствует о том, что большая часть лактобактерий находится в связанном состоянии.
Для получения сухой биомассы бактериальную суспензию разливали в металлические кассеты с толщиной слоя до 15 мм и подвергали лиофильному высушиванию в сублимационной установке ТГ-50 (Германия) в течение не менее 44 ч с предварительным замораживанием при температуре –(50±10) ºС. В качестве ксеропротектора использовали сахарозо-желатино-молочную среду. Лиофилизированную биомассу извлекали из кассет, протирали через сито с ячейками на 0,25 мм и хранили в герметично закрытых контейнерах при температуре (5±3) ºС.
При моделировании условий пищеварения использовали кислый раствор пепсина (3 г пепсина, 6 мл концентрированной соляной кислоты, до 1 л воды очищенной, рН 1,8±0,2), щелочной раствор панкреатина (3 г панкреатина, 15 г натрия гидрокарбоната, до 1 л воды очищенной, рН 8,2±0,2) и желчь медицинскую консервированную (ООО «САМСОН-МЕД», рН 7,2). Образцы сухой биомассы регидратировали в растворе натрия хлорида 0,9%-ном и инкубировали при (37±1) °С в кислом растворе пепсина в течение 30 мин, в щелочном растворе панкреатина и желчи – в течение 2 ч, контрольные образцы – в растворе натрия хлорида 0,9%-ном. Для определения показателя КОЕ до и после окончания инкубации в модельных средах использовали стандартную методику посева последовательных десятикратных разведений на плотную питательную среду МРС-4.
Определение антагонистических свойств образцов проводили с использованием методики отсроченного антагонизма [4] и теста подавления биолюминесценции индикаторного штамма Escherichia coli lum+ [5].
Экспериментальные образцы лактобактерий регидратировали раствором натрия хлорида 0,9%-ного и высевали по периметру чашки Петри бактериологической петлей на плотную среду МРС-5. Посевы инкубировали в аэробных условиях в течение 2 суток при температуре (37±1) °С. Индикаторную культуру штамма E. coli 157 выращивали на мясо-пептонном агаре в течение 1 суток в аэробных условиях, затем смывали раствором натрия хлорида 0,9%-ного, доводили оптическую плотность до 5 единиц по ОСО 42-28-86-86 и подсевали в виде «перпендикулярных штрихов» к выросшей культуре лактобактерий. Результаты учитывали через 1 сутки инкубации при температуре (37±1) °С по размеру зон подавления роста тест-штамма.
Для исследования антагонистической активности в экспресс-тесте угнетения биолюминесценции экспериментальные образцы и индикаторный штамм E. coli lum+ регидратировали раствором натрия хлорида 0,9%-ным. Регидратированную тест-культуру выдерживали не менее 30 мин при температуре (5±3) °С и доводили ее объем до 50 мл. При подготовке опытной пробы 0,5 мл исследуемого образца лактобактерий, разведенного раствором натрия хлорида 0,9%-ного в 10 раз, смешивали с 0,5 мл штамма-индикатора. При подготовке контрольной пробы к 0,5 мл индикаторной культуры добавляли 0,5 мл раствора натрия хлорида 0,9%-ного. Через определенные промежутки времени (10 мин, 1, 2, 4, 6 и 24 ч) проводили регистрацию уровня свечения тест-штамма с помощью люминометра «Биотокс-10М» (ООО «НЕРА-С», Россия), который автоматически вычислял индекс антагонистической активности (ИАА). ИАА представляет собой безразмерную величину, численно равную проценту подавления свечения индикаторного штамма по сравнению с исходным уровнем.
Обработку полученных данных проводили в программе MS Excel. Результаты представлены в виде средней величины и стандартной ошибки средней (М ± m). Различия считали статистически значимыми при p<0,05.
Результаты исследования и обсуждение
Полученные результаты исследования процесса иммобилизации клеток свидетельствуют о высокой эффективности всех использованных сорбентов – полнота связывания составила более 90%, наиболее эффективными являются носители на основе фукуса лиофилизированного, отрубей ферментированных и полифепана (табл. 1).
Таблица 1
Иммобилизация лактобактерий
|
Сорбент |
Концентрация сорбента в рабочем растворе |
КОЕ/мл |
Полнота иммоби- лизации, % |
|
|
Взвесь иммобилизованных клеток L. plantarum 8P-A3 |
Надосадочная жидкость |
|||
|
Ламинария лиофилизированная |
2,5% |
5,60×109 |
1,75×108 |
> 95 |
|
Ламинарии слоевища измельченные |
5% |
4,30×109 |
0,93×108 |
> 95 |
|
Фукус лиофилизированный |
5% |
5,35×109 |
1,05×108 |
> 98 |
|
Альгинат натрия |
2,5 % |
4,25×109 |
2,00×108 |
> 95 |
|
Отруби пшеничные ферментированные |
5% |
5,03×109 |
0,95×108 |
> 98 |
|
Лигнин гидролизный |
10% |
5,40×109 |
0,65×108 |
> 98 |
|
МКЦ |
15% |
4,45×109 |
1,00×108 |
> 95 |
|
Каолин |
15% |
6,50×109 |
1,90×108 |
> 95 |
|
Контроль (бакт. взвесь без сорбента) |
– |
5,80×109 |
1,90×109 |
– |
Следующим этапом исследований было изучение устойчивости иммобилизованных лактобактерий к действию модельных сред, имитирующих условия пищеварения в желудке и кишечнике человека. До экспозиции в модельных средах количество жизнеспособных лактобактерий в регидратированных образцах иммобилизованной биомассы и в контрольном образце составляло не менее 109 КОЕ/мл. После инкубации в кислом растворе пепсина показатель КОЕ снизился на 3 порядка в образцах с сорбентами на основе ламинарии лиофилизированной, термически высушенного порошка ламинарии и фукуса лиофилизированного. Сорбенты на основе альгината натрия, отрубей пшеничных ферментированных и лигнина гидролизного оказали менее выраженный протективный эффект – после действия кислого раствора пепсина количество жизнеспособных лактобактерий в этих образцах сохраняется на уровне не ниже 105 КОЕ/мл (снижение показателя КОЕ на 4 порядка). Выраженная чувствительность к действию кислого раствора пепсина отмечена в образцах биомассы с МКЦ, каолином и в контрольном образце без сорбента.
После 2-часовой экспозиции в желчи показатель КОЕ сохраняется на уровне 109 КОЕ/мл в образцах биомассы лактобактерий, иммобилизованных с применением лиофилизированного порошка ламинарии и фукуса, снижение выживаемости на один порядок отмечено в образцах с ламинарией и лигнином гидролизным.
Щелочной раствор панкреатина не оказал значительного влияния на выживаемость лактобактерий – уровень показателя КОЕ снизился на 1 порядок во всех испытуемых образцах после 2-часовой экспозиции (табл. 2).
Таблица 2
Выживаемость иммобилизованных лактобактерий в модельных средах
|
Сорбент |
Количество жизнеспособных клеток, КОЕ/мл |
|||
|
Исходное |
Кислый раствор пепсина, экспозиция 30 мин при (37±1) ºС |
Желчь, экспозиция 2 ч при (37±1) ºС |
Щелочной раствор панкреатина, экспозиция 2 ч при (37±1) ºС |
|
|
Ламинария лиофилизированная |
3,25(±1,19)×109 |
3,58(±1,06)*×106 |
2,10(±0,42)×109 |
2,67(±0,49)*×108 |
|
Ламинарии слоевища измельченные |
4,33(±1,29)×109 |
2,50(±0,65)*×106 |
3,50(±0,65)*×108 |
2,33(±0,61)*×108 |
|
Фукус лиофилизированный |
3,58(±0,59)×109 |
3,40(±0,91)*×106 |
1,85(±0,72)*×109 |
2,57(±0,33)*×108 |
|
Альгинат натрия |
4,18(±0,44)×109 |
0,93(±0,12)*×106 |
1,93(±0,05)*×107 |
1,80(±0,47)*×108 |
|
Отруби пшеничные ферментированные |
4,60(±0,70)×109 |
1,45(±0,22)*×105 |
1,40(±0,24)*×107 |
1,85(±0,32)*×108 |
|
Лигнин гидролизный |
3,67(±0,67)×109 |
1,60(±0,47)*×105 |
1,75(±0,30)*×108 |
2,22(±0,57)*×108 |
|
МКЦ |
3,33(±0,88)×109 |
1,53(±0,21)*×104 |
1,35(±0,24)*×107 |
1,90(±0,46)*×108 |
|
Каолин |
3,90(±0,42)×109 |
1,70(±0,26)*×104 |
2,88(±0,30)*×107 |
1,64(±0,15)*×108 |
|
Контроль |
4,00(±0,41)×109 |
2,88(±0,30)*×104 |
3,35(±0,47)*×107 |
2,00(±0,77)*×108 |
* – р<0,05 по сравнению с исходным значением
Защитные свойства носителей на основе ламинарии, фукуса и альгината натрия можно объяснить тем, что данные сорбенты, взаимодействуя с желудочным соком, образуют изотропный гель с включенными в него лактобактериями. Получаемая «гелевая капсула» защищает клетки от дальнейшего воздействия соляной кислоты и пепсина желудочного сока, сохраняя их выживаемость. В тонком кишечнике «капсула» растворяется, происходит высвобождение лактобактерий.
Лигнин гидролизный и отруби пшеничные ферментированные представляют собой растительные волокна, на поверхности которых сорбируются бактерии, что способствует их устойчивости к действию желудочного сока и желчи.
Результаты контроля антагонистической активности иммобилизованных лактобактерий методом «перпендикулярных штрихов» представлены в таблице 3.
Таблица 3
Антагонистическая активность иммобилизованных лактобактерий по отношению к E. coli 157
|
№ серии биомассы |
Сорбент |
Зона задержки роста тест-штамма, мм |
|
1 |
Ламинария лиофилизированная |
40,14±0,40 |
|
2 |
Ламинарии слоевища измельченные |
39,57±0,69 |
|
3 |
Фукус лиофилизированный |
41,17±0,70 |
|
4 |
Альгинат натрия |
39,33±0,95 |
|
5 |
Отруби пшеничные ферментированные |
39,17±1,08 |
|
6 |
Лигнин гидролизный |
40,33±0,99 |
|
7 |
МКЦ |
37,83±0,91 |
|
8 |
Каолин |
39,40±1,08 |
|
Контроль |
39,67±0,49 |
|
У всех образцов зона подавления роста тест-штамма превышала нормируемый минимум (20 мм) примерно в 2 раза. Статистически значимых различий между активностью иммобилизованных и свободных клеток не выявлено.
В экспресс-тесте подавления биолюминесценции индикаторного штамма E. coli lum+ все исследуемые образцы лактобактерий проявляли схожую динамику ингибирования свечения, которая характеризовалась последовательным увеличением ИАА, максимум которого (практически 100% подавления) наблюдали к 24 ч экспозиции, за исключением биомассы № 8 с сорбентом на основе каолина (рис. 1).
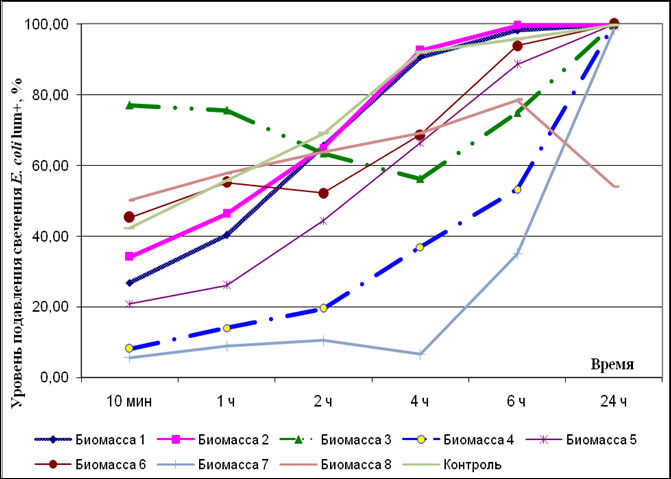
Влияние лактобактерий на биолюминесценцию E. coli lum+
Различия между образцами наблюдались в степени подавления свечения индикаторного штамма в течение 4 ч экспозиции. Низкий уровень подавления свечения (меньше 40%) отмечен у образцов иммобилизованных лактобактерий с сорбентом на основе альгината натрия и каолина. Средний уровень угнетения биолюминесценции (от 40 до 80%) проявляли образцы с сорбентом на основе фукуса, отрубей пшеничных ферментированных, лигнина гидролизного и каолина. Образцы лактобактерий, иммобилизованных на ламинарии, и лактобактерин (контроль) подавляли свечение тест-штамма на уровне выше 80%.
Заключение
Таким образом, эксперименты по изучению выживаемости лактобактерий в модельных средах показали, что иммобилизация клеток позволяет повысить резистентность лактобактерий к действию модельных сред, имитирующих секреты желудочно-кишечного тракта человека. Установлено, что выраженными протективными свойствами обладают сорбенты на основе бурых водорослей (ламинарии и фукуса).
Данные, полученные при использовании двух методических подходов, свидетельствуют о наличии выраженных антагонистических свойств у всех изученных образцов лактобактерий, а процесс иммобилизации клеток не оказывает негативного влияния на их биологическую активность.



