Артроз коленного сустава – распространенное заболевание, сопровождающееся болевым синдромом и потерей трудоспособности. Установлено, что в 7,5% случаев больные старше 55 лет испытывают болевой синдром в коленном суставе, подтверждающийся рентгенологическими признаками гонартроза, а в 2% случаев наряду с болевым синдромом развиваются двигательные нарушения, обусловленные ограничением функции, что становится серьезной медицинской, социальной и экономической проблемой [1]. В настоящее время эндопротезирование коленного сустава является одним из самых эффективных хирургических вмешательств, позволяющим значительно улучшить качество жизни пациентов с данным заболеванием, а также восстановить функцию сустава [2, 3]. Но, как и любое хирургическое вмешательство, эндопротезирование коленного сустава может сопровождаться осложнениями, такими как парапротезные переломы, первичная асептическая нестабильность компонентов эндопротеза [4, 5]. Однако наиболее серьезным осложнением, развивающимся в послеоперационном периоде после первичного эндопротезирования, является перипротезная инфекция, частота возникновения которой составляет от 0,3 до 1,5% [6, 7]. Ранняя диагностика этого осложнения является весьма затруднительной, что обусловлено ограниченной чувствительностью и специфичностью существующих биохимических, серологических и микробиологических маркеров, особенно в случаях субклинического латентного течения инфекционного воспалительного процесса. Применяемый комплекс клинико-лабораторных исследований преимущественно демонстрирует системный ответ организма пациентов на развивающийся инфекционный процесс, однако при этом никак не характеризует состояние локуса инфекции коленного сустава. Именно по этой причине поиск простого и информативного способа диагностики скрытой перипротезной инфекции является чрезвычайно актуальным. С этой целью в повседневной клинической практике с успехом применяется цитологический метод диагностики перипротезной инфекции, который позволяет уточнить вид воспаления, особенности клеточной реактивности и длительность его существования как типового патологического процесса [8, 9].
Известны исследования ряда отечественных авторов последних лет, которые широко используют цитологическое исследование жидкости, полученной при пункции параартикулярных тканей крупных суставов [10].
Цель исследования: изучить возможности цитологического метода в диагностике параимплантарного воспаления после первичного эндопротезирования коленного сустава.
Материалы и методы. В 2018 году на лечении в НИИТОН СГМУ им. В.И. Разумовского находились 20 пациентов с первичной нестабильностью компонентов эндопротеза коленного сустава, среди которых 11 (55%) – с асептической, 9 (45%) – с септической. Средний возраст пациентов составил 60±7,5 лет. Из них женщин было 16, мужчин 4.
Материалом для цитологического исследования явились пунктаты жидкостных образований области эндопротеза, полученные в предоперационном периоде, а также мазки-отпечатки кусочков параартикулярной ткани коленного сустава, полученные во время операции. Суставной аспират центрифугировали при 2000 оборотах/мин в течение 10 минут для получения осадка, из которого готовили цитологические препараты в количестве 5 от каждого пациента. Осадок суставного аспирата и мягкие ткани наносили на обезжиренные предметные стекла. Фиксацию и окрашивание препаратов производили с помощью набора фиксатора и красителей «Лейкодиф 200». Клеточный состав определяли подсчетом не менее 100 клеток при микроскопическом исследовании (микроскоп Revelation III SkyOptic) с использованием иммерсионного объектива (10×100).
Статистическую обработку полученных данных проводили с помощью пакета программ IBM SPSS 20 Statistics. Большинство наших данных не соответствовало закону нормального распределения, поэтому для сравнения значений использовали непараметрические критерии (U-критерий Манна–Уитни). Рассчитывали показатель достоверности р. Значения считали статистически достоверными при р<0,05.
Результаты
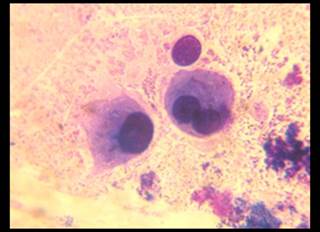
У пациентов с асептической нестабильностью компонентов эндопротеза в цитологических препаратах пунктатов параартикулярной ткани выявлено наличие единичных лимфоцитов, медиана количества которых составила 2 (1;2), а также синовиоцитов – 0 (0;1) (рис. 1). В мазках-отпечатках кусочков удаленной параартикулярной ткани фиксировали отсутствие фиброзных клеток и наличие единичных клеток крови.
 |
![]()
![]()
![]()
![]()
Рис. 1. Цитограмма пунктата у пациентов с асептической нестабильностью коленного сустава. Окраска «Лейкодиф 200». Об. х100
У 9 пациентов с септической нестабильностью компонентов эндопротеза коленного сустава при исследовании цитологических препаратов пунктатов параартикулярной ткани было выделено два типа цитограмм.
Первый тип цитограммы соответствовал картине острого воспаления и был диагностирован у 3 (15%) пациентов. В цитологических препаратах у них преобладали нейтрофильные лейкоциты, медиана значений которых составила 65 (62; 71), а также в небольшом количестве лимфоциты – 9 (8; 10), макрофаги – 1 (0;1) и гистиоциты – 1 (0;1) (рис. 2).
![]()

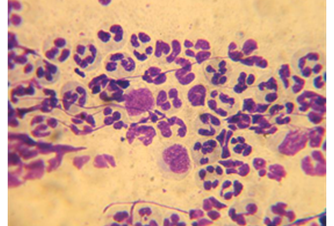
Рис. 2. Цитограмма острого воспаления у пациентов с септической нестабильностью коленного сустава. Окраска «Лейкодиф 200». Об. х100
Второй тип цитограммы соответствовал картине подострого воспаления, которое имело место у 6 (30%) пациентов. Во всех препаратах данного типа фиксировали уменьшение количества нейтрофильных лейкоцитов, медиана значений составила 39 (34; 42), увеличение количества лимфоцитов, медиана значений которых составила 20 (17; 23), а также гистиоцитов – 8,5 (7; 9) и макрофагов – 6 (5; 7) (рис. 3).
![]()
![]()
![]()

![]()
![]()
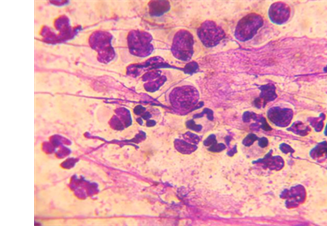
Рис. 3. Цитограмма подострого воспаления у пациентов с септической нестабильностью коленного сустава. Окраска «Лейкодиф 200». Об. х100
У этих же 9 пациентов с септической нестабильностью компонентов эндопротеза коленного сустава в мазках-отпечатках кусочков удаленных параартикулярных тканей фиксировали наличие единичных фиброцитов, медиана значений которых составила 1 (0; 1) (рис. 4).
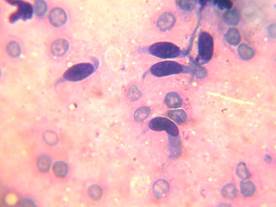
Рис. 4. Цитограмма мазков-отпечатков параартикулярной ткани у пациентов с септической нестабильностью коленного сустава. Окраска «Лейкодиф 200». Об. х100
При проведении сопоставления было выявлено, что в цитограмме острого воспаления у пациентов с септической нестабильностью коленного сустава по сравнению с цитограммой пациентов с асептической нестабильностью наблюдалось статистически достоверное увеличение медианы количества нейтрофильных лейкоцитов на 65 клеток (р1=3,54×10-9), лимфоцитов на 7 клеток (p1=3,54×10-9), присутствовали также единичные макрофаги 1 (0;1), гистиоциты 1 (0;1) (табл.).
В цитограмме подострого воспаления у остальных 6 пациентов отмечали статистически достоверное уменьшение медианы количества нейтрофильных лейкоцитов на 26 клеток (p2=6,05×10-8) по сравнению с цитограммой острого воспаления, однако оно оставалось выше на 39 клеток (p3=3,29×10-14) по отношению к цитограмме пациентов с асептической нестабильностью коленного сустава; статистически достоверное увеличение медианы количества лимфоцитов на 11 клеток (p1=3,54 ×10-9) по сравнению с цитограммой острого воспаления и на 18 клеток (p3=3,07×10-14) по сравнению с цитограммой пациентов с асептической нестабильностью (p3=3,07×10-14).
Отмечено, что медиана количества макрофагов увеличилась на 5 клеток (p2=6,05×10-8) по сравнению с цитограммой острого воспаления и на 6 клеток (p3=3,29×10-14) по сравнению с цитограммой пациентов с асептической нестабильностью; медиана количества гистиоцитов увеличилась на 7,5 клеток (p2=6,05×10-8) по сравнению со значениями при остром воспалении и на 8,5 клеток (p3= 3,29×10-14) по сравнению со значениями цитограммы пациентов с асептической нестабильностью (p3= 3,29×10-14).
Клеточные элементы воспаления у пациентов с нестабильностью коленного сустава после первичного эндопротезирования коленного сустава
|
Клеточный состав
|
Первичная нестабильность компонентов эндопротеза коленного сустава |
||
|
Асептическая, n = 11 |
Септическая, n = 9 |
||
|
Острое воспаление, n = 3 |
Подострое воспаление, n = 6 |
||
|
Нейтрофильные лейкоциты |
0 (0;0)
|
65 (62;71)
p1 = 3,54 ×10-9 |
39 (34;42)
p2 = 6,05×10-8 p3 = 3,29×10-14 |
|
Лимфоциты |
2 (1;2)
|
9 (8;10) p1 = 3,54 ×10-9 |
20 (17; 23) p2 = 6,47 ×10-8 p3 = 3,07×10-14 |
|
Макрофаги |
0 (0;0)
|
1 (0;1) р1>0,05 |
6 (5;7) p2 = 6,05×10-8 p3 = 3,29×10-14 |
|
Гистиоциты |
0 (0;0)
|
1 (0;1) р1>0,05 |
8,5 (7;9) p2 = 6,05×10-8 p3 = 3,29×10-14 |
|
Синовиоциты |
0 (0;1) |
0 (0;0) р1>0,05
|
0 (0;0) p2>0,05 p3>0,05 |
|
Фиброциты |
0 (0;0)
|
0 (0;1) р1>0,05
|
1 (0;1) р2>0,05 p3>0,05 |
Примечания: в каждом случае приведены медиана — Ме, нижний и верхний квартили (25%; 75%); р – показатель достоверности (двусторонний) количества элементов воспаления в цитограммах; p1 — показатель достоверности у больных с острым воспалением по отношению к данным, полученным при асептической нестабильности; p2 — показатель достоверности у больных с подострым воспалением по отношению к данным, полученным при остром воспалении; p3 — показатель достоверности у больных с подострым воспалением по отношению к данным, полученным при асептической нестабильности
Обсуждение. В цитологическом материале у пациентов с асептической нестабильностью компонентов эндопротеза фиксировали единичные синовиальные клетки, что свидетельствует о сохранении достаточного пула метаболически активной синовии, являющейся выстилкой параартикулярной ткани, клеточная реактивность которой минимальна в условиях отсутствия воспалительного процесса и обусловлена лишь ответом на частицы износа пар трения и разной степени выраженности механическим воздействием материалов на оставшиеся костные структуры и мягкие ткани.
В цитограмме острого воспаления у пациентов с септической нестабильностью коленного сустава наблюдали преобладание нейтрофильных лейкоцитов, что может говорить как об активации защитной реакции организма пациента в ответ на присутствие инфекционного агента, так и демонстрировать степень активности воспалительного процесса, даже в тех случаях, когда выделить возбудитель инфекции не представляется возможным по разным причинам. Появление макрофагов и гистиоцитов в цитограммах острого воспаления в свою очередь характеризует начало ограничения очага воспаления или переход его в хроническое течение [10].
В цитограмме подострого воспаления у этих же пациентов фиксировали нарастание лимфоцитов, что свидетельствовало о развитии процессов пролиферации и восстановлении поврежденной ткани, уменьшение же количества нейтрофильных лейкоцитов говорит об активном процессе купирования параимплантарного воспаления. Нарастание количества макрофагов и гистиоцитов в препаратах свидетельствовало об уменьшении активности подострого воспалительного процесса [11].
Выводы
1. Цитологический метод является доступным, высокоэффективным исследованием биологического материала, полученного из параартикулярной ткани области эндопротеза коленного сустава.
2. У пациентов с асептической нестабильностью эндопротеза коленного сустава в цитологических препаратах элементы воспаления не обнаруживаются, однако выявление синовиоцитов свидетельствует об отсутствии воспалительной реакции параартикулярной ткани.
3. У пациентов с септической нестабильностью эндопротеза коленного сустава выявляются два типа цитограмм, соответствующих картинам острого или подострого воспаления.



