Рубцовые сужения пищевода, развившиеся в результате химических ожогов, относятся к числу тяжелых осложнений, приводящих к алиментарной дистрофии и инвалидизации пациентов. Поскольку химические ожоги пищевода преимущественно наблюдаются у лиц молодого и трудоспособного возраста, очевидна большая социальная значимость реабилитации данной группы больных [1]. Подавляющее большинство хирургов, занимающихся этой проблемой, считают, что большая часть рубцовых сужений может быть излечена различными методами бужирования пищевода [1-3]. Наиболее сложным и трудоемким в техническом исполнении продолжает оставаться лечение стенозов пищевода протяженностью более 4 см, нередко захватывающих два анатомических отдела. Частота перфораций пищевода при бужировании колеблется от 1 до 13% [3; 4]. В настоящее время одним из методов лечения послеожоговых стриктур является реканализация с помощью нитиноловых пищеводных стентов [5; 6].
В то же время стентирование пищевода может сопровождаться тяжелыми осложнениями: грануляционным стенозом, дегенеративными и дистрофическими изменениями в слизистой оболочке, врастанием протеза в стенку пищевода с последующим некрозом, образованием пролежней и свищей [7]. Таким образом, наиболее безопасным и более эффективным методом лечения продленных рубцовых сужений пищевода продолжает оставаться метод бужирования за направляющую нить через предварительно сформированную гастростому.
Цель: оптимизировать хирургическую тактику лечения рубцовых стриктур пищевода в зависимости от протяженности сужения.
Материалы и методы: в период с 1995 по 2017 год в 6-м хирургическом отделении находилось 232 больных с рубцовыми сужениями пищевода, обусловленными его химическим ожогом. Средний срок от факта ожога до развития клиники дисфагии составлял 60 ± 5,6 дня. У подавляющего большинства пациентов в качестве поражающего агента выступала щелочь. У всех пациентов отмечалась тяжелая дисфагия III-IV степени (табл. 1, 2).
Таблица 1
Распределение пациентов по степени выраженности дисфагии
|
Степень дисфагии |
III степень |
IV степень |
|
Всего: |
96 (41,4%) |
136 (58,6%) |
Таблица 2
Характеристика поражающего агента
|
Поражающий агент |
Кислота |
Щелочь |
|
Всего: |
34 (14,6%) |
198 (85,4%) |
На первом этапе всем 232 пациентам выполнялась рентгеноскопия пищевода с водорастворимым контрастом с целью оценки уровня и протяженности стеноза для дальнейшего выбора способа лечения (рис. 1). Для оценки протяженности стриктуры в работе использовалась классификация, представленная в методическом руководстве Л.М. Мяукиной (1999), в которой выделяют: короткие стриктуры (менее 4 см); протяженные стриктуры (5 см и более); субтотальные и тотальные стриктуры (поражающие более двух анатомических отделов пищевода или весь пищевод).
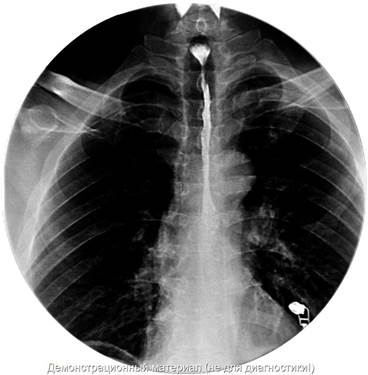
Рис. 1. Рентгенограмма пищевода с раствором Урографин 76% - продленная рубцовая стриктура пищевода до 12 см
143 (61,6%) больным с протяженностью стриктуры до 4 см выполнялось форсированное бужирование комплектом бужей Salivary-Gillard со сменой бужей от № 12 до № 33-36 по струне-направителю под контролем эндоскопа c внутривенной седацией с экспозицией 1 ч. После сеанса бужирования выполнялась контрольная эндоскопия пищевода, на следующий день - контрольная рентгеноскопия пищевода. В среднем для достижения стойкого клинико-рентгенологического эффекта за одну госпитализацию выполнялось 3 ± 1,25 сеанса бужирования пищевода.
Остальным 89 (38,4%) пациентам с продленными стриктурами формировалась точечная гастростома традиционным лапаротомным доступом, с учетом внутриорганного анастомозирования основных сосудистых коллекторов желудка, а именно левой желудочной артерии, правой желудочно-сальниковой артерии, левой желудочно-сальниковой артерии (патент № 2417764 от 10.05.2011) для сохранения вышеописанной магистрали и возможного использования желудка в целях эзофагогастропластики при необходимости, с последующим форсированным бужированием за направляющую нить (рис. 2). Направляющая нить при этом фиксировалась к гибкому проводнику-направителю диаметром 0,025 Fr и проводилась антеградно по инструментальному каналу эндоскопа вслед за проводником, где выводилась через гастростому. Бужирование выполнялось комплектом термопластичных бужей со сменой диаметров от № 9 до № 30-38 с экспозицией последнего бужа не менее 1 ч. Также для достижения положительного клинико-рентгенологического эффекта в среднем за одну госпитализацию проводилось 3 ± 1,5 сеанса бужирования пищевода. Средний срок бужирования составлял 12 ± 1,3 мес. с периодичностью 2-3 мес.
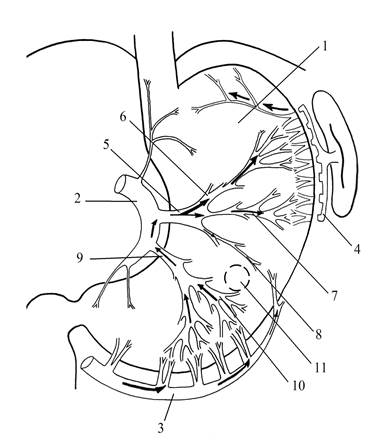
Рис. 2. Локализация гастростомического отверстия с учетом внутриорганной сосудистой магистрали в мобилизованном желудке: 1 - передняя стенка желудка; 2 - левая желудочная артерия; 3 - правая желудочно-сальниковая артерия; 4 - левая желудочно-сальниковая артерия; 5 - поперечная ветвь нисходящего отдела ЛЖА; 6 - восходящая ветвь поперечной ветви нисходящего отдела ЛЖА; 7 - средняя ветвь поперечной ветви нисходящего отдела ЛЖА; 8 - интраорганная нижняя ветвь первой ветви нисходящего отдела ЛЖА; 9 - вторая ветвь нисходящего отдела ЛЖА; 10 - интраорганная верхняя ветвь второй ветви нисходящего отдела ЛЖА; 11 - локализация гастростомического отверстия на передней стенке желудка
После чего через 12 мес. при отсутствии признаков дисфагии и алиментарной дистрофии, контрольной рентгеноскопии пищевода направляющая нить удалялась. Затем через 2 мес. выполнялась контрольная эзофагоскопия. Из 89 больных с продленными стриктурами 7 (7,9%) пациентам потребовалось восстановление точечной гастростомы при помощи двух эндоскопов (патент № 2570292 от 10.11.2015) вследствие потери нити с последующим форсированным бужированием пищевода в течение 8 мес. с положительным эффектом.
19 (21,3%) из 89 больных выполнена субтотальная резекция пищевода с пластикой желудочным трансплантатом ввиду неэффективности бужирования. Желудочный трансплантат формировался по принятой в клинике методике с учетом интраорганного анастомозирования основных сосудистых коллекторов желудка, что обеспечивало гарантированное, надежное питание проксимальной части желудочного трансплантата (рис. 3). Использование в качестве пластического материала для эзофагопластики желудочного трансплантата имеет лучший функциональный результат в отдаленном периоде, качество жизни таких больных, несомненно, лучше, чем среди пациентов, перенесших эзофагопластику целым желудком.
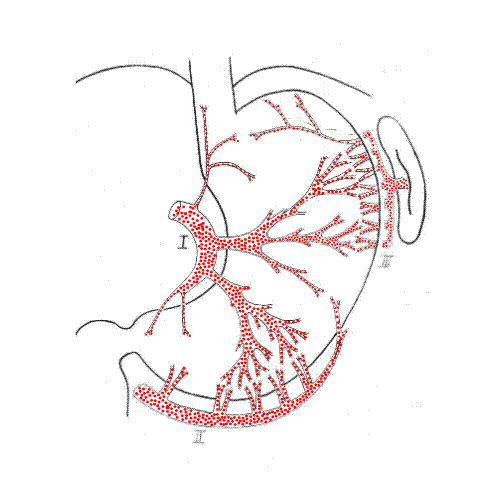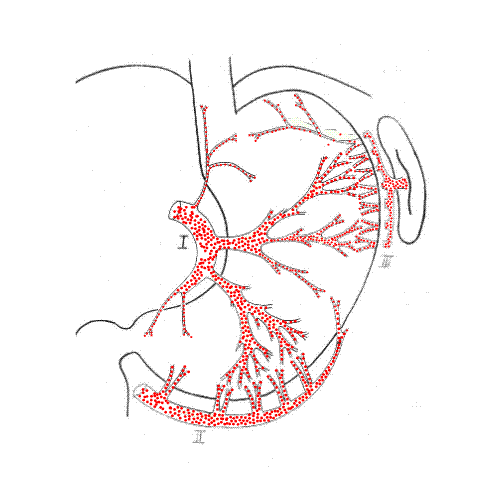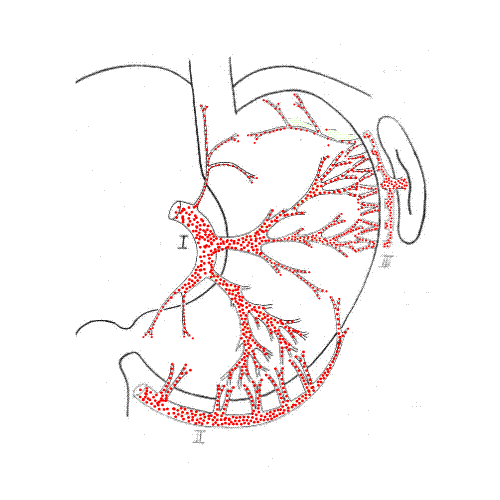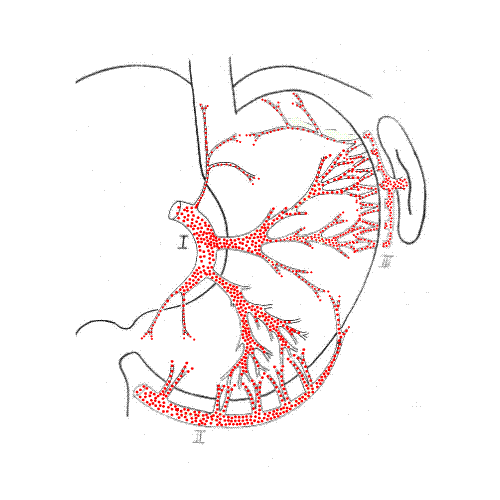
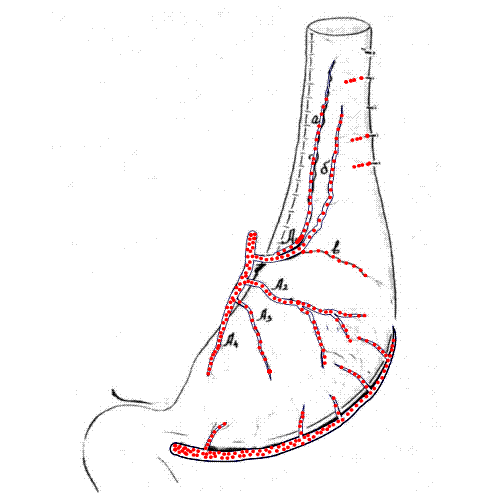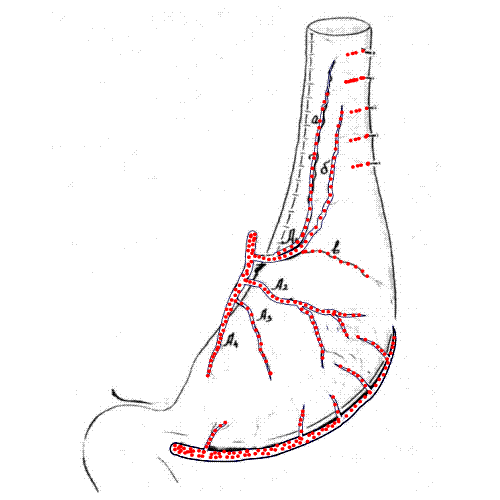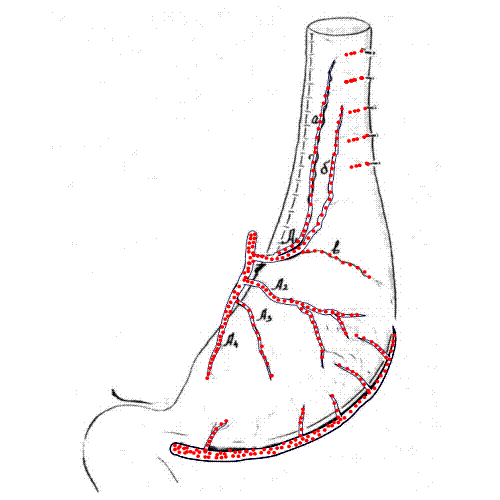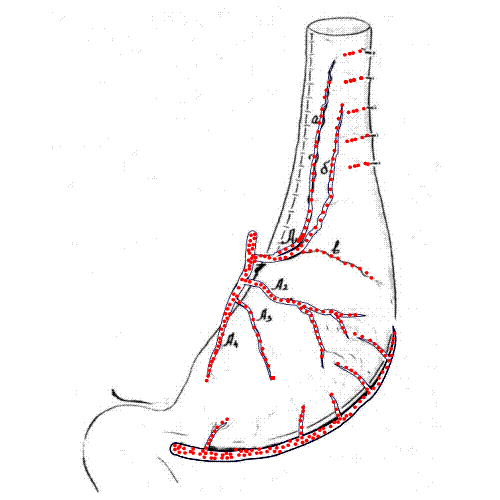
Рис. 3. Схема формирования и конечный вид желудочного трансплантата
В ходе формирования желудочного трансплантата всем 19 пациентам выполнялась дигитопилороклазия с целью обеспечения профилактики моторно-эвакуаторных расстройств и декомпрессии желудочного трансплантата. В желудочный трансплантат также проводился назогастральный зонд ниже пилорического жома. После этапа резекции пищевода, пораженного рубцовой стриктурой (рис. 4), желудочный трансплантат переводился в правую плевральную полость, в ложе удаленного пищевода, где, как правило, в куполе правой плевральной полости формировался инвагинационный пищеводно-желудочный анастомоз по К.Н. Цацаниди. Несостоятельности анастомоза не было выявлено ни в одном случае. После рентгенологического контроля целостности анастомоза моторно-эвакуационной функции ЖКТ, желудочный зонд удалялся, и пациент начинал раннее пероральное питание с 5 сут. послеоперационного периода (рис. 5). Средний послеоперационный койко-день 10 ± 1,78 сут.
Таблица 3
Характеристика методов лечения пациентов с рубцовыми стриктурами пищевода
|
Метод лечения |
Бужирование пищевода по струне-направителю |
Бужирование пищевода за направляющую нить |
Бужирование пищевода за направляющую нить с последующей его резекцией |
|
Кол-во пациентов |
143 (61,6%) |
70 (30,2%) |
19 (8,2%) |
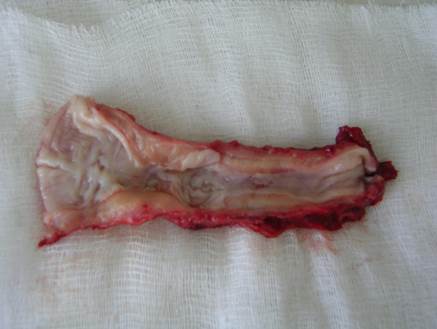
Рис. 4. Препарат грудного отдела пищевода, пораженного рубцовой стриктурой в результате химического ожога кислотой, протяженностью 9 см
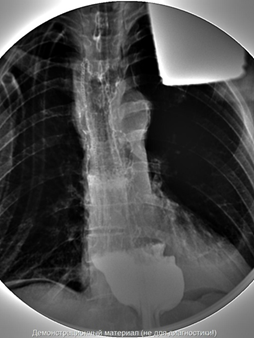
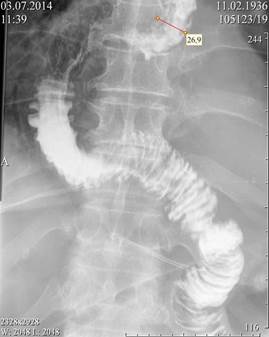
Рис. 5. Контрольная рентгеноскопия на 5-е сутки после резекции пищевода с пластикой желудочным трансплантатом
Результаты. Из всех 232 (100%) пациентов осложнений не было. У 138 (59,5%) пациентов после первого сеанса бужирования отмечен регресс дисфагии с III до II степени. У всех 232 (100%) отмечено восстановление проходимости пищи по пищеводу с дисфагией I степени уже после третьего сеанса форсированного бужирования. Имел место 1 летальный исход при форсированном бужировании за направляющую нить через предварительно сформированную гастростому у пациента с кахексией и нарастающей полиорганной недостаточностью. Летальность составила 0,43%. Энтеральное питание восстановлено в полном объеме у всех пациентов. Признаков нутритивного дефицита не наблюдалось.
Выводы
1. В случае наличия короткой рубцовой стриктуры пищевода оптимальным способом лечения следует считать форсированное бужирование пищевода по струне-направителю под эндоскопическим контролем.
2. При наличии протяженного рубцового стеноза пищевода методом выбора является формирование точечной гастростомы с сохранением желудочной интраорганной сосудистой магистрали, с последующим форсированным бужированием пищевода за направляющую нить.
3. Для восстановления ранее сформированной точечной гастростомы предпочтение следует отдать мини-инвазивным методикам.
4. При неэффективности форсированного бужирования методом выбора хирургического лечения является резекция пищевода с пластикой желудочным трансплантатом.



