Несмотря на значительные усилия, предпринимаемые международным сообществом, бурный рост заболеваемости сахарным диабетом (СД) является одной из важнейших проблем современного общества. По данным Международной федерации диабета, численность больных СД в мире за последние 10 лет увеличилась более чем в 2 раза и к концу 2017 года достигла 425 млн человек, согласно прогнозам экспертов, к 2045 году ожидается увеличение числа больных СД до 629 млн [1].
Известно, что одним из факторов риска для развития ряда онкологических заболеваний является диабет, в том числе для новообразований, связанных с желчевыводящими путями: рака печени, желчного пузыря, желчных протоков [2; 3]. Наиболее вероятными причинами этого могут быть развивающиеся при СД гипергликемия, инсулиновая резистентность, вторичная гиперинсулинемия и митогенный эффект инсулина, реализующийся при связывании его с рецептором инсулиноподобного фактора роста [4; 5].
Активное применение инновационных технологий в медицине обуславливает необходимость поиска новых терапевтических средств на основе многофункциональных наноструктур [6]. Наличие антиоксидантных свойств, биосовместимость и способность к плазмонному резонансу определяет перспективность использования золотых наночастиц (ЗНЧ) для лечения сахарного диабета и злокачественных новообразований [7; 8].
До настоящего времени недостаточно изученными остаются эффекты воздействия золотых наночастиц in vivo при развитии патологических процессов в организме, в том числе при злокачественных новообразованиях и сахарном диабете.
Цель исследования – оценить морфологические изменения в печени при внутривенном ведении золотых наностержней у лабораторных животных с перевитым раком печени на фоне аллоксанового диабета.
Материалы и методы
Экспериментальное исследование проводилось на 48 белых беспородных половозрелых крысах-самцах массой тела 250±20 г. Исследования с участием лабораторных животных выполняли согласно международным этическим нормам Европейской конвенции защиты позвоночных животных для экспериментальных и других научных целей (Страсбург, 1986) и «International Guiding principles for Biomedical Research Involving Animals» (2012).
В экспериментах применяли золотые наностержни (ЗНС), средние параметры длины и диаметра которых составили 41±8 и 10,2±2 нм соответственно. ЗНС были синтезированы в лаборатории нанобиотехнологии ИБФРМ РАН (г. Саратов). Определение геометрических параметров наностержней осуществлялось по трансмиссионным электронно-микроскопическим изображениям, полученным на электронном микроскопе Libra-120 (CarlZeiss, Germany). С целью увеличения биодоступности и биосовместимости золотые наностержни конъюгировали с полиэтиленгликолем PEG-SH (Nektar).
В эксперименте лабораторные животные были распределены на четыре группы – три опытные и одна контрольная, в каждой по 12 особей. В группе контроля 6 животным однократно внутривенно вводили по 2 мл раствора ЗНС. Животным первой опытной группы («рак печени») подкожно в области лопатки вводили по 0,5 мл 25% опухолевой взвеси в растворе Хэнкса штамма альвеолярного рака печени – РС-1. Животным второй опытной группы («диабет») для моделирования диабета внутрибрюшинно вводили аллоксан моногидрат (Sigma, США) в дозе 100 мг/кг. Уровень глюкозы в крови крыс измеряли с помощью глюкометра Accu-Chek Performa Roche (Швейцария). Животным третьей опытной группы («рак печени на фоне диабета») моделировали аллоксановый диабет, через 15 суток после введения аллоксана животным перевивали альвеолярный рак печени.
Из каждой опытной группы было выбрано по 6 животных, которые выводились из эксперимента по следующей схеме: в первой опытной группе на 30-е сутки после трансплантации опухоли; во второй – на 15-е сутки после инъекции аллоксана моногидрата; в третьей - на 45-е сутки после моделирования рака печени на фоне диабета. Оставшимся в эксперименте животным, в этот же день однократно внутривенно вводили по 2 мл раствора ЗНС c концентрацией золота 400 мкг/мл. Через сутки после введения оставшиеся животные контрольной и опытных групп выводились из эксперимента путем декапитации.
Для морфологического исследования ткань печени окрашивали c использованием стандартной методики гематоксилином и эозином. Для выявления углеводов в ткани использовали реактив Шиффа (ШИК-реакция). Для морфометрического исследования применяли систему анализа цифровых изображений на микровизоре медицинском µVizo-103. Статистическую обработку полученных данных проводили с использованием пакета статистических программ SSPS - 13.0. Проверку нормальности распределения значений в выборке проводили с помощью теста Колмогорова-Смирнова, в случае отличия распределения от нормального рассчитывали медиану и квартили и определяли показатель достоверности различий (Р) с использованием непараметрического критерия Манна-Уитни.
Результаты исследования
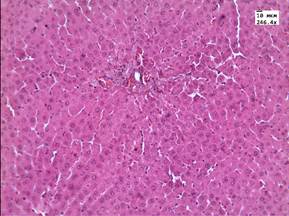
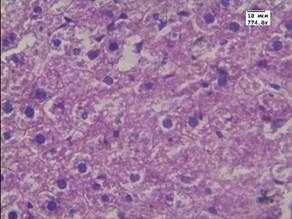
Проведенные нами ранее исследования [9] показали отсутствие значимых морфологических изменений в печени после однократного внутривенного введения ЗНС у здоровых животных (рис. 1А).
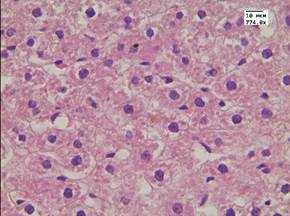
В печени животных с перевитым раком печени отмечались признаки нарушения кровообращения - выраженное полнокровие и отек, а также признаки повреждения паренхимы – отмечалась умеренная дистрофия гепатоцитов (рис. 1Б). Развитие данных морфологических изменений могло быть связано с интоксикационным воздействием развивающейся опухоли на организм животных.
|
А) |
Б) |
|
В) |
Г) |
|
Д) |
Е) |
Рис. 1. А - печень животного контрольной группы. Окр. Гематоксилин-эозин. Ув. 246.4.
Б - печень животного с перевитым раком. Окр. Гематоксилин-эозин. Ув. 774.
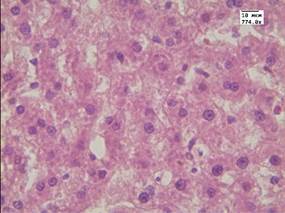
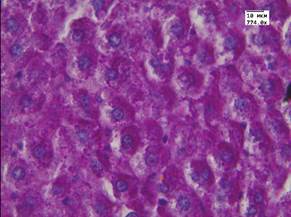
В - печень животного с моделированным диабетом. Окр. Гематоксилин-эозин. Ув. 774.
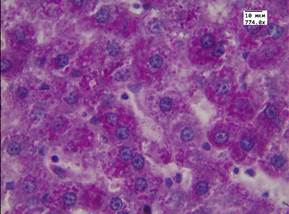
Г - печень животного с моделированным диабетом. Окр. Шик. Ув. 774.
Д - печень животного с раком печени на фоне диабета. Окр. Гематоксилин-эозин. Ув. 774.
Е - печень животного с раком печени на фоне диабета. Окр. Шик. Ув. 774.
В результате гистологического исследования установлено, что в группе животных с моделированным аллоксановым диабетом в печени развивались морфологические изменения, характерные для сахарного диабета (рис. 1В). В паренхиме наблюдалась углеводная дистрофия различной степени выраженности, в строме - полнокровие центральных вен и синусоидов. При окраске методом ШИК отмечалось уменьшение содержания гликогена в цитоплазме гепатоцитов по сравнению с контрольной группой животных (рис. 1Г). Данный факт может быть обусловлен снижением в печени тканевых запасов гликогена на фоне развивающегося диабета.
Ранее проведенные нами исследования [9] показали, что трансплантация рака печени меняет течение моделированного диабета. На 10-й день после трансплантации рака печени у животных регистрировалось снижение уровня глюкозы в крови до 5,7±0,7 ммоль/л. В печени наблюдались изменения, возникающие при сахарном диабете: более выраженная зернистая дистрофия гепатоцитов, вплоть до некроза отдельных клеток. При окраске методом ШИК в цитоплазме гепатоцитов отмечалась выраженная ШИК-положительная реакция в виде гомогенной зернистости, что свидетельствует об увеличении накопления гликогена в печени животных данной опытной группы по сравнению с группой животных с моделированным аллоксановым диабетом (рис. 1E). На фоне аллоксанового диабета регистрировалось замедление темпов роста перевиваемой опухоли, через месяц после трансплантации - масса опухоли у животных с раком печени на фоне диабета составила 17,6±2,3 г, что на 34% меньше по сравнению с первой опытной группой «рак печени» (26,9±3,1 г).
При морфологическом исследовании при окраске срезов гематоксилином и эозином ни в одной из опытных групп не было выявлено значимых морфологических изменений в печени после однократного внутривенного введения ЗНС.
Для более детальной оценки морфологических изменений в печени нами были проведены морфометрические исследования с использованием следующих показателей: количество гепатоцитов с дистрофическими изменениями; количество гепатоцитов в состоянии некроза; коэффициент нормализации паренхимы (КНП); количество непаренхиматозных элементов печени (НПЭ), в состав которых входили лимфоциты, клетки Купфера и клетки Ито; количество двуядерных гепатоцитов. Результаты количественного подсчета клеточных элементов печени представлены в таблице.
По данным морфометрического исследования, во всех опытных группах отмечались признаки повреждения паренхимы разной степени выраженности и признаки активации процессов пролиферации и дифференцировки иммунокомпетентных клеток и макрофагов.
В группе животных с аллоксановым диабетом отмечалось резкое увеличение количества гепатоцитов в состоянии некроза – до 49 [31;57], что в 3 раза превышает показатели в контрольной группе - 16 [13;19].
Выраженность некробиотических изменений в печени оценивали с помощью коэффициента нормализации паренхимы. Проведенные нами более ранние исследования подтвердили значимость данного показателя в оценке повреждающего воздействия ЗНЧ на морфологическое строение печени [10].
Результаты морфометрического исследования печени
|
Группы наблюдения |
Морфометрические показатели в поле зрения (х774). |
||||
|
Кол-во гепатоцитов с дистрофическими изменениями |
Кол-во гепатоцитов в состоянии некроза |
КНП |
Кол-во НПЭ печени |
Кол-во двуядерных гепатоцитов |
|
|
Контроль |
36[30;43] |
16[13;19] |
2,3 |
7[5;8] |
|
|
Контроль+ЗНЧ |
43[37;47] |
17[13;19] |
2,7 |
4[3;5] |
5[3;7] |
|
Диабет |
41[40;59] |
49[31;57]* |
0,83* |
13[10;17]* |
1[1;2]* |
|
Диабет+ЗНЧ |
32[25;35] |
37[33;39]* |
0,86* |
21[18;24]* |
1[0;2]* |
|
Рак печени |
41[40;47] |
42[36;43]* |
0,97* |
15[12;20]* |
2[1;3]* |
|
Рак печени+ЗНЧ |
34[27;40] |
36[29;41]* |
0,94* |
21[17;26]* |
3[2;4] |
|
Рак печени на фоне диабета |
36[29;41] |
34[27;40]* |
1,07* |
21[17;26]* |
3[2;4] |
|
Рак печени на фоне диабета+ЗНЧ |
30[28;32] |
34[28;40]* |
0,89* |
16[12;20]* |
2[1;3] |
*-p<0,05 достоверность отличия с контрольной группой.
КНП отражает степень повреждения паренхимы и рассчитывается как отношение количества гепатоцитов с дистрофическими изменениями к гепатоцитам в состоянии некроза на поле зрения (х774). При подсчете КНП отмечалось снижение данного показателя до 0,83, что в 3,3 раза меньше по сравнению с результатами, полученными в контрольной группе.
Влияние моделированного диабета на макрофагальную и лимфоцитарную систему печени оценивали в гистологических срезах с помощью количественного подсчета общего числа непаренхиматозных элементов (НПЭ) – лимфоцитов, клеток Купфера, клеток Ито в поле зрения (х774). В группе с моделированным аллоксановым диабетом наблюдалось увеличение НПЭ печени до 13 [10;17], что практически в 2 раза превысило показатели в контрольной группе и свидетельствует о наличии активирующего влияния на моноцитарно-макрофагальную систему.
Активность пролиферативных процессов в печени оценивали по количеству двуядерных гепатоцитов на поле зрения (х774). В контрольной группе животных количество двуядерных гепатоцитов составило 5 [3;6] в поле зрения. В группе с моделированным диабетом количество двуядерных гепатоцитов уменьшилось до 1 [1;2] в поле зрения. Однократное внутривенное введение ЗНС в группе с диабетом сопровождалось увеличением числа НПЭ печени на 57% до 21 [18;24].
В группе животных с раком печени отмечалось увеличение в 3 раза количества гепатоцитов в состоянии некроза – до 42 [36;43] и значительное снижение КНП по сравнению с контрольной группой. Число двуядерных гепатоцитов составило 2 [1;3]. При подсчете НПЭ печени в группе животных с перевитым раком печени обнаружено повышение общего числа НПЭ до 15 [12;20]. Однократное внутривенное введение животным данной группы ЗНС не приводило к существенным морфологическим изменениям в паренхиме, но способствовало увеличению общего числа НПЭ печени на 40% до 21 [17;26] в поле зрения.
В группе животных с перевитым раком печени на фоне моделированного аллоксанового диабета по сравнению с группой контроля отмечалось увеличение в два раза числа гепатоцитов в состоянии некроза – до 34 [27;40], и, как следствие этого, – снижение практические вдвое КНП – до 1,07. Подсчет количества НПЭ печени показал значительное увеличение данного показателя – до 21 [17;26], по сравнению с контрольной группой - 7 [5;8]. Число двуядерных гепатоцитов в данной опытной группе уменьшилось в два раза до 3 [2;4].
Однократное введение ЗНС в группе животных с перевитым раком печени на фоне моделированного аллоксанового диабета не сопровождалось достоверными изменениями в исследуемых показателях.
Обсуждение
При морфологическом исследовании с применением обзорных методов окраски значительных структурных изменений в печени через сутки после внутривенного введения ЗНС не было выявлено ни в одной из опытных групп. При морфометрическом исследовании во всех опытных группах отмечалось увеличение количества гепатоцитов в состоянии некроза, снижение КНП и повышение числа непаренхиматозных элементов печени (лимфоциты, клетки Купфера и клетки Ито). Характер выявленных нами морфологических изменений в печени у животных после внутривенного введения ЗНС согласуется с полученными нами ранее данными о морфологических изменениях в печени после внутривенного введения золотых наночастиц [11] и данными других авторов о накоплении золотых наночастиц в печени при внутривенном введении.
Semmler-Behnke и соавторы [12] отметили, что через 24 часа после внутривенного введения ЗНЧ размером 18 нм они накапливаются преимущественно в печени и селезенке. В исследовании Sonavane и соавторов [13] у мышей через 24 ч после внутривенного введения ЗНЧ различных размеров (15, 50, 100 и 200 нм) наибольшее накопление для всех типов наночастиц наблюдалось в печени. Похожее исследование было проведено De Jong и соавторами [14] у крыс, которым внутривенно вводили золотые наночастицы (10, 50, 100 и 250 нм), и через 24 часа наибольшее накопление ЗНЧ всех типов наблюдали в печени и селезенке, только 10 нм частицы наблюдались и в других органах. Таким образом, было установлено, что золотые наночастицы активно поглощаются макрофагами и накапливаются преимущественно в печени и селезенке, не оказывая повреждающего эффекта.
Заключение. В ходе исследования установлено, что во всех опытных группах животных с моделированными патологическими процессами однократное внутривенное введение покрытых полиэтиленгликолем золотых наностержней не вызывает развитие значимых морфологических изменений в печени, в качестве реакции на введение наночастиц отмечается увеличение общего числа макрофагальных и лимфоидных клеточных элементов печени. Полученные данные свидетельствуют об отсутствии повреждающего влияния золотых наностержней на паренхиму печени в условиях развивающегося опухолевого процесса на фоне диабета, что позволяет рекомендовать их к применению в целях экспериментальной онкологии и диабетологии.
Конфликт интересов
Авторы заявляют об отсутствии явных и потенциальных конфликтов интересов, связанных с настоящей статьей.
Исследование проведено в рамках реализации государственного задания Минздрава России. Работа по синтезу наночастиц поддержана грантами РФФИ 16-02-00054, 17-02-00075 и 18-52-7803.