Биохимический атипизм является одной из характерных особенностей опухолевых клеток [1]. В настоящее время актуальными являются научные исследования, посвященные изучению особенностей биохимического фенотипа клеток для обоснования молекулярных звеньев канцерогенеза и на этой основе разработки новых онкомаркеров для диагностики онкопатологии.
Рак шейки матки является одной из самых частых злокачественных опухолей среди женщин репродуктивного и трудоспособного возраста во всем мире [2]. Ранее было установлено, что в клетках малигнизированного цервикального эпителия возникает дисбаланс высших жирных кислот (ВЖК) в сторону преобладания насыщенных аналогов, а также увеличение доли жирных кислот с нечетным числом атомов углерода [3]. На фоне этого регистрируется высокий уровень TNF-α и его растворимого рецептора sTNF-RI [4].
Цель исследования: установить особенности взаимосвязей между величинами спектра ВЖК, уровнями TNF-α и sTNF-RI в клетках экзоцервикса при дис- и неопластической трансформации.
Материалы и методы исследования
В качестве образцов для исследования служили биоптаты шейки матки, полученные путем прицельной ножевой биопсии или в ходе проведения оперативного лечения. Средний возраст пациенток составил 38±8,26 года. Все обследуемые были информированы о проводимой работе и дали свое письменное согласие на участие в ней. Исследование проведено с соблюдением принципов Хельсинкской декларации Всемирной медицинской ассоциации (WMA Declaration of Helsinki, 1964, 2013 ред.) c согласия Локального этического комитета Читинской государственной медицинской академии.
В соответствии с данными гистологического исследования были выделены 2 сопоставимые клинические группы. I клиническая группа – больные с предраковыми заболеваниями шейки матки: цервикальная интраэпителиальная неоплазия III степени (20 женщин). II – пациентки с впервые выявленным плоскоклеточным раком шейки матки Iа - Ib стадии (28 пациенток). В каждой группе выделены 2 фрагмента исследования: А – локус злокачественной трансформации или предопухолевое поражение шейки матки; Б – интактная ткань без признаков злокачественного роста и предраковых изменений.
Образцы контрольной группы были взяты у 18 практически здоровых женщин в возрасте от 28 до 48 лет (34,5±6,5 года), проходивших диспансерное наблюдение по поводу неопухолевой патологии экзоцервикса, леченной ранее, ознакомленных с дизайном исследования и давших информированное согласие на участие в нем. Интактность цервикального эпителия подтверждена морфологически.
Для получения клеточной суспензии биоптат измельчали и гомогенизировали в гомогенизаторе Gentle MACS Dissociator (Германия) с пробирками С типа и с использованием набора реагентов Tumor Dissociation Kit (Германия). Затем суспензию клеток фильтровали через капроновый фильтр размером ячеек 30 мкм. Полученные клетки отмывали в среде RPMI-1640 с добавлением 10% телячьей сыворотки и стандартного набора антибиотиков.
Для изучения спектра ВЖК липиды экстрагировали методом J. Folch (1957) [5]. Спектр ВЖК анализировали на хроматографе «Кристалл-2000М» (Россия) с использованием плазменно-ионизационного детектора и капиллярной колонки FFAP (США).
Исследование уровня TNF-α и растворимого рецептора sTNF-RI производилось методом ИФА с использованием реагентов BenderMedSystems (Австралия) на микропланшетном ридере Multiscan DigiScan (Австрия) при длине волны 450 нм. Результаты оценивались автоматически с использованием программы IFAN.
Оцениваемый спектр высших жирных кислот: С14:0 – миристиновая, С14:1 – миристоолеиновая, С15:0 – пентадекановая, С15:1 – пентадекаеновая, С16:0 – пальмитиновая, С16:1 – пальмитолеиновая, С17:0 – маргариновая, С17:1 – гептадекаеновая, С18:0 – стеариновая, С18:1 – олеиновая, C18:2ω6 – линолевая, C18:3ω6 – γ-линоленовая, C18:3ω3 – α-линоленовая, С19:0 – α-метилстеариновая, С20:0 – арахиновая, C20:3ω6 – дигомо-γ-линоленовая кислота, C20:4ω6 – арахидоновая, C20:5ω3 – эйкозапентаеновая, C22:5 ω3 – докозапентаеновая кислоты.
Для выявления патогенетических взаимосвязей между изучаемыми параметрами проводился корреляционный анализ изучаемых величин с помощью метода ранговой корреляции Спирмена.
Результаты исследования
В представленных иллюстративных материалах отражены только статистически значимые зависимости.
В здоровых клетках шейки матки выявлены единичные корреляционные взаимосвязи между уровнем TNF-α и его растворимого рецептора sTNF-RI и величинами отдельных ВЖК. Так, между TNF-α и sTNF-RI были зарегистрированы отрицательные корреляции с пальмитолеиновой и арахидоновой кислотами, и положительные – с С18:0 (рис. 1).

Рис. 1. Схема корреляционных взаимосвязей между величинами ВЖК и уровнем TNF-α и его растворимого рецептора sTNF-RI в клетках шейки матки контрольной группы
В очаге «предрака» было выявлено большое количество корреляционных взаимоотношений между уровнем TNF-α и sTNF-RI, а также ВЖК-составом клеток экзоцервикса (таблица). Между содержанием исследуемого цитокина и концентрацией к С15:0, С17:0, а также С16:0 выявлены сильные прямые взаимосвязи. Аналогичная зависимость была характерна и для sTNF-RI. Что касается мононенасыщенных жирных кислот, то зарегистрированы отрицательные связи средней силы между пулом пальмитолеиновой и гептадекаеновой кислотами, с одной стороны, и уровнем TNF-α и sTNF-RI - с другой. Корреляционные взаимосвязи между исследуемым цитокином, его рецептором и концентрацией полиненасыщенных аналогов были многообразны: так, положительные сильные взаимосвязи были зарегистрированы с линолевой, линоленовой (ω3), дигомо-γ-линоленовой, эйкозапентаеновой, доказапентаеновой кислотами. Отрицательные корреляции TNF-α и sTNF-RI были выявлены с С18:3ω6 и С20:4 ω6.
В парадиспластических клетках среди насыщенных жирных кислот сильные положительные корреляции зарегистрированы между пулом С14:0, С16:0, С18:0 и С20:0, с одной стороны, и уровнем TNF-α и sTNF-RI - с другой. Значения пальмитолеиновой и олеиновой кислот были взаимосвязаны отрицательными связями с исследуемым цитокином и рецептором. Аналогичные взаимоотношения были характерны и для линолевой, линоленовой (ω3), арахидоновой, эйкозапентаеновой, докозапентаеновой кислот. Положительные корреляции были выявлены с концентрациями линоленовой (ω6) и дигомо-γ-линоленовой кислот (таблица).
Коэффициент корреляции Спирмена между величинами ВЖК, уровнем TNF-α и sTNF-RI в группе «предрак»
|
Параметры |
Очаг поражения |
Парадиспластический участок |
||
|
ВЖК |
TNF-α |
sTNF-RI |
TNF-α |
sTNF-RI |
|
C14:0 |
-0,58 |
-0,51 |
0,86 |
0,86 |
|
р=0,056 |
р=0,86 |
р=0,001 |
р=0,001 |
|
|
C15:0 |
0,93 |
0,96 |
-0,51 |
-0,51 |
|
р=0,001 |
р=0,001 |
р=0,78 |
р=0,52 |
|
|
C16:0 |
0,93 |
0,75 |
0,82 |
0,82 |
|
р=0,001 |
р=0,001 |
р=0,001 |
р=0,001 |
|
|
C16:1 |
-0,58 |
-0,51 |
-0,51 |
-0,51 |
|
р=0,021 |
р=0,04 |
р=0,04 |
р=0,04 |
|
|
C17:0 |
0,93 |
0,82 |
-0,51 |
-0,51 |
|
р=0,001 |
р=0,001 |
р=0,56 |
р=0,245 |
|
|
C17:1 |
-0,58 |
-0,51 |
0,04 |
0,12 |
|
р=0,021 |
р=0,04 |
р=0,52 |
р=0,46 |
|
|
C18:0 |
-0,58 |
-0,51 |
0,94 |
0,86 |
|
р=0,56 |
р=0,046 |
р=0,001 |
р=0,001 |
|
|
C18:1 |
0,48 |
0,80 |
-0,51 |
-0,51 |
|
р=0,489 |
р=0,135 |
р=0,04 |
р=0,04 |
|
|
C18:2ω6 |
0,93 |
0,74 |
-0,51 |
-0,51 |
|
р=0,001 |
р=0,001 |
р=0,04 |
р=0,04 |
|
|
C18:3ω6 |
-0,58 |
-0,51 |
0,86 |
0,84 |
|
р=0,021 |
р=0,04 |
р=0,001 |
р=0,001 |
|
|
C18:3ω3 |
0,93 |
0,92 |
-0,51 |
-0,51 |
|
р=0,001 |
р=0,001 |
р=0,04 |
р=0,04 |
|
|
С20:0 |
-0,58 |
-0,51 |
0,84 |
0,86 |
|
р=0,45 |
р=0,53 |
р=0,001 |
р=0,001 |
|
|
C20:3ω6 |
0,93 |
0,85 |
0,85 |
0,91 |
|
р=0,001 |
р=0,001 |
р=0,001 |
р=0,001 |
|
|
C20:4ω6 |
-0,58 |
-0,51 |
-0,51 |
-0,51 |
|
р=0,021 |
р=0,04 |
р=0,04 |
р=0,04 |
|
|
C20:5ω3 |
0,93 |
0,76 |
-0,51 |
-0,51 |
|
р=0,001 |
р=0,001 |
р=0,04 |
р=0,04 |
|
|
C22:5ω3 |
0,93 |
0,86 |
-0,51 |
-0,51 |
|
р=0,001 |
р=0,001 |
р=0,04 |
р=0,04 |
|
В очаге цервикального рака не было выявлено достоверных корреляций между исследуемыми показателями.
В паранеопластических клетках цервикального эпителия с уровнем TNF-α выявлены положительные взаимосвязи концентраций линолевой, линоленовой (ω6) кислот и отрицательные – линоленовой (ω3), дигомо-γ-линоленовой и докозапентаеновой кислот. Аналогичные корреляции были характерны и для sTNF-RI (рис. 2).
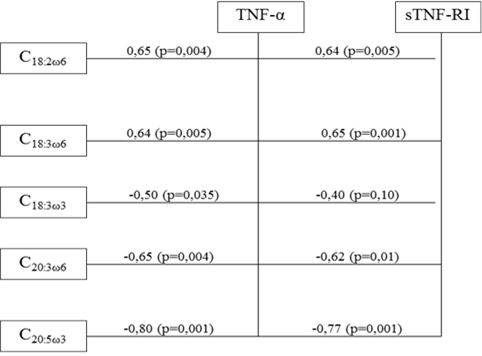
Рис. 2. Схема корреляционных взаимосвязей между величинами ВЖК и уровнем TNF-α и его растворимого рецептора sTNF-RI в паранеопластических клетках шейки матки
Обсуждение
Установленные корреляционные взаимосвязи между исследуемыми параметрами были многообразны, что определяется различными патогенетическими ролями высших жирных кислот в опухолевом процессе.
Наличие положительных корреляций между уровнем насыщенных жирных кислот (С15:0, С16:0, С17:0 в локусе «предрака» и С14:0, С16:0 и С18:0 в парадиспластических клетках) и величиной TNF-α и sTNF-RI при диспластической трансформации цервикального эпителия указывает на их провоспалительное действие. Известны механизмы активации синтеза цитокинов пальмитиновой кислотой. Во-первых, она является лигандом TLR-2 и TLR-4 (Toll-like receptor), в результате взаимодействия с которыми формируются инфламмасомы. Последние представляют собой мультимерный цитозольный белковый комплекс, посредством активации которого реализуется синтез провоспалительных цитокинов клетками иммунной системы [6]. Во-вторых, С16:0 активирует фактор транскрипции NF-κB, регулирующий синтез провоспалительных цитокинов [7]. В-третьих, пальмитат способен активировать протеинкиназу С, которая участвует в механизмах шеддинга мембранного рецептора TNF-α [8]. Следует обратить внимание на наличие положительных взаимосвязей между пулом С15:0, С17:0 и концентрацией исследуемого цитокина и его рецептора в очаге «предрака», что указывает на причастность жирных кислот с нечетным числом атомов углерода к цервикальному канцерогенезу.
Что касается мононенасыщенных жирных кислот, то наличие отрицательных корреляционных взаимосвязей с пулом TNF-α и sTNF-RI в исследуемых группах указывает на их противовоспалительное действие. Молекулярные механизмы, объясняющие данный факт, практически не изучены. Имеются данные, что олеиновая кислота способна предотвращать активацию NF-κB в культуре клеток, обработанных пальмитатом [9].
Влияние полиненасыщенных жирных кислот на уровень TNF-α и sTNF-RI неоднозначно, поскольку нами были выявлены как положительные, так и отрицательные взаимосвязи между ними.
Наличие обратных корреляций с пулом ПНЖК ω3 серии свидетельствует об их антивоспалительном потенциале. Установлено, что ПНЖК ω3 серии способны влиять на синтез провоспалительных цитокинов, реализуя несколько механизмов [10]. Известно, что представители данного класса жирных кислот способны блокировать продукцию TNF-α и ИЛ-6 путем связывания с GPR120 рецептором на поверхности макрофагов [11]. Группа ученых во главе с Y. Williams-Bey (2014) сообщили, что докозагексаеновая кислота ингибирует образование инфламмасом макрофагами путем блокирования транскрипционного фактора NF-κВ, тем самым препятствуя выработке провоспалительных цитокинов, таких как TNF-α, ИЛ-1β, ИЛ-2, ИЛ-6 и другие [6].
Вместе с тем наличие прямых корреляций TNF-α и sTNF-RI с линоленовой (ω3), эйкозапентаеновой, докозапентаеновой кислотами в локусе цервикального «предрака» указывают на их обусловленность. Вероятнее всего, это следует объяснять не самими эффектами ПНЖК, а их метаболитами, образовавшимися в результате 15-липоксигеназного преобразования, которые и проявляют провоспалительное действие.
Установленные прямые и обратные взаимосвязи между представителями ПНЖК ω-6 серии и пулом TNF-α и sTNF-RI подтверждают их активное участие в опухолевом и воспалительном процессе. Так, наличие отрицательных корреляций с арахидоновой кислотой свидетельствуют об активном участии ее метаболитов в синтезе провоспалительных цитокинов. Кроме того, полиеновые кислоты ω6 серии способны активировать ген NF-κB [12].
Выводы
Многообразные корреляционные взаимосвязи между исследуемыми параметрами обусловлены разными биохимическими фенотипами клеток цервикального эпителия в зависимости от ее морфологического статуса (здоровая, дисплазия или малигнизация), а также плейотропными эффектами ВЖК и TNF-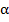 в цервикальном канцерогенезе. Наиболее патогенетически значимыми из них являются: положительные корреляции TNF-
в цервикальном канцерогенезе. Наиболее патогенетически значимыми из них являются: положительные корреляции TNF-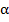 и sTNF-RI с уровнем насыщенных жирных кислот, отрицательные связи – с величинами мононенасыщенных аналогов и различные корреляции с полиненасыщенными жирными кислотами.
и sTNF-RI с уровнем насыщенных жирных кислот, отрицательные связи – с величинами мононенасыщенных аналогов и различные корреляции с полиненасыщенными жирными кислотами.
Выявленные корреляционные взаимоотношения между изучаемыми параметрами свидетельствуют о важной патогенетической роли высших жирных кислот, а также фактора некроза опухолей и его растворимого рецептора в процессах цервикального канцерогенеза.
Работа выполнена при финансовой поддержке гранта президента Российской Федерации для государственной поддержки молодых российских ученых МК-6143.2018.7.



