В настоящее время антрациклиновые антибиотики, в частности доксорубицин, остаются препаратами выбора в лечении многих онкологических заболеваний. Доксорубицин применяется как самостоятельно, так и в составе различных комбинаций противоопухолевых лекарственных средств, многие из которых являются стандартами лечения солидных новообразований. Несмотря на все достоинства препаратов из этой группы, они не лишены побочных эффектов. Известно, что основной «мишенью» цитостатиков являются активно пролиферирующие клетки, которые быстро восстанавливаются после завершения курса противоопухолевой терапии. Клетки дефинитивного миокарда также восприимчивы к воздействию химиотерапевтических агентов, в особенности антрациклиновых антибиотиков. В отличие от быстро пролиферирующих клеточных популяций, для кардиомиоцитов (КМЦ) характерна способность к их репарации на внутриклеточном уровне. Поэтому антрациклиновая кардиотоксичность может значительно ухудшать качество жизни пациентов и быть потенциально фатальной [1].
Необходимость разработки и внедрения новых протективных и регенераторных технологий обусловлена широким спектром негативных побочных эффектов антрациклиновых антибиотиков. Их противоопухолевый эффект является дозозависимым, поэтому применение кардиопротекторов позволит увеличить терапевтические дозы доксорубицина для повышения его противоопухолевой активности [2].
Цель исследования: изучить воздействие антагониста рецепторов ангиотензина II телмисартана на гистологическое строение сердечной мышечной ткани при доксорубицин-индуцированной ХСН.
Материалы и методы. Данная работа выполнялась на базе кафедры гистологии, цитологии и эмбриологии РостГМУ и лаборатории электронной микроскопии НИИ Нейрокибернетики ЮФУ. Эксперимент проводили на 40 крысах – самцах линии Вистар с массой тела 0,15-0,20 кг, разделенных на 4 группы по 10 крыс в каждой. Животные содержались в условиях стандартного вивария: температура воздуха в помещении 18-20 °С, относительная влажность воздуха 40-60%, 12-часовой цикл день/ночь. Известно, что эстроген обладает некоторым кардиопротективным эффектом, поэтому в эксперименте использовались только самцы.
Все процедуры и протоколы, примененные в эксперименте, соответствовали основным принципам гуманного обращения с лабораторными животными, предусмотренными «Международными рекомендациями по проведению медико-биологических исследований с использованием животных» [3]. Животных под обязательным наркозом в/б тиопентала Na в дозе 30 мг/кг декапитировали и брали материал для морфологического исследования. Экспериментальные животные были разделены на следующие группы: первая группа – контрольные крысы, которые получали физиологический раствор в соответствующем массе их тела объеме. Ко 2–й группе относились животные, которым в курсовой дозе 15 мг/кг внутрибрюшинно (в/б) был введен доксорубицин («ЛЭНС-Фарм», Москва), эта доза была разделена на 6 инъекций в течение 2 недель [4]. Крысы из третьей группы получали per os телмисартан («Берингер Ингельхайм Фарма ГмбХ и Ко.КГ», Германия) по 5 мг/кг ежедневно в течение 8 недель. Животным из четвертой группы начиная с первого дня эксперимента вводили параллельно доксорубицин и телмисартан по тем же схемам введения. Так как скорость протекания биохимических процессов видоспецифична, количество изучаемого препарата рассчитывалось с учетом коэффициента пересчета 5,9 относительно терапевтической дозы для человека [5]. Апоптотическую и пролиферативную активность исследовали при помощи иммуногистохимического выявления белков P53, Bcl-2 и Ki-67. Светооптическое и ультраструктурное исследование проводилось на материале, полученном спустя 3, 21 и 56 суток от начала эксперимента. В первой и третьей группах миокард забрали только на 56-е сутки эксперимента. Для изучения миокарда на ультраструктурном уровне использовался просвечивающий электронный микроскоп TecnaiG2 SpiritBioTWIN с ускоряющим напряжением 120 кВ [6]. Световую микроскопию проводили при помощи микроскопа ZEIZZ PrimoStar [6].
Результаты. Проведенное сравнительное светооптическое и электронно-микроскопическое исследование строения атриального и вентрикулярного миокарда интактных животных показало, что полученные результаты не противоречат данным подобных работ, отраженных в литературе [4]. Однако гистофизиологическим особенностям КМЦ правого предсердия уделено недостаточное внимание.
Сравнительное морфологическое исследование предсердного и желудочкового миокарда крыс из третьей группы, получавших телмисартан, не выявило значимых изменений относительно нормы. Такие результаты свидетельствуют об отсутствии какого- либо влияния телмисартана на морфологию миокарда.
Изучение влияния введения доксорубицина на миокард обоих отделов сердца свидетельствует о его выраженном кардиотоксическом воздействии. В миокарде животных в этой группе уже спустя 3 суток и далее на 21-е и 56-е сутки очевидна гетероморфность КМЦ в обоих отделах сердца. Часто встречались апоптотические изменения сердечных миоцитов. На поздних сроках эксперимента визуализировались очаги некроза и фиброза. В большинстве КМЦ наблюдались дистрофические изменения, сопровождавшиеся кариопикнозом, кариорексисом и кариолизисом ядер, которые только нарастали в отдаленные сроки эксперимента. Кариолемма большинства ядер имела выраженную извилистость хода, наблюдались локальные расширения перинуклеарного пространства. Для большинства КМЦ характерны ядра с диспергированным эухроматином, наличием обычно одного ядрышка с преобладанием фибриллярного компонента; однако нередко встречались ядрышки с проявлениями фрагментации. В сократительном аппарате КМЦ был выражен лизис миофиламентов миофибрилл, наблюдалось их разрыхление. Миофибриллы в центральной зоне саркоплазмы КМЦ были истончены. Митохондрии в основном неправильной формы, чаще с плотным матриксом и хаотично упакованными кристами. Однако в большинстве характерен просветленный матрикс с дезориентированно расположенными кристами. Цистерны саркоплазматической сети в околоядерной и субсарколеммальной областях нередко расширены. В атриальных КМЦ вблизи полюсов ядер находились диктиосомы комплекса Гольджи с признаками редукции его цистерн и везикул, значительно снижено число предсердных гранул (рис. 1). В обоих отделах сердца очевидны проявления интерстициального отека миокарда, а также активация фибробластов, активно синтезирующих компоненты межклеточного матрикса.
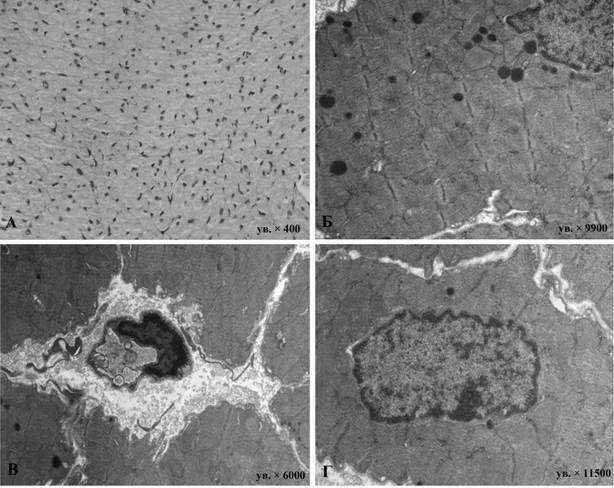
Рис. 1. Световая и электронные микрофотографии предсердного (А, Б) и вентрикулярного (В, Г) миокарда крыс, получавших доксорубицин в течение 8 недель эксперимента:
А - окраска гематоксилином-эозином, ув. × 400. Б, В, Г - электронные микрофотографии. Б - ув. × 9900; В - ув. × 6000; Г - ув. × 11500
В миокарде животных четвертой группы, получавших доксорубицин и телмисартан, по сравнению с миокардом животных второй группы, получавших исключительно доксорубицин, были демонстративно менее выражены гетероморфность КМЦ и дистрофические изменения в них. В ранние сроки наблюдения в ядрах многих КМЦ в кариоплазме преобладает эухроматин, в ядрышках – фибриллярный компонент. Состояние сократительного аппарата КМЦ экспериментальной группы сопоставимо с изменениями во 2-й группе на тех же сроках эксперимента, при этом повреждающее действие доксорубицина сильнее проявлялось в миокарде желудочков. В отдаленные сроки эксперимента патологические изменения в сократительном аппарате менее выражены, однако в пределах саркомера миофибрилл заметны участки лизиса миофиламентов.
Весьма типична различная форма обнаруживаемых митохондрий, с преобладанием округлой или овальной. Подавляющее большинство этих органелл имели просветленный матрикс и рыхло хаотично упакованные кристы. Значительно реже встречались митохондрии небольшого размера, зачастую неправильной формы с темным матриксом, плотно упакованными кристами. Как и во 2-й группе, расширенные и укороченные цистерны саркоплазматической сети наиболее часто располагались в околоядерной и субсарколеммальной областях. Для атриальных КМЦ характерны единичные диктиосомы комплекса Гольджи с небольшим количеством предсердных гранул. Интерстициальный отек менее выражен. Заметна активность фибробластов, синтезирующих компоненты интерстиция, главным образом коллагеновые волокна. Во всех сроках эксперимента очевидна гетероморфность эндотелия сосудов микроциркуляторного русла. Встречались эндотелиоциты с темными гиперхромными ядрами, с малочисленными органеллами и большим количеством везикул. На ранних сроках эксперимента изредка встречались отечные эндотелиоциты с небольшим количеством везикул (рис. 2).
Изучив содержание белка Ki-67 в интактном миокарде методом иммуногистохимии, выявили крайне низкую пролиферативную активность КМЦ. Наличие белков P53 и Bcl-2 у очень небольшого количества КМЦ свидетельствует о слабовыраженных про- и антиапоптотических процессах соответственно. У животных, которым вводили только телмисартан, уровни экспрессии белков Р53, Bcl-2, Ki-67 были сопоставимы с интактным миокардом. В обоих отделах сердца крыс после введения только доксорубицина выявлены высокие показатели апоптотической и пролиферативной активности в особенности в отдаленные сроки эксперимента. Проведенный иммуногистохимический анализ показал значительное увеличение экспрессии белков Р53 и Bcl-2. Уровень экспрессии белка Ki-67 также был значительно выше, чем в контрольной группе. К восьми неделям эксперимента в этой группе животных количество клеток с позитивной иммуногистохимической реакцией значительно увеличилось.
Проведенный иммуногистохимический анализ КМЦ крыс, которым параллельно с доксорубицином вводили телмисартан, показал значительное увеличение количества клеток с высоким содержанием белка Bcl-2 относительно контроля.
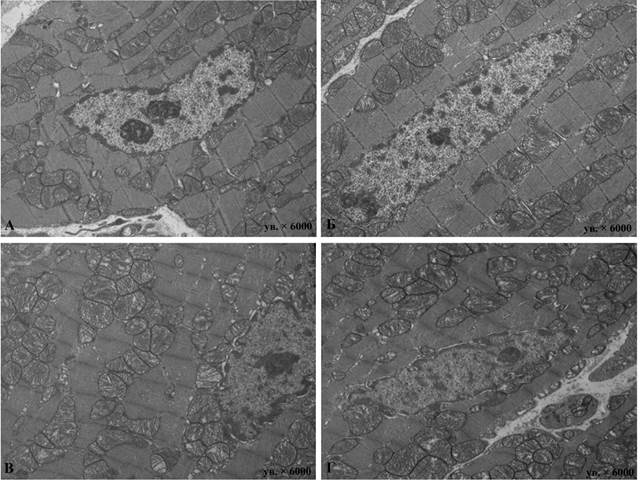
Рис. 2. Электронные микрофотографии атриальных (А, Б) и вентрикулярных (В, Г) КМЦ миокарда крыс после введения доксорубицина и телмисартана. 8 недель эксперимента. Электронные микрофотографии: А - ув. × 6000; Б - ув. × 6000; В - ув. × 6000; Г - ув. × 6000
Количество клеток с высоким уровнем белка P53 на ранних сроках эксперимента лишь немного больше, чем в миокарде интактных животных. Уровень экспрессии белка Ki-67 также был выше, чем в контрольной группе, что свидетельствует об усилении как пролиферативной активности КМЦ, так и антиапоптотических процессов по сравнению с первым сроком. Проапоптотические процессы были выражены достаточно слабо. Следует отметить постепенное увеличение количества позитивных клеток к 8-й неделе эксперимента.
Обсуждение результатов. Представленная нами информация по результатам исследований ультраструктуры миокарда крыс при экспериментальном моделировании регенераторно-пластической ХСН в основном коррелирует с уже опубликованными данными [4]. Однако более целенаправленное и обширное применение метода электронной микроскопии в нашем эксперименте позволяет утверждать о несомненном нарастании гетероморфности клеток миокарда под воздействием доксорубицина как основного альтерирующего фактора, способствующего возникновению реактивных изменений ядерного компартмента, органелл энергетического, синтетического, сократительного аппаратов и других внутриклеточных структур, наиболее остро нуждающихся в процессах репарации. Также безусловно то, что именно этот метод при сравнительном ультраструктурном исследовании миокарда экспериментальных лабораторных животных с сочетанным введением доксорубицина и телмисартана доказательно и убедительно демонстрирует морфологическую разнотипию обнаруживаемых миокардиальных клеток, а также явно различающееся сравнительное соотношение объемов клеточного гетероморфизма в динамике проведенного эксперимента, особенно в наиболее различном диапазоне его сроков. Наблюдаемые нами проявления явной деструкции сократительного аппарата, митохондрий, саркоплазматической сети в сочетании с изменениями ультраструктуры ядерного компартмента сердечных миоцитов в экспериментальной группе животных безусловно подтверждают имеющее место блокирование репаративного ядерного биосинтеза при соответствующем отсутствии в саркоплазме КМЦ свободных рибосом, а в ядрышках – гранулярного компонента. Проявления внутриклеточной регенерации манифестируют чаще всего в примембранных участках саркоплазмы смежных кардиальных миоцитов. Ультраструктурные признаки блокирования внутриклеточной регенерации сопряжены с наблюдаемыми процессами миоцитолизиса и аутофагии, деструкции КМЦ, распространяющимися до границы межклеточных мембран вставочных дисков.
Весьма проблемно и многосторонне следует рассматривать пролиферативный потенциал и апоптотическую гибель КМЦ предсердий и желудочков и реактивность их ядерного компартмента. Иммуногистохимический анализ апоптотической и пролиферативной активности КМЦ крыс, которые получали только телмисартан, показал, что количество клеток с экспрессией проапоптотического белка Р53 и антиапоптотического белка Bcl-2, а также фактора пролиферации Ki-67 незначительно отличалось от аналогичных показателей в КМЦ интактного миокарда. У животных, которым вводили только доксорубицин, выявлено значительное увеличение количества клеток с экспрессией про- и антиапоптотического белка а также фактора пролиферации Ki-67. При параллельном введении доксорубицина и телмисартана эти иммуногистохимические показатели были значительно ниже, чем после введения одного доксорубицина. Это свидетельствует об активизации процессов внутриклеточной регенерации в этой группе. Объем интерстициального компонента сердечно-мышечной ткани под воздействием только доксорубицина был значимо больше, чем в интактном миокарде. Применение телмисартана на фоне введения доксорубицина привело к менее выраженному развитию интерстициального компонента.
Выводы. Проведенные сравнительные морфологические исследования ультраструктуры миокарда при экспериментальной доксорубициновой регенераторно-пластической ХСН позволяют заключить, что применявшийся в её лечении антагонист рецепторов ангиотензина II телмисартан оказывает очевидное кардиопротекторное влияние. Кардиопротекторный эффект телмисартана характеризуется менее выраженной гетероморфностью КМЦ, уменьшением интерстициального и внутриклеточного отека, а также сохранностью структур сократительного аппарата и митохондрий. Все это ещё раз убеждает в кардиопротекторных свойствах телмисартана. Кроме того, наблюдалась стабилизация ядерного компартмента и менее выраженные повреждения синтетического аппарата, что позволяет говорить об улучшении синтетических процессов в КМЦ, как результата кардиопротективного эффекта телмисартана. При иммуногистохимическом исследовании не выявлено значимых изменений апоптотической и пролиферативной активности при применении телмисартана относительно интактного миокарда. Доксорубицин оказывает несомненное активирующее влияние на апоптотические и пролиферативные процессы. Применение телмисартана на фоне введения доксорубицина уменьшает доксорубицин-обусловленное повышение апоптотической и пролиферативной активности.



