взаимосвязь между первичными и повторными ишемическими поражениями головного мозга сейчас начинает активно изучаться. Исход и отдаленные последствия ишемии головного мозга определяются как изменениями со стороны центральной гемодинамики, так и состоянием системы микрогемоциркуляции, в которой постишемические изменения проявляются в первую очередь. Возникающие на уровне микрососудистого русла преходящие нарушения часто являются причиной повторных инфарктов головного мозга [1]. Имеющиеся исследования микроциркуляции головного мозга в отдаленный постишемический период немногочисленны, разрозненны и фрагментарны [2].
Основными заболеваниями, приводящими к развитию хронической ишемии мозга, являются атеросклероз сосудов головного мозга и артериальная гипертензия. При артериальной гипертензии имеет место ремоделирование сосудов: уменьшение просвета церебральных артерий, утолщение мышечного слоя сосудистой стенки и прочие изменения церебральной сосудистой сети [3]. Поэтому исследование процессов, происходящих на микроциркуляторном уровне при артериальной гипертензии, является актуальным и перспективным для последующей разработки новых методов, направленных на восстановление сосудистого русла и микрокровотока. Задача данной работы состояла в изучении микроциркуляции и перфузионной сатурации в коре головного мозга спонтанно гипертензивных крыс в отдаленном постишемическом периоде методами лазерной доплеровской флуометрии (ЛДФ) и оптической тканевой оксиметрии (ОТО).
Материалы и методы исследования
Эксперименты проведены на спонтанно гипертензивных крысах-самцах линии SHR из биоколлекции «Коллекция лабораторных млекопитающих разной таксономической принадлежности» Института физиологии им. И.П. Павлова РАН, поддержанной программой биоресурсных коллекций ФАНО России. Для подготовки к эксперименту наркотизированных (4,3%-ный раствор хлоралгидрата, внутрибрюшинно, 27 мг/100 г массы тела) крыс подвергали однократной ишемии головного мозга. Ишемию осуществляли окклюзией обеих сонных артерий на фоне гипотензии, поддерживаемой на уровне 45 мм рт. ст. в течение 12 мин [4]. По окончании окклюзии проводили полную реинфузию забранной крови.
Затем на 2, 7, 14 и 21-й день постишемического периода измеряли параметры микроциркуляции методом лазерной доплеровской флуометрии (ЛДФ) и параллельно методом оптической тканевой оксиметрии (ОТО) оценивали насыщение крови кислородом с помощью прибора ЛАКК-М (НПП «Лазма», Россия), устанавливая датчик прибора в высверленное на дорсальной поверхности черепа окно (S≈2 см2) с удаленной твердой мозговой оболочкой. Регистрацию ЛДФ-грамм проводили в течение 12 мин в нескольких точках. Поверхность мозга непрерывно орошали физиологическим раствором (Т 37 оC).
Параллельно измеряли среднее системное АД в бедренной артерии с помощью устройства для инвазивного измерения АД у крыс.
Метод ЛДФ дает общую оценку состояния микроциркуляции крови в исследуемой ткани. С помощью программы прибора ЛАКК-М рассчитывали среднюю величину (М, пф. ед.) показателя микроциркуляции, характеризующего средний поток эритроцитов в объеме ткани и среднеквадратичное отклонение (СКО или σ, пф. ед.), характеризующее среднее колебание перфузии относительно средней величины М. уменьшение или увеличение М указывает на снижение или повышение тканевой перфузии, уменьшение или увеличение σ – на снижение или увеличение вазомоций. Амплитудно-частотный анализ ЛДФ-грамм позволяет по амплитудам колебаний микрокровотока в конкретных частотных диапазонах оценить функционирование определенных механизмов регуляции перфузии [5]. Для более корректного анализа используются нормированные характеристики ритмов колебаний, т.е. определяется вклад амплитуды колебаний определенной группы ритмов относительно средней модуляции кровотока [6]: Анорм=А/σ, где А – максимальная амплитуда колебаний в выбранном частотном диапазоне, σ – среднеквадратичное отклонение амплитуды колебания кровотока.
Вклад эндотелиальной, нейрогенной и миогенной составляющих сосудистого тонуса оценивали по мощности их спектра (Р) в процентном отношении к общему спектру активных колебаний микрокровотока по формулам: Рэ = Аэ2 /(Aэ2 +Aн2 +Ам2) × 100%,
Рн = Ан2 /(Aэ2 +Aн2 +Ам2) × 100%,
Рм = Ам2 /(Aэ2 +Aн2 +Ам2) × 100%,
где Аэ – амплитуды эндотелиальных, Ан – нейрогенных, Ам – миогенных ритмов колебаний тканевого кровотока. На основании данных по амплитудам нейрогенных колебаний с учетом среднего АД рассчитывали величину нейрогенного тонуса (НТ) прекапиллярных резистивных микрососудов [5]: НТ = (σ×АДср)/Ан×М, где М – среднее арифметическое значение перфузии; σ – среднеквадратичное отклонение амплитуды колебания кровотока; АДср – среднее артериальное давление; Ан – максимальное значение амплитуды колебаний мозгового кровотока крыс в нейрогенном диапазоне частот (0,04-0,126 Гц) [7]. По аналогичным формулам рассчитывали величины миогенного тонуса (МТ) метартериол и прекапиллярных сфинктеров (частота колебаний микрокровотока 0,126-0,4 Гц) и эндотелий-зависимого тонуса (ЭТ) микрососудов (частота колебаний микрокровотока 0,01-0,04 Гц) [7].
Используя величины нейрогенного и миогенного тонуса, рассчитывали показатель шунтирования (ПШ) [8]: ПШ=МТ/НТ, где МТ – величина миогенного тонуса; НТ – величина нейрогенного тонуса микрососудов. Используя ПШ, рассчитывали величину нутритивной перфузии (Мнутр): М нутр=М/(1+ПШ), где М – среднее арифметическое значение перфузии; ПШ – показатель шунтирования, и величину шунтовой перфузии (Мшунт): Мшунт=М – Мнутр [7] для оценки перфузии по шунтовым и нутритивным путям.
Методом оптической тканевой оксиметрии (ОТО) определяли средний относительный уровень сатурации крови в микроциркуляторном русле (SO2) и показатель объема крови в микроциркуляторной сети (Vr) зондируемой ткани. На основании этих значений рассчитывали индексы, связывающие перфузию и сатурацию: индекс относительной перфузионной сатурации в микрокровотоке (Sm) и индекс удельного потребления кислорода тканью (U): Sm=SO2/М и U=(100-SO2)/Vr [9].
Статистическую обработку результатов проводили с помощью критерия Манна–Уитни, при уровне достоверности различий p<0,05 и, в случае выборок с нормальным распределением, с помощью t-критерия Стьюдента при уровне значимости (p<0.05).
Результаты исследования и их обсуждение
Артериальное давление у наркотизированных интактных крыс составило 75±2 мм рт. ст., у перенесших ишемию наркотизированных крыс – 90±3, 100±3, 103±4 и 115±2 мм рт. ст. соответственно на 2, 7, 14 и 21-й день постишемического периода.
Сравнением микроциркуляции в коре головного мозга у подвергнутых ишемии и у интактных спонтанно гипертензивных крыс установлено, что в коре головного мозга крыс в течение 21 дня после ишемии наблюдаются неоднородные изменения средних величин уровня перфузии и его колебаний: среднее значение М показателя микроциркуляции и среднее квадратичное отклонение ? достоверно увеличивались на 2-й и 14-й день постишемического периода, тогда как на 7-й и 21-й день отклонений не отмечено (рис. 1).
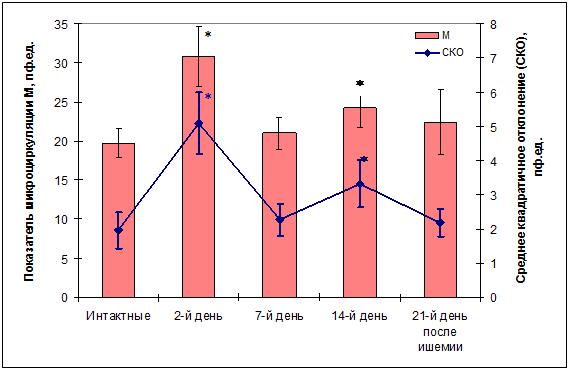
Рис. 1. Оценка церебральной микроциркуляции в постишемический период у спонтанно гипертензивных крыс. Столбики – среднее значение показателя микроциркуляции М (левая шкала), график – среднее квадратичное отклонение показателя М (правая шкала), характеризующее уровень вазомоций. * - достоверность различий по t-критерию при p<0.05
нормированные значения амплитуд колебаний микрокровотока у спонтанно гипертензивных крыс после ишемии не отличались от аналогичных значений у интактных крыс. анализ амплитудно-частотного спектра колебаний у гипертензивных крыс, как интактных, так и перенесших ишемию, не выявил преобладания колебаний отдельных компонентов в общем спектре активных колебаний микрокровотока. У них также не отмечено достоверного преобладания какого-либо из компонентов сосудистого тонуса, однако проявляется тенденция к доминированию миогенного тонуса. В целом показатели тонуса постепенно увеличивались к 21-му дню постишемического периода: к 7-му дню – нейрогенный и эндотелиальный компоненты, к 14-му – миогенный относительно показателей у интактных крыс (рис. 2).
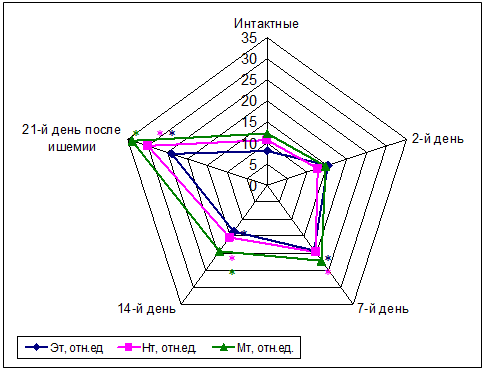
Рис. 2. Компоненты сосудистого тонуса: нейрогенный (Нт), эндотелиальный (Эт) и миогенный (Мт) у спонтанно гипертензивных крыс до (интактные) и после ишемии в течение 21 дня. Оценка различий по критерию Манна-Уитни, p<0.05
Значительное увеличение показателя микроциркуляции и среднеквадратичного отклонения модуляций кровотока ? ко 2-му дню постишемического периода, возможно, связано с постишемической гиперемией, возникающей вследствие высвобождения из ишемизированной ткани вазоактивных и провоспалительных метаболитов, обильного поступления крови через коллатерали [10].
Увеличение М и ? наблюдалось также на 14-й день после ишемии. Увеличение ? указывает на увеличение модуляций микрокровотока за счет активных механизмов регуляции сосудистого тонуса. Поскольку показатель М характеризует средний поток эритроцитов в единице объема ткани в зондируемом участке, то его увеличение указывает на ослабление артериолярного сосудистого тонуса, что ведет к увеличению объема крови в артериолах. Однако ко 2-му дню сосудистый тонус значимо не изменялся, показатель объема крови Vr снижался (рис. 3А), а снижение нутритивной перфузии относительно шунтовой составило всего 7%, тогда как у интактных животных она снижена примерно на 25%. к 14-му дню увеличивались нейрогенный и эндотелиальный компоненты тонуса, а перфузия и активные колебания ? вернулись к контрольному уровню. Вероятно, здесь мы имеем дело с подстройкой перфузии к потребностям мозговой ткани.
Увеличение тонуса и всех его компонентов к 21-му дню постишемического периода указывает на эндотелиальную дисфункцию сосудов микроциркуляторного русла коры, уменьшение нутритивного кровотока и усиление симпатических влияний на сосуды. Увеличение миогенного тонуса на 14-й и 21-й день постишемического периода указывает на снижение нутритивной перфузии [7; 11]. Оценка соотношения нутритивной и шунтовой перфузии показала, что в постишемический период нутритивная перфузия снижалась относительно шунтовой примерно на 7% на 2-й день, на 18% - на 7-й день и на 30% - на 14-й и 21-й день.
Методом оптической тканевой оксиметрии установлено, что насыщение крови кислородом у ишемизированных крыс на протяжении всего исследованного постишемического периода было достоверно выше, чем у интактных, тогда как показатель кровенаполнения Vr резко снижался ко 2-му дню постишемического периода и затем постепенно восстанавливался на протяжении всего времени наблюдения (рис.3 А).
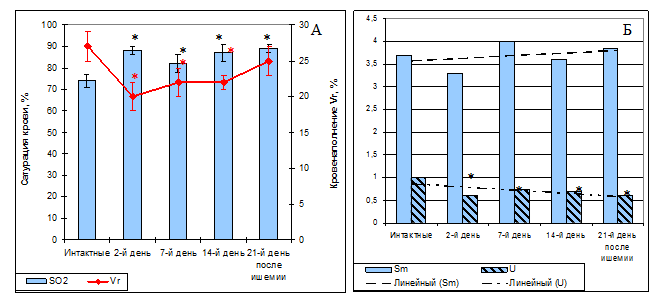
Рис. 3. Результаты оптической тканевой оксиметрии у инактных крыс и в различные сроки постишемического периода. А: уровень сатурации крови в микроциркуляторном русле (SO2, %, столбики) и показатель объема крови в микроциркуляторной сети (Vr, %, график) зондируемой ткани. Достоверность различий по t-критерию при p<0.05. Б: индекс относительной перфузионной сатурации в микрокровотоке (Sm, абс.ед., сплошная заливка) и индекс удельного потребления кислорода тканью (U, абс.ед., штриховка). Оценка различий по критерию Манна-Уитни, p<0.05
При этом, несмотря на увеличение перфузии и вазомоций, на 2-й день постишемического периода снижались относительная перфузионная сатурация Sm и потребление кислорода тканью U. В целом же индекс относительной перфузионной сатурации в микрокровотоке Sm проявлял тенденцию к увеличению к 21-му дню постишемического периода, а индекс удельного потребления кислорода тканью – тенденцию к снижению (рис. 3Б). Это свидетельствует об отсутствии эффективной оксигенации мозговой ткани на протяжении исследованного постишемического периода [9]. Мы полагаем, что снижение показателя кровенаполнения ткани головного мозга Vr и потребление кислорода тканью U при одновременном повышении сатурации крови кислородом связано с реперфузионным отеком ткани мозга. Развившийся отек приводит к увеличению диффузного расстояния для кислорода от капилляров до клеток, что сопровождается снижением потребления кислорода тканью. При этом уменьшается артериовенозная разность по кислороду, что проявляется увеличением показателя сатурации крови кислородом.
Снижение потребления тканью головного мозга кислорода может нарушать функционирование нейрососудистых единиц головного мозга, т.е. вызывать дисбаланс во взаимодействии эндотелиальных и гладкомышечных клеток микрососудов, с одной стороны, и глиальных клеток - с другой [12], что приводит к нарушению трофики тканей. Следует отметить, что тенденция к нарушению баланса между доставкой кислорода и его потреблением тканью мозга является неблагоприятным фактором, повышающим вероятность повторных ишемических атак.
Заключение
Установлено, что у крыс линии SHR под влиянием кратковременной ишемии мозга церебральная микроциркуляция на протяжении последующих трех недель имеет нестабильный характер: улучшение перфузии на 2-й и 14-й день сопровождается ее снижением до контрольных значений на 7-й и 21-й.
Не отмечено преобладания какого-либо компонента сосудистого тонуса, но в целом к 21-му дню постишемического периода сосудистый тонус возрастает.
Обнаруженная тенденция к нарушению баланса между скоростью доставки кислорода кровью и его потреблением тканью мозга является неблагоприятным фактором и может повышать вероятность вторичной ишемии мозга.
Работа поддержана Программой Президиума РАН I.19П (проект 0134-2015-0002).



