Хронические диффузные заболевания печени (ХДЗП) являются одной из ведущих причин смерти лиц среднего возраста в России. Патология печени занимает 5-ое место в структуре заболеваемости среди всех видов болезней желудочно-кишечного тракта в Астраханской области. На особенности течения заболеваний печени в этом регионе оказывают влияние характер и качество пищевых продуктов и воды, климатические, социально-экономические факторы, вирусный фактор, а также склонность к злоупотреблению алкоголем, курение, психосоциальные стрессы [5]. Но лишь в немногих работах отмечается роль цитомегаловируса, вируса Эпштейн – Барр, герпес-вирусов, иных вирусов при хроническом гепатите (ХГ) и циррозе печени (ЦП), причем чаще всего они рассматриваются как кофакторы, не имеющие самостоятельного значения [7]. Участие бактериального фактора (патогенной и условно-патогенной микрофлоры) в патогенезе заболеваний печени изучено в ещё меньшей степени. Микроорганизмы могут влиять на болезнь, выступая в роли этиологических факторов, провоцируя чрезмерный иммунный ответ, а также иными способами. Огромное разнообразие связей между маркером инфекции и патогенезом инфекционного процесса, которое CapronL. в статье 2003 г. называет «модификацией» [8]. Проблема взаимосвязи многообразных заболеваний, связанных с наличием в организме пациента различных вирусов и бактерий (как патогенных, так и нейтральных или даже полезных), а также антител к вирусно-бактериальным антигенам, представляет большой интерес. Выявление таких взаимосвязей позволяет выбирать более эффективные методы лечения, улучшать диагностический процесс.
Цель исследования: создание формализованной процедуры оценки влияния вирусно- бактериальных маркеров на течение хронических диффузных заболеваний печени (ХДЗП) с точки зрения концепции «модификации» клинической картины последних.
Материалы и методы исследования. За период 2000–2014 гг. у 42 здоровых лиц и у 96 больных ЦП и 69-ХГ, всего у 165 пациентов с ХДЗП, качественным, полуколичественным или количественным методом твёрдофазного иммуноферментного анализа (ИФА) были определены сывороточные маркеры: Ch. pneum., Myc. Pneum., H. pylori, вируса простого герпеса (HSV-1), вируса Эпштейна – Барр (EBV), цитомегаловируса (CMV), вируса гепатита А (HAV), антитела к сапрофитной и условно-патогенной микрофлоре, а именно к E. coli, Proteusspp., Candidaalbicans, Strept.spp., Bacteroides, Klebs. рneum. классов IgG, IgM, IgA или суммарные антитела. Средний возраст больных составил 48,8±1,7 лет. Все пациенты были обследованы согласно Национальным Стандартам Российской Федерации с созданием базы данных, включающей формализованные результаты физикальных, лабораторных, инструментальных методов исследования, а также результаты определения вирусно- бактериальных маркеров. Всего в базе данных у каждого больного учитывалось 135 параметров [3]. В качестве базовой методики анализа выбрана модифицированная процедура проверки гипотезы об однородности двух многомерных выборок, построенная на основе непараметрического критерия рангов U Манна – Уитни, с определением U сначала по каждому признаку, затем с нахождением взвешенной суммы Uв. Полученная величина сравнивалась с табличным квантилем уровня значимости Uкр, равным 1,645 для 95 % достоверности. Если Uв≥Uкр, то имелось существенное различие между уровнем признака в рассматриваемых выборках [1, 4].
Таким образом, поставленная задача была сведена к проверке гипотезы на однородность двух многомерных выборок. Для конкретного изучаемого вирусно- бактериального маркера формируются две выборки. Первая выборка – наборы результатов обследований по всем показателям больных, у которых зафиксировано либо наличие данного маркера (бинарный признак – «есть или нет маркер»), либо, при количественном определении, концентрация его превышала норму; вторая – аналогичные наборы по больным, у которых маркера либо не было, либо его концентрация была меньше таковой у здоровых добровольцев. В ряде случаев возможным было выделение дополнительной, третьей группы со сниженной относительно «нормальной» концентрацией антител, определяемых количественно. Рассматривается гипотеза H0: можно ли считать, что обе выборки подчиняются одному тому же вероятностному распределению. Справедливость данной гипотезы будет означать, что наличие изучаемого вирусно-бактериального маркера не влияет на особенности заболевания печени. Альтернативной является гипотеза H1 о несовпадение распределений, которым подчиняются выборочные значения для пациентов, имеющих высокое содержание данного маркера, с распределением аналогичных значений для больных, у которых данный маркер отсутствует или имеет те же показатели, что и здоровые лица. Одним из возможных подходов мог бы быть проверка одномерных гипотез об однородности по каждому показателю, и если хотя бы по одному из показателей гипотеза об однородности не выполняется, то считается, что и исходные наборы не являются однородными. Имеется много методов проверки гипотезы об однородности для одномерных выборок [5, 6, 7]. Однако при таком подходе признаки рассматриваются как независимые, что некорректно. Кроме того, поскольку в задаче, рассматриваемой в данной работе, число признаков составляет 135, то практическая реализация описанного подхода в рамках данной работы трудно реализуема ввиду ее трудоемкости. Поэтому целесообразно рассмотреть многомерные методы анализа однородности. Наиболее эффективными методами проверки гипотезы об однородности многомерных данных являются методы, разработанные для анализа нормально распределенных данных. Однако предположение о нормальности неубедительно для данных, принимающих два значения: есть симптом (или признак) или нет его. Для решения рассматриваемой задачи может быть использован метод Манна – Уитни, модифицированный с учётом особенностей имеющихся данных. Ниже предлагается модификация метода, учитывающая эти особенности [2,3].
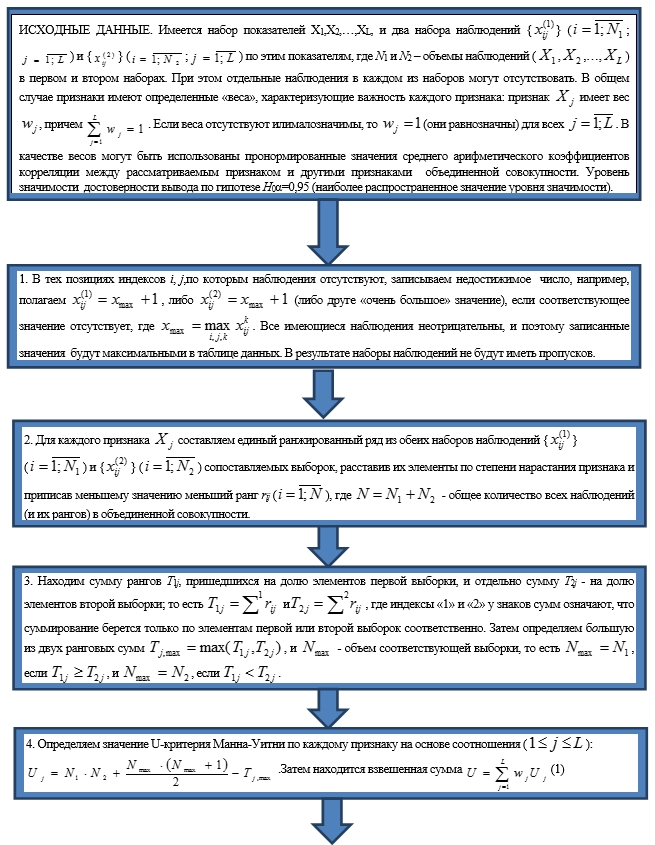

Многомерная модификации метода Манна – Уитни для сравнения двух многомерных выборок (групп наблюдений)
Результаты исследования и их обсуждение
В качестве базовой методики анализа выбрана процедура проверки гипотезы оценки значимости модифицирующего действия вирусно-бактериальных маркеров об однородности двух многомерных выборок, построенная на основе непараметрического критерия рангов U Манна – Уитни, с определением U сначала по каждому признаку, затем с нахождением взвешенной суммы Uв, или коэффициент связи набора признаков с маркером (k), или «коэффициент модификации». Полученная величина сравнивалась с квантилем уровня значимости Uкр, равным 1,645 (табличное данное) для 95 % cтaтиcтичecкoй достоверности, а число 1,282 – для 90 % дocтoвepнocти. Если Uв≥Uкр, то имеется существенное различие между уровнем признака в рассматриваемых выборках. Предложено считать признак с достоверностью больше 95 % сильным модификатором, при 90–95 % – модификатором средней силы, а менее 90 % – слабым.
Таблица 1
Оценки значимости модифицирующего действия вирусно-бактериальных маркеров при ХДЗП
|
Маркер(антитела) |
Коэффициент связи набора признаков с маркером (k) |
Оценка модифицирующего действия маркера |
|
ChlamidophylapneumoniaeIgM |
0,912 |
Слабый модификатор |
|
ChlamidophylapneumoniaeIgA |
1,77* |
Сильный модификатор |
|
ChlamidophylapneumoniaeIgG |
1,610 |
Средней силы модификатор |
|
MycoplasmapneumoniaeIgM |
1,014 |
Слабый модификатор |
|
MycoplasmapneumoniaeIgA |
1,309 |
Средней силы модификатор |
|
MycoplasmapneumoniaeIgG |
** |
|
|
H.pylori (суммарные антитела) |
1,203 |
Слабый модификатор |
|
Вирус простого герпеса (HSV-1) IgM |
1,953* |
Сильный модификатор |
|
Вирус простого герпеса (HSV-1) IgG |
NS |
NS |
|
Вирус Эпштейна – Барр(EBV) IgM |
1,494 |
Средней силы модификатор |
|
Вирус Эпштейна – Барр(EBV) IgG |
1,596 |
Средней силы модификатор |
|
Цитомегаловирус (CMV) IgM |
2,059* |
Сильный модификатор |
|
Цитомегаловирус (CMV) IgG |
0 |
NS |
|
Вирус гепатита А (HAV) |
** |
|
|
E. coli |
1,691* |
Сильный модификатор |
|
Candidaalbicans |
1,717* |
Сильный модификатор |
|
Streptococcusspp. |
0,862 |
Слабый модификатор |
|
Klebsiellapneumoniae |
1,670* |
Сильный модификатор |
|
Staphylococcus spp. |
0,505 |
Слабый модификатор |
|
Ps. aeruginosa |
1,933* |
Сильный модификатор |
|
Антиэндотоксиновые антитела |
1,353 |
Средней силы модификатор |
|
Proteusspp. |
1,826* |
Сильный модификатор |
|
Bacteroides |
1,028 |
Слабый модификатор |
Примечание: при k > 1,645, p* < 0,05;NS – не имеет статистических отличий;** – p не вычислено.
Оценка значимости маркеров показала, что достоверно модифицировали клиническую картину ХДЗП наличие ChlamydiapneumoniaeIgA (1,77), HSV IgМ (1,95), CytomegalovirusIgМ (2,06), а также повышенные по сравнению с нормой уровни суммарных антител к E.coli (1,69), Proteusmirabilis(1,83), Candidaalbicans (1,72), Klebsiellapneumoniae (1,67), Pseudomonasaeruginosa (1,93). Установлена высокая степень соответствия между вычисленными «коэффициентами модификации» Uв и особенностями течения ХДЗП у пациентов, имеющим различия по данным маркерам. Значимость маркера целесообразнее оценивать как с учётом клинического анализа, так и путём вычисления коэффициента модификации, когда один метод дополняет другой.
На основе полученных данных можно наметить определенный спектр воздействий, потенциально могущих изменить, модифицировать течение заболеваний, через влияние на вирусно-бактериальные инфекционные маркёры. И хотя целью работы не была разработка новых методов лечения, но некоторые перспективные направления могут быть эмпирически предложены на основании проведенных клинических исследований и разработанного математического аппарата. Это может быть использование бактериофагов, в частности – хламидиофагов против парсистирующей хламидийной инфекции, лактулозы для коррекции кишечной микрофлоры, профилактическая вакцинация против HAV, лечение реактивации инфекций CMV и HSV при ХДЗП. Степень и направление этой индуцированной лечебным воздействием модификации болезни можно оценивать с помощью объективных методов математического моделирования. Методологические подходы, в частности – математический аппарат, предложенный в рамках настоящей работы, может дать новую информацию в рамках изучения роли не только вирусно-бактериальных маркеров, но и самих представителей микрофлоры человека при различных заболеваниях. Дальнейшее изучение выявленных особенностей, с применением новых технологий, может позволить уточнить детали патогенеза и процессы модификации течения острых и хронических неинфекционных заболеваний, тем самым внося вклад в теоретическую и практическую медицину. Предлагаемые методические подходы могут быть использованы как при решении других медико-биологических проблем, так и в иных, не связанных с медициной и биологией областях, при которых обрабатываются количественные данные, организованные в многомерные массивы.
Выводы. Установлены вирусно-бактериальные маркеры, достоверно модифицирующие клиническую картину ХДЗП. Предложен алгоритм выявления подобных маркеров, «модифицирующих» течение заболеваний печени. Получен объективный «коэффициент модификации» клинической картины болезни при наличии того или иного вирусно-бактериального маркера, согласующийся с клиническими данными. Выявлены сильные, слабые и средней силы модификаторы ХДЗП. Создана программа для ЭВМ «Автоматизированная система оценки различий между группами больных терапевтического профиля» (Cвидетельство о регистрации № 2016611315 от 29.01.16), для количественной оценки и достоверности влияния различных факторов, позволяющая количественно определять вклад того или иного мapкеpа в изменение (модификацию) клинической картины хронических диффузных заболеваниях печени. Наличие возможности вычисления коэффициентов модификации дает возможность создания так называемой «теории модификации» применительно к ХДЗП.



