В настоящее время все большее социальное значение отводится сердечно-сосудистой патологии, новообразованиям, эндокринным заболеваниям, которые являются частой причиной высокой смертности населения, случаев временной и длительной нетрудоспособности. В то же время уделяется меньше внимания хроническим заболеваниям мочеполовой системы, резко снижающим качество жизни больных. Доброкачественная гиперплазия предстательной железы (ДГПЖ) является одним из таких заболеваний [1; 2].
Наиболее распространенными методами оперативного лечения ДГПЖ при неэффективности консервативного ведения являются травматичная, связанная с высоким риском интра- и послеоперационных осложнений открытая аденомэктомия — 27,2% операций и трансуретральная резекция простаты (ТУРП) — 27,8%. ТУРП в настоящее время является «золотым стандартом» оперативного лечения ДГПЖ, однако она наиболее эффективна и показана при объёме предстательной железы (ПЖ) от 30 до 80 см3 [3; 4].
Несмотря на хорошую эффективность указанных вмешательств, не каждому больному возможно предложить такое лечение в силу различных обстоятельств. К ним можно отнести: возраст – что неразрывно связано с самим определением ДГПЖ, обусловленные указанным фактором сопутствующие заболевания, повышающие анестезиологический риск, нежелание самого больного ввиду риска характерных осложнений – таких как ретроградная эякуляция, недержание мочи, снижение эректильной функции.
Не так давно появились такие минимально инвазивные методы, как трансуретральная микроволновая терапия, интерстициальная лазерная термоабляция, трансуретральная игольчатая абляция, водо-индуцированная термотерапия и др. [5; 6]. Однако применение данных методов при большом объеме железы также ограниченно.
Одна из активно развивающихся высокотехнологических отраслей медицины – эндоваскулярная хирургия. Достоинствами эндоваскулярных вмешательств являются: минимальная инвазивность, низкий операционный риск, быстрое восстановление пациентов, отсутствие необходимости в проведении анестезиологического пособия, возможность проведения у пожилых людей и у пациентов с тяжелой соматической патологией.
Изначально эндоваскулярная эмболизация в урологии рассматривалась лишь как способ остановки жизнеугрожающих кровотечений из мочевого пузыря и предстательной железы [7].
У части пациентов после выполнения эмболизации в бассейне нижней мочепузырной артерии были отмечены редукция объема ПЖ и, как следствие, улучшение качества мочеиспускания, что натолкнуло исследователей на мысль о возможности применения данного метода в лечении больных ДГПЖ.
Уже в 2010 году португальские исследователи во главе с J.M. Pisco представили данные 4-летних наблюдений по результатам нового метода лечения доброкачественной гиперплазии простаты. Метод был технически успешным у 14 из 15 пациентов (93,3%) [8]. В этом же 2010 г. отечественные исследователи (Неймарк А.И., Карпенко А.А., Яковец Я.В.) представили данные по эмболизации артерий простаты у 40 больных с высоким риском оперативного вмешательства. Вмешательство позволило после операции на фоне снижения выраженности клинических проявлений уменьшить объем предстательной железы на 50%, объем аденоматозного узла — на 43%, исследования продолжаются и по сей день [9].
Другие независимые исследователи в 2012 году во главе с Carnevale F.C. опубликовали результаты лечения более 100 больных ДГПЖ с СНМП и объемом железы от 30 до 90 см3. Эффективность процедуры оценивалась как крайне высокая [10]. До настоящего момента ежегодно появляются новые результаты исследований со всего мира, свидетельствующие о высоком потенциале метода эмболизации простатических артерий (ЭПА).
Цель исследования
Оценить долгосрочные результаты лечения методом ЭПА больных ДГПЖ. Разработать алгоритм ведения различных групп пациентов после выполнения ЭПА.
Материал и методы
Начиная с 2004 по 2015 год на базе отделения рентгеноперационных методов диагностики и лечения Алтайской краевой клинической больницы у 70 пациентов проведена ЭПА. Возраст больных составил 69,7±7,3 года, объем предстательной железы 111,6±52,6 см3. Максимальный объем ПЖ - 296 см3. Индекс IPSS - 18,3±3,2, максимальная скорость мочеиспускания Qmax (maximum urinary flowrate) – 7,3±4,2 мл/с. Все пациенты были предупреждены о возможных осложнениях при проведении процедуры и о возможных альтернативных методах лечения. Подавляющее большинство пациентов имело различную сопутствующую патологию: сахарный диабет, патологию сердечно-сосудистой системы, избыточный вес, что в значительной степени увеличивало риск оперативного лечения общепринятыми методами. Перед процедурой проводилось анкетирование по международной системе суммарной оценки симптомов при заболеваниях простаты (IPSS), оценке качества жизни QoL. Объем простаты и узла определялся по данным трансректального ультразвукового исследования (ТРУЗИ) ПЖ. Перед оперативным вмешательством всем больным было проведено исследование крови на определение уровня простатспецифического антигена (ПСА), в сомнительных случаях произведена пункционная биопсия предстательной железы.
Для анализа качества мочеиспускания проводилась урофлоуметрия (УФМ).
Эффективность лечения оценивалась на 6, 12 и 24-й месяцы после процедуры.
ЭПА проводилась под местной анестезией трансфеморальным либо чресплечевым доступом по методике Сельдингера. Под рентгеновским контролем выполнялась суперселективная катетеризация ветвей внутренней подвздошной артерии (ВПА). Затем выполнялась эмболизация сосудов, питающих ПЖ, путём применения микрокатетерной техники с введением микросфер EmboGold (BiosphereMedical, Франция), размером 100-300 или 300-500 мкм, до полной блокады кровотока (рис. 1).
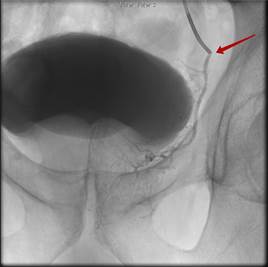
Рис. 1. Стрелкой указан дистальный конец катетера, контрастируется простатическая артерия слева
Диаметр микросфер выбирался в зависимости от диаметра артерий, питающих предстательную железу. Для катетеризации применялись катетеры конфигурации Roberts5F или Cobra5F, которые выполняли роль проводникового катетера. Через просвет проводникового катетера проводился микрокатетер на микропроводнике. После эмболизации артерий простаты с одной стороны, проводниковый катетер 5F устанавливался в контр- либо ипсилатеральную артерию, в зависимости от доступа, и процедура повторялась. В ряде случаев требовалась пункция обеих бедренных артерий с проведением проводникового катетера контрлатерально.
Для оценки типа распределения признаков использовали показатели эксцесса и асимметрии, характеризующие форму кривой распределения. Значения непрерывных величин представлены в виде M±m, где M – выборочное среднее арифметическое и m – стандартная ошибка среднего. В случаях нормального распределения, а также равенства выборочных дисперсий, для сравнения связанных выборок использовали парный t-критерий Стьюдента. В иных случаях использовали непараметрический T-критерий Вилкоксона. Равенство дисперсий оценивали по F-критерию Фишера. Уровень статистической значимости при проверке нулевой гипотезы принимали соответствующий Р<0,05. При множественных сравнениях использовали поправку Бонферрони.
Обработку данных проводили с помощью компьютерной программы Statistica 10 (StatSoft).
Критериями исключения для проведения эмболизации были:
• непереносимость рентгенконтрастных веществ;
• наличие острых инфекционно-воспалительных заболеваний;
• декомпенсированная патология внутренних органов (сердечно-сосудистой системы, паренхиматозных органов);
• декомпенсированная патология эндокринной системы;
• нарушения сердечного ритма независимо от причины;
• тяжелая форма бронхиальной астмы;
• состояние после перенесенного инфаркта миокарда или острого нарушения мозгового кровообращения в срок до 6 месяцев;
• наличие флотирующих тромбов в бассейне вен нижних конечностей;
• анемия тяжелой и средней степени;
• окклюзионно-стенотические поражения подвздошных сосудов;
• аномалии анатомического строения подвздошных сосудов, не позволяющие выполнить операцию.
Результаты исследования и их обсуждение
Билатеральная ЭПА удалась у 64 больных (93%), что немного ниже, чем у других исследователей, и, вероятно, связано с более возрастной группой пациентов и, как следствие, с более высокой степенью отягощенности сопутствующими заболеваниями, в частности системным атеросклерозом, что проявляется в патологической извитости и облитерации мелких артерий таза у данной категории больных. Отчасти вышеуказанное связано с отсутствием технической возможности предоперационного картирования сосудистой архитектоники и использованием МР ангиографии, перед выполнением вмешательства, что позволило бы более тщательно отбирать пациентов перед вмешательством. 4 больным ЭПА не удалась с обеих сторон – в группу исследования они не включались. В послеоперационном периоде у 58% больных наблюдались явления так называемого постэмболизационного синдрома, проявлявшегося умеренными болями в области промежности, резями по ходу уретры при мочеиспускании, в небольшом проценте случаев субфебрилитет не более суток. 42% больных, однако, не испытывали никакого дискомфорта в послеоперационном периоде.
Для предупреждения и уменьшения выраженности болевого синдрома перед вмешательством и после операции в течение 7 дней больным назначались нестероидные противовоспалительные препараты (НПВП) в стандартных дозировках.
Из осложнений можно отметить 3 случая острой задержки мочеиспускания, в 1 случае потребовалось выполнение троакарной цистостомии. Еще 2 случая образования язвочек эпителия головки полового члена, эпителизировавшихся через 2 недели без каких-либо остаточных явлений (рис. 2).
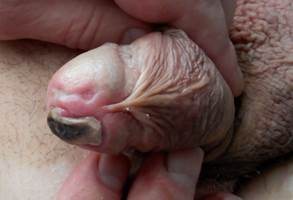
Рис. 2. Поверхностные язвочки головки полового члена в стадии репарации – 3 недели после ЭПА
Указанное явление, видимо, связано с забросом эмболов по коллатералям в пенильные артерии.
Результаты наблюдений больных, подвергнутых ЭПА, представлены в таблице.
Результаты наблюдений за больными после выполнения ЭПА (n = 51)
|
Показатель |
До ЭПА |
6-й месяц наблюдения |
12-й месяц наблюдения |
24-й месяц наблюдения |
|
Объем остаточной мочи, мл |
92,6±12,7 |
42,2±11,5* |
28,0±5,7^ |
26,0±4,4 |
|
IPSS |
18,3±3,2 |
6,2±2,1* |
4,0±1,7 |
3,0±1,4 |
|
ПСА (общий), нг/мл |
3,40±0,96 |
1,3±0,42* |
1,08±0,32 |
1,02±0,27 |
|
Qmax, мл/с |
7,3±4,2 |
14,7±4,5* |
15,9±3,7 |
16,7±3,4 |
|
Объем ПЖ, см³ |
111,6±52,6 |
73,4±8,3* |
64,29 ±5,37^ |
61,14 ±4,47 |
|
Объем узла, см³ |
87,8±9,8 |
52,90±5,17 |
43,26±6,67^ |
39,21±6,11 |
Примечания: * – результат, достоверный по сравнению с данными до лечения (P<0,05);
^ – результат, достоверный по сравнению с данными через 6 мес. после лечения (P<0,05);
IPSS - The International Prostate Symptom Score, ПСА – простатспецифический антиген,
Qmax – maximum urinary flow rate.
Через 6 месяцев достоверно уменьшилось количество симптомов по шкале IPSS, увеличилась Qмакс. Эта тенденция сохранилась и в течение полугодового периода, при наблюдении за пациентами в течение 24 месяцев после эмболизации достигнутый эффект был стабилен. Объем ПЖ уменьшился с 111,6±52,6 до 73,4±8,3 см3, уменьшение узлового образования с 87,8±9,8 до 52,90±4,7 см3, максимальный эффект – уменьшение объема железы на 82%.
19 пациентам в различные сроки после ЭПА выполнена ТУРП.
Этим пациентам соматический статус не позволял выполнить показанное открытое оперативное вмешательство, но стало возможным выполнение ТУРП за счет уменьшения объема железы менее 80 см3, благодаря ЭПА. Критериями для включения в данную группу было, помимо редукции объема простаты, наличие нижеуказанных факторов или их сочетание:
• сохранение выраженных СНМП (IPSS более 12 баллов);
• Qol более 3;
• максимальная скорость мочеиспускания менее или равна 12 мл/сек.
ТУРП выполнялась в урологическом отделении Негосударственного учреждения здравоохранения «Отделенческая клиническая больница на станции Барнаул открытого акционерного общества «Российские железные дороги». Операция выполнялась на установке THUNDERBEAT (OLYMPUS, Japan).
У всех больных данной группы мочеиспускание восстановлено не позднее 2 суток после вмешательства, результаты долгосрочного наблюдения - 6 и более месяцев достоверно не отличались от таковых после стандартной ТУРП по данным других исследований.
Гистологические препараты резецированной ткани, подтверждают эффективность ЭПА (рис. 3, 4).
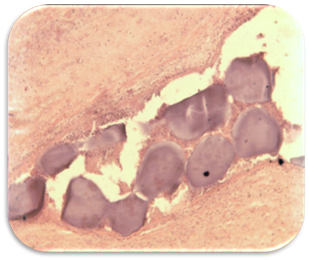
Рис. 3. Скопление частиц эмболов в просвете сосуда в зоне полного некроза ткани. В ткани вокруг эмболов множественные мелкие фрагменты распавшихся ядер погибших клеточных элементов (1 месяц после ЭПА)
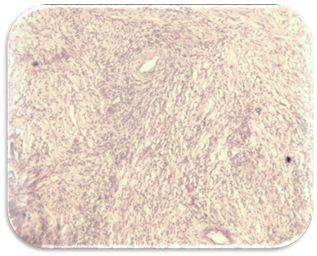
Рис. 4. Новообразованная фиброзная ткань (3 месяца после ЭПА)
У 6 пациентов не было отмечено какого-либо значимого эффекта после выполнения ЭПА, 3 из них выполнена повторная процедура, эффективность которой была неоднозначной.
Выводы
Эмболизация простатических артерий при ДГПЖ, безусловно, является новым и эффективным методом лечения, расширяющим возможности медицинской помощи различным группам пациентов. Учитывая его новизну, разнящиеся результаты эффективности процедуры у разных исследователей, ежегодно появляется все больше публикаций, где авторы экспериментируют с размером эмболизационных частиц, длительностью их введения, анализируют случаи неэффективности процедуры, связывая их с индивидуальными особенностями сосудистой архитектоники каждого больного, например наличием дополнительных источников кровоснабжения предстательной железы [11]. Лишь только дополнительные исследования с апробацией различных модификаций процедуры, анализом случаев неудачного лечения позволят добиться лучших результатов работы.
Результатом нашей работы, основанной на более чем 7-летних результатах наблюдений за отдельными больными, стали рекомендации по ведению пациента после проведенной ЭПА (рис. 5).
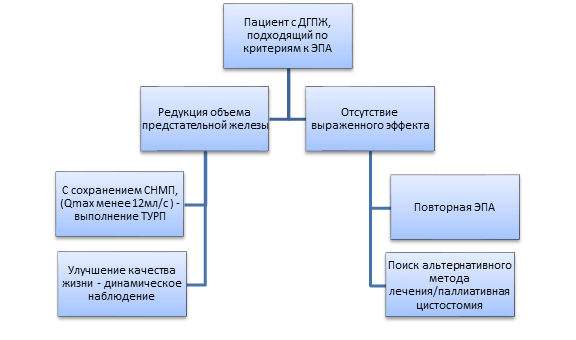
Рис. 5. Схема ведения больного после выполненной ЭПА
Таким образом, ЭПА зарекомендовала себя как самодостаточный метод лечения ДГПЖ, предоперационный метод перед выполнением ТУРП при крупных аденомах простаты, альтернативный хирургический метод лечения, позволяющий избежать таких осложнений, как ретроградная эякуляция, для лиц, желающих сохранить физиологичную и адекватную репродуктивную функцию. Последний момент доказан в 2008 году при эксперименте на животных, а также по результатам собственных наблюдений [12].



