На сегодняшний день описано множество генотипов гемоглобина, которые можно разделить на три группы: постоянно присутствующие в крови человека; появляющиеся только на определенных этапах развития организма и патологические. В последние годы повышается интерес к отдельным типам гемоглобина как диагностически значимым маркерам. Гетерогенная система гемоглобина человека является каноническим примером сложной полифункциональной белковой системы, включающей белее 300 изотипов этого протеина. Одним из самых манифестных и значимых типов гемоглобина является эмбриоспецифический протеин – плодовый (фетальный) гемоглобин (HbF). Это железосодержащий тетрамер, состоящий из двух α- и двух γ-цепей. Изоэлектрическая точка белка, по данным разных авторов, составляет 6,9–7,15. Синтез плодового гемоглобина человека начинается с 12–13 недели гестации, и к 6 месяцам этот белок полностью замещает собой онтогенетически более ранний эмбриональный гемоглобин. Концентрация HbF к моменту рождения составляет 50–80 % от общего гемоглобина. В крови взрослого здорового человека на долю плодового гемоглобина приходится не более 1,5 % от общего гемоглобина [5, 6].
Многочисленные литературные данные последних лет свидетельствуют о высокой диагностической значимости HbF. Его концентрация в крови достоверно изменяется при талассемиях, анемиях, патологии новорожденных, гипоксических состояниях, заболеваниях легких, эндокринных нарушениях, интоксикациях и др. [1, 2, 7, 9].
В современной клинической практике большинства стран для количественного анализа гемоглобинов в качестве стандартных применяются колориметрические циангемоглобиновые методы, рекомендованные комитетом по стандартизации Европейского и Международного Общества по Гематологии. Большинство колориметрических методов количественного определения гемоглобина не отличаются избирательностью: с их помощью определяется лишь общее количество гемоглобина крови, а не отдельные его типы. Даже в случае определения щелочеустойчивой фракции гемоглобина по Зингеру и Бетке регистрируются несколько типов гемоглобина, а не только плодовый гемоглобин [5, 6, 7].
В связи с вышесказанным, в последние годы ведется активный поиск и разработка новых оптимальных алгоритмов по количественному анализу плодового гемоглобина человека [6, 8, 9].
Актуальным и целесообразным является моделирование иммунохимических тест-систем на HbF, отличающихся абсолютной специфичностью и высокой точностью определения
Цель исследования: разработка иммунохимического теста количественного анализа плодового гемоглобина человека и его широкая клиническая апробация.
Материалы и методы исследования
Исследование было проведено в период с 2007 по 2015 г. на биоматериале общей численностью 945 образцов (табл. 1).
Таблица 1
Перечень использованного в работе материала
|
Материал |
Число образцов |
|
Кровь гематологических больных |
243 |
|
Кровь наркологических больных |
95 |
|
Пуповинная кровь новорожденных |
194 |
|
Кровь пациентов с заболеваниями печени |
202 |
|
Кровь здоровых доноров (группы контроля) |
211 |
|
ВСЕГО |
945 |
В работе применяли методы механически-термического гемолиза, комбинированной щелочной денатурации (поэтапная обработка гемолизата раствором сернокислого аммония 50 % насыщенности и 1,2 М раствором едкого натра с последующей седиментацией при 8000 g), препаративного электрофореза в агаровом геле на 0,1 М цитратном буфере с рН 6,0 (в авторской модификации), аналитического электрофореза в полиакриламидном геле, ионообменной хроматографии на ДЕАЕ-сефадексе А-50 и гель-фильтрации на сефадексе G-200. Антисыворотки получали путем иммунизации кроликов породы «шиншилл» дробными дозами очищенного антигена с адъювантом Фрейнда по стандартной схеме. Для качественной и количественной регистрации белков в исследуемом биоматериале использовали: определение общего гемоглобина спектрофотометрически при 280 и 260 нм по Варбургу, иммунодиффузионное титрование по Ouchterlony, ракетный электрофорез в агаровом геле по Laurell [3].
Для математической обработки и оценки статистической значимости результатов исследования использовали лицензионный пакет прикладных программ статистического анализа Statistica 6.0 (StatSoft, Inc., США), Excel-2007 (Microsoft). Для каждой выборки вычисляли средние величины (М), среднее квадратичное отклонение (σ), средние ошибки средней арифметической (m). С целью определения значимости р различий сопоставляемых величин применяли критерий t Стьюдента с поправкой Бонферрони и однофакторный дисперсионный анализ с вычислением критерия F Фишера. Различия считали значимыми при р < 0,05. Для оценки межгрупповой зависимости проводили линейный корреляционный анализ Пирсона (коэффициент корреляции – r). Корреляция считалась высокой при приближении модульной величины r к единице. Статистические взаимосвязи между показателями оценивали применением корреляционного, регрессионного анализа и методов многомерной статистики [4].
Результаты исследования и их обсуждение
Ранее нами были получены новые данные по физико-химическим свойствам HbF и разработан оптимальный алгоритм выделения и очистки этого белка [7, 8], что легло в основу представленной работы, в ходе которой был использован очищенный препарат HbF для иммунизации кроликов и получения специфических иммунных антисывороток.
Нами проведена масштабная работа, включающая следующие, успешно завершенные этапы:
- Моделирование моновалентной иммунохимической тест-системы на плодовый гемоглобин человека;
- Разработка оптимального алгоритма количественного определения HbF;
- Широкая клиническая апробация нового иммунохимического теста на HbF.
На первом этапе работы была смоделирована моновалентная иммунохимическая тест-система на HbF, в которой тест-антигеном являлся гемолизат пуповинной крови в разведении: 1/128, порог чувствительности тест-системы – 2,24±0,26 мг/л (р<0,005).
Селективность и чувствительность полученной тест-системы была верифицирована путем иммунохимического анализа с необходимым антигенным материалом, специфического окрашивания бензидиновым и гваяколовым методами, иммуноэлектрофорезом и иммунодиффузией по Оухтерлони.
Полученную иммунохимическую тест-систему в дальнейшем использовали для разработки оптимального способа количественного анализа плодового гемоглобина.
Для данной цели был разработан способ ракетного электрофореза в агаровом геле с додецилсульфатом натрия [8]. Корреляционный анализ Пирсона показал высокую прямую зависимость концентрации HbF от квадрата диаметра кольца преципитации (r=0,96; p<0,001). Преимущества способа: специфичность, высокая чувствительность (порог чувствительности – 1,72±0,27 мг/л), точность (максимальная погрешность ±2%), экономия времени (8-10 ч), значимость регистрации, в том числе и при определении малых величин гемоглобина (F=8,3; р<0,01).
На заключительном этапе работы проведена апробация разработанного теста на широком клиническом материале, результаты которой приводятся ниже.
- Миелопролиферативные заболевания
Отмечено значительное достоверное (t>4,65; p<0,005) повышение концентрации HbF в крови больных эритремией (на 78,9 % выше референтных значений), сублейкемическим миелозом (на 42,8 %), острым (на 58,1 %) и хроническим (на 70,2 %) миелолейкозом.
Для дополнительной верификации полученных результатов в тех же выборках было проведено их конвертирование в относительные величины: процент от общего гемоглобина в каждой нозологической группе. Полученные данные (в %) в целом адекватно соотносились с результатами иммунохимического тестирования HbF (в мг/л) (рисунок).
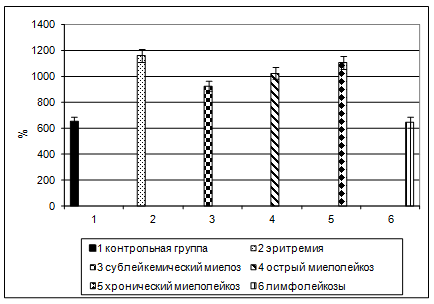
Уровень HbF при некоторых гемобластозах
Полученные результаты свидетельствуют, что плодовый гемоглобин может рассматриваться как канцероэмбриональный антиген, иммунохомическая регистрация которого может повысить качество диагностики миелопролиферативных заболеваний. Следует отметить, что в силу дешевизны, простоты и доступности (для проведения тестов на HbF по предложенной схеме достаточно 0,1 мл крови из пальца), разработанный иммунохимический тест на HbF может применяться в скрининг-обследовании групп риска по данной нозологии.
- Патология новорожденных
Проведен иммунохимический анализ HbF у новорожденных с внутриутробной гипоксией и сопутствующей патологией. Показано значительное достоверное (t=5,53; p<0,002; F>4,9) повышение уровня HbF в крови новорожденных с тяжелой внутриутробной гипоксией (на 30,1% выше, чем в группе контроля), и, особенно, с задержкой внутриутробного развития в сочетании с тяжелой внутриутробной гипоксией (на 68,5%). Концентрация HbF в крови новорожденных с массой тела менее 1000 г, наоборот, оказалась на 58,3% ниже, чем в контрольной группе (t=7,2; p<0,001; F=9,1).
Сравнительный анализ уровня плодового гемоглобина у новорожденных по гендерному признаку показал, что уровень HbF в крови новорожденных девочек достоверно (t=4,9; p<0,001; F=7,1) превышает таковой у новорожденных мальчиков. И если в группе здоровых детей эта разница невелика, то в группе новорожденных с внутриутробной гипоксией уровень HbF в крови новорожденных девочек значительно выше, чем у мальчиков (t=7,3; Р<0,0005; F=6,8).
Полученные данные о повышении уровня плодового гемоглобина при гипоксии, очевидно, объясняются тем, что этот протеин имеет бóльшее сродство к кислороду, чем гемоглобин взрослого, следовательно, увеличение уровня HbF в крови способствует более оптимальному тканевому газообмену в условиях тканевой гипоксии. Значительный разброс средних концентраций HbF в крови новорожденных мальчиков и девочек с внутриутробной гипоксией можно объяснить более высокими компенсаторными возможностями женского организма в этом онтогенетическом периоде.
- Наркоманическая и алкогольная зависимость
Иммунохимический анализ уровня плодового гемоглобина у больных с алкогольной зависимостью и пациентов с опийной наркоманией показал манифестные результаты. Показано значительное превышение концентрации HbFв крови больных алкогольной зависимостью и опийной наркоманией почти в три раза, по сравнению с уровнем концентрации этого белка в крови доноров контрольной группы (табл. 2). Анализ статистической значимости полученных результатов показал высокую степень достоверности как в группе больных опийной наркоманией (t=7,20; Р<0,001), так и в группе больных алкоголизмом (t=6,39; Р<0,001).
Таблица 2
Показатели HbF в крови наркологических больных
|
Исследуемая группа |
n
|
Концентрация HbF (мг/л) |
Процент HbF от общего Hb |
|
Кровь больных опийной наркоманией |
50 |
1847±97 |
4,25 |
|
Кровь больных алкоголизмом |
45 |
1632±84 |
3,77 |
|
Кровь здоровых (контрольная группа) |
43 |
653±46 |
1,52 |
Экспрессия гамма-гена плодового гемоглобина у наркологических больных, по нашему мнению, объясняется тем, что метаболический диссонанс, возникающий в результате хронической интоксикации психоактивными веществами, затрагивает процессы митохондриального тканевого дыхания, что приводит к развитию гипоксических состояний. А HbF, как было сказано выше, является ферропротеином, эволюционно адаптированным к оптимизации тканевого газообмена в условиях хронической гипоксии. С другой стороны, возможно в результате хронической интоксикации ПАВ, в некоторых гемопоэтических стволовых клетках возникает трансформация генетических структур, ведущая к изменению интенсивности синтеза фетального гемоглобина.
Заключение
Иммунохимический тест на плодовый гемоглобин является абсолютно специфичным и высокочувствительным диагностическим тестом на данный белок. Его широкое внедрение в клиническую практику, безусловно, повысит качество и эффективность диагностики в соответствующих нозологических сферах.



