В структуре глазного травматизма поражения роговицы и их последствия составляют 30 % и более [2]. Большая часть пациентов с травмами глаза – молодые мужчины, в большинстве случаев поражается передний сегмент глаза [9]. Несмотря на активную терапию травматических повреждений роговицы, исходы чаще сопровождаются значительным стойким снижением остроты зрения, что связано с формированием рубца в оптической зоне, развитием роговичного астигматизма, повреждением внутриглазных структур. Необходим поиск и внедрение новых препаратов, способствующих улучшению регенеративных свойств роговицы и формированию более нежного рубца [3].
Цель исследования – оценка эффективности применения ИМН «Бол-хит» на модели проникающего ранения роговицы у кроликов.
Материал и методы. Использованное в исследовании ИМН «Бол-хит» содержит 2 % хитозан молекулярной массы от 100 до 700 kDa и степени дезацетилирования свыше 95 %, аскорбиновую кислоту – 1,8 г, хондроитинсерную кислоту – 5-100 мг, гиалуроновую (Д-глюкуроновую) кислоту – 10–100 мг, сывороточный фактор роста крупного рогатого скота «адгелон» – 11–220 мкг, гепарин – 2,5–5 мг. Изделие запатентовано на территории Российской Федерации [4–8], на базе лабораторно-испытательного центра НИИ ФХМ МЗ РФ подтверждено разрешение к использованию по показателю «токсичность» (аттестат № ФС 02-ПТИ-04 от 10.03 2004 г., регистрация в реестре ФС 16.08.2004 г.), проведены санитарно-химические и токсикологические испытания продукта для офтальмологии (протокол № 1612.007 от 13.08.2007 г.). Изделие отвечает требованиям, предъявляемым к изделиям медицинского назначения [1].
Исследование проводили на 6 кроликах обоего пола (12 глаз) массой 1,5–2,5 кг. Кролики были разделены на две группы – опытную и контрольную, по 3 кролика (6 глаз) в каждой группе. Кроликам обеих групп в условиях операционной под общим и местным обезболиванием наносили типовые линейные проникающие роговичные разрезы на протяжении от 11 до 19 часов условного циферблата стальным кератомом «Оптимед» 2,75 мм. В послеоперационном периоде при условии адаптации краев раны проводили лечение: кроликам опытной группы – инстилляции ИМН «Бол-хит» 4 раза в сутки, кроликам контрольной группы – инстилляции водного раствора левомицетина 0,25 % и декспантенола 3 раза в сутки. В послеоперационном периоде в течение месяца ежедневно проводили офтальмологический осмотр, который включал оценку состояния век, конъюнктивы, роговицы, передней камеры, радужки, хрусталика, стекловидного тела, сетчатки. Осмотр производился прямым офтальмоскопом WelchAllyn (США). В течение двух недель производили биомикроскопию глаз при помощи щелевой лампы и выполняли флюоресцеиновую пробу для оценки формирования роговичного рубца. Результаты осмотра фиксировали в дневнике наблюдений. Оценивали степень выраженности и вид инъекции глазного яблока, состояние роговицы (степень выраженности отека, динамику заживления раны, наличие неоваскуляризации). Кроликов выводили из эксперимента методом воздушной эмболии в следующие сроки: 2 недели (2 кролика), 1 месяц (2 кролика), 3 месяца (2 кролика). Производили энуклеацию глаз для последующего проведения оптической когерентной томографии роговицы глаза и гистологического исследования срезов роговицы методом окраски гематоксилин-эозином. Все манипуляции с экспериментальными животными производились с соблюдением принципов гуманного обращения согласно приказу МЗ СССР № 755 от 12.08.1977, европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (Страсбург, 18. 03. 1986).
Оптическую когерентную томографию роговицы энуклеированных глаз выполняли на томографе RTVue-100 (компания – производитель «Оptovue», США) на базе КГБУЗ «Краевая офтальмологическая больница», г. Барнаул. Гистологический анализ срезов роговицы производился на базе патолого-анатомического отделения КГБУЗ «Городская больница № 8», г. Барнаул с помощью светового микроскопа Leica (Leica Microsystems, Германия – Швейцария), фотографирование препаратов осуществлялось с помощью цифровой камеры Canon и персонального компьютера.
Результаты и их обсуждение. Послеоперационный период в контрольной и опытной группах протекал без особенностей. На второй день после операции отмечались умеренные светобоязнь, слезотечение, слизисто-гнойное отделяемое из конъюнктивальной полости, умеренный отек роговицы в области раны. Адаптация краев раны, восстановление передней камеры отмечены у всех кроликов ко второму дню после операции. Воспалительные явления глаз у кроликов контрольной группы стихли к седьмому дню после операции, у кроликов опытной группы – к девятому дню. Остаточные явления воспаления (гиперемия конъюнктивы) в обеих группах сохранялись до 14 дней после операции. В обеих группах лечение протекало благоприятно, препараты хорошо переносились, не отмечено побочных явлений и аллергических реакций.
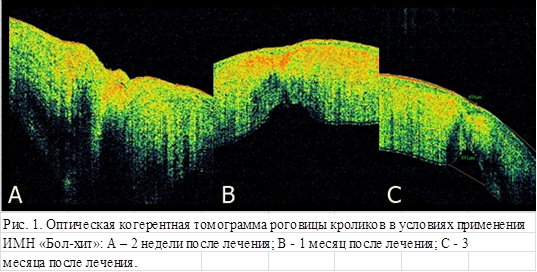
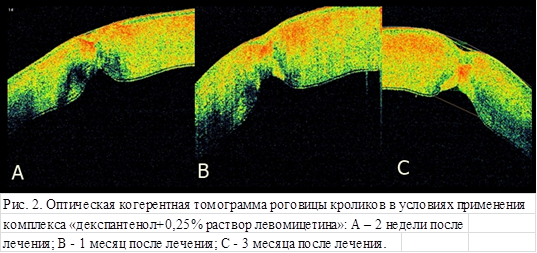
Известно, что на томограммах участки с высокой светоотражающей способностью имеют красно-белые оттенки, в более прозрачных участках преобладает черный цвет. Например, неизмененное оптически прозрачное стекловидное тело на томограмме имеет черный цвет, а слой нервных волокон и пигментный эпителий сетчатки, обладающие хорошей фоторефлективностью, создают красный цвет [10]. По данным проведенной нами оптической когерентной томографии оценена интенсивность и плотность роговичного рубца по интенсивности и преобладанию красно-белых, теплых оттенков в строме роговицы. На томограммах роговицы кроликов достаточно четко визуализируются пять слоев: эпителий, боуменова оболочка, строма, десцеметова мембрана, эндотелий.
В опытной группе через две недели после ранения видно уплотнение поверхностных слоев стромы, раневой канал закрыт, однако со стороны эндотелия в области раны имеется утолщение стромы, эндотелий слабо визуализируется. Возможно, это связано с отеком роговицы (рис. 1А). В контрольной группе в области ранения видно сформированное уплотнение стромы на 2/3 толщины роговицы, втяжение эндотелия в область раневого канала, истончение роговицы и разрежение стромы в этой области (рис. 2А).
Спустя 1 месяц после ранения, в опытной группе кроликов в области ранения просматривается практически сформированный рубец в виде уплотнения стромы на 2/3 роговицы, её истончение и втяжение эндотелия, со стороны эндотелия в области рубца роговица более прозрачна в сравнении с контрольной группой (рис. 1В). В контрольной группе наблюдается не только большая плотность стромы в области рубца, но и более глубокий дефект стромы со стороны эндотелия (рис. 2В).
На томограммах роговицы кроликов, выведенных из эксперимента после трехмесячного срока лечения и наблюдения, достаточно четко видны все слои роговицы. В области сформировавшегося рубца контрольной группы со стороны эпителия имеется углубление, что может свидетельствовать о деформации слоев роговицы, сформированный рубец более грубый, плотный, видна деформация стромы роговицы (рис. 2С), что не наблюдается в опытной группе животных. Оптически роговица наиболее прозрачна в области рубца в опытной группе (рис. 1С).
Гистологическое исследование, были направлены представленные выше образцы.
В опытной группе (ИМН «Бол-хит) на 14-е сутки после лечения (рис. 3А) гистологический анализ показал утолщение эпителиального слоя за счет активно пролиферирующего базального слоя, выявил многочисленные фигуры митоза с сохранением незначительного отека эпителия в виде вакуолизации. Волокна собственного вещества, рыхлые, набухшие, с образованием складок роговицы, отмечена активная пролиферация и миграция фибробластов стромы в область повреждения, беспорядочное расположение новообразующихся волокон. Воспалительный инфильтрат отсутствовал.
К концу первого месяца (рис. 3В) отек эпителия и собственного вещества сохранялся, однако ткани роговицы оставались спокойными, воспалительный инфильтрат отсутствовал. В эпителии – участки пролиферации, количество слоев до 5–6. Новообразованные волокна в большом числе располагались правильно, сохранялась слабая активность фибробластов.
В срок 3 месяца (рис. 3С) cохранялся слабо выраженный отек собственного вещества. Эпителий состоял из 5 слоев клеток, базальные клетки преимущественно вытянутые, регенерация отсутствовала. Воспалительные клетки в эпителии и строме отсутствовали. Фибробласты единичные, располагались параллельно базальной мембраны. Определялись значительные участки, где собственная ткань роговицы имела нормальное строение.
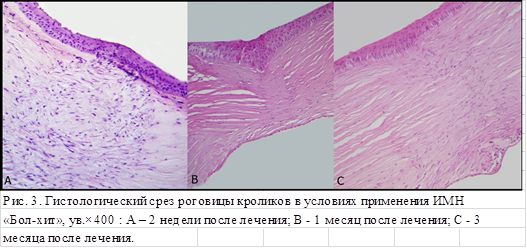
Таким образом, лечение с помощью ИМН «Бол-хит» приводит к формированию рубца с минимальной деформацией эпителиального слоя и стромы роговицы.
В группе контроля (декспантенол и раствор левомицетина 0,25 %) гистологический анализ на 14-е сутки (рис. 4А) выявил умеренный выраженный отек эпителия и собственного вещества: вакуолизацию эпителия, набухание и разрыхление волокон, складки Боуменовой капсулы. Отмечена активная пролиферация молодых элементов фибропластического ряда с формированием нежной волокнистой грануляционной ткани. Воспалительный инфильтрат отсутствовал. Эпителий резко утолщен, состоит из 9 слоев. Клетки выстроены с нарушением стратификации слоев. Ядра базального слоя вытянутые или округлые, митозов нет – пролиферация эпителия завершена.
К концу 1-го месяца (рис. 4В) – уменьшение отека собственного вещества и формирование нежной волокнистой соединительной ткани с выраженной активностью фибробластов, а также регенерация эпителия в виде толстого пласта на значительном протяжении, состоящего из 8 слоев клеток.
В срок 3 месяца (рис. 3С) эпителий роговицы имел четко выстроенную структуру, состоял из 8 слоев клеток, отек и признаки регенерации отсутствовали. В строме сохранялся умеренный отек. Фибробласты единичные, с минимальной активностью, располагались параллельно базальной мембраны, единичные участки с нормальным строением собственной ткани роговицы.
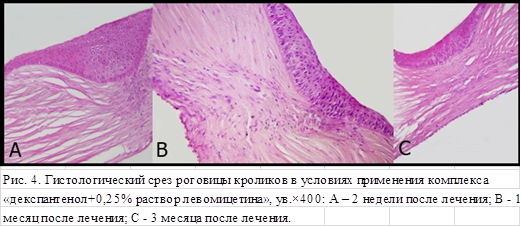
Таким образом, в результате лечения комплексом декспантенол-левомицетин 0,25 % формируется рубец с утолщённым эпителиальным слоем роговицы, небольшой деформацией стромы.
Заключение
Динамика заживления роговичной раны и процесс формирования рубца после проникающего ранения с помощью сопоставления данных оптической когерентной томографии и гистологического анализа показали, что лечение указанного дефекта роговицы как с использованием декспантенола и 0,25 % раствора левомицетина, так и ИМН «Бол-хит», способствовало благоприятному течению раневого процесса без осложнений. В результате применения ИМН «Бол-хит» сформирован рубец с нормальным количеством слоев эпителиальных клеток, минимальной деформацией структуры стромы, что предполагает обеспечение более высоких зрительных функций в отдаленные сроки после ранения. ИМН«Бол-хит» рекомендуется в качестве протектора роговицы, стимулятора процессов регенерации при её травматических повреждениях и заболеваниях.



