Искусственное снижение температуры тела как метод снижения кислородных запросов организма успешно применяется для повышения устойчивости органов и тканей к различным видам стресса, защиты организма от травматических повреждений, восстановления функции органов и тканей после ишемии-реперфузии [3]. Наряду с повышением устойчивости организма к воздействию многих неблагоприятных факторов, гипотермия вызывает ряд нежелательных изменений. При снижении температуры тела происходит нарушение микроциркуляции, обусловленное вазоспазмом и централизацией кровотока, а также повышением вязкости крови [8]. Негативными эффектами гипотермии являются также смещение прооксидантно-антиоксидантного баланса в сторону избыточной генерации свободных радикалов и возникновение дефицита антиоксидантов [12]. Это в свою очередь, может быть причиной изменения физико-химического состояния эритроцитарных мембран [8] и нарушения работы мембраносвязанных ферментов.
Na, K-АТФаза является интегральным ферментом мембран эритроцитов, участвующим в регуляции ионного гомеостаза красных клеток. Ранее на изолированных мембранах эритроцитов крыс нами было установлено, что глубокая гипотермия (20 °С) снижает активность Na, K-АТФазы [6]. При гипотермии увеличивалось количество связанного с мембранами эритроцитов гемоглобина. Снижение активности Na, K-АТФазы при гипотермии отрицательно коррелировало с количеством связанного с мембранами гемоглобина. В процессе получения белых теней эритроцитов мембрана теряет ряд белков, особенно цитоскелета [5], что может отразиться на активности Na, K-АТФазы. В связи с этим представляет интерес исследование активности Na, K-АТФазы в составе цельных эритроцитов в условиях гипотермии.
Даларгин (Тир-D-Ала-Гли-Фен-Лей-Арг) является синтетическим аналогом нейропептида лей-энкефалинас широким спектром биологической активности. Важным эффектом пептида является антистрессорный, проявляющийся и при гипотермии [7]. Даларгин препятствует развитию стрессорной вазоконстрикции [1]. Нами показано, что предварительное введение даларгина предотвращает активацию процессов перекисного окисления липидов и снижение антиоксидантной защиты эритроцитов [10], а также стабилизирует структурно-функциональное состояние их мембран при умеренной гипотермии у крыс [9]. Учитывая тот факт, что Na, K-АТФаза весьма чувствительна как к составу липидов в микроокружении фермента, так и к их физико-химическому состоянию [13], представляет интерес изучение влияния даларгина на активность Na, K-АТФазы эритроцитов в условиях гипотермии.
Цель работы. Исследовать зависимость активности Na,К-АТФазы эритроцитов и содержания ионов Na+ и K+ в плазме крови и эритроцитах крыс от глубины гипотермии, а также возможности коррекции обнаруженных изменений путем введения даларгина.
Материалы и методы исследования. Эксперименты проведены на самцах беспородных белых крыс массой 180–200 г. Гипотермию вызывали охлаждением животных в плексигласовых камерах с рубашкой, через которую циркулировала холодная (5 °С) вода. Температуру тела крыс равномерно (0,28 °С/мин) снижали до 30 °С (кратковременная умеренная гипотермия) и 20 °С (глубокая гипотермия). За 30 мин до декапитации (контроль) или за 30 мин до начала снижения температуры тела животным внутрибрюшинно вводили 0,5 мл фармакопейного препарата даларгина в дозе 100 мкг/кг массы. После декапитации животного собирали кровь в пробирку с гепарином (50 ед/мл). Эритроциты осаждали центрифугированием при 2000 об/мин в течение 10 мин, а затем трижды промывали 0,145 М раствором NаСl, приготовленном на 0,02 М трис-НСl буфере (рН 7,6 при 20 °С).
Активность Na, К-АТФазы в цельных эритроцитах определяли по методу Казёнова А.М. и сотр. [4]. Для образования пор, проницаемых для АТФ, эритроциты обрабатывали твином-20. Преинкубацию цельных эритроцитов с твином-20 проводили в следующих условиях: отмытые эритроциты смешивали с равным объёмом 1 % твина-20, приготовленного на 0,145 М NаСl в 0,02 М трис-НСl буфере, и смесь инкубировали при комнатной температуре в течение 60 мин. Далее взвесь эритроцитов разводили в 4 раза 0,145 М NаСl в 0,02 М трис-НСl буфере без детергента. Для определения активности Na,К-АТФазы 0,2 мл конечной суспензии эритроцитов, обработанных твином-20, вводили в 1 мл инкубационной среды, содержащей (в мМ концентрациях) Na+– 100, К+– 10, трис-НСl – 50, АТФ – 3, МgCl2 – 3, ЭДТА – 1. Инкубацию проводили при 37 °С в течение 30 мин. Реакцию останавливали добавлением 0,5 мл 20 % ТХУ. Активность Na, К-АТФазы рассчитывали по разнице между АТФ-азной активностью в отсутствии и присутствии 0,2м Муабаина. Об активности фермента судили по накоплению в среде инкубации неорганического фосфора и выражали в мкмоль Рн/мл/ч.
Содержание ионов натрия и калия в плазме крови и эритроцитах определяли на атомно-абсорбционном спектрофотометре AAS-1N (CarlZeiss, Германия).
Статистическую обработку результатов осуществляли с помощью пакетов прикладных программ Statistica 6.0 и Excel общепринятыми методами вариационной статистики. В таблице результаты представлены в виде средних значений (М) ± стандартная ошибка (m). Для определения статистической значимости полученных результатов были использованы: параметрический t-критерий Стьюдента (t-тест), непараметрический U-критерий Манна – Уитни (U-тест). Достоверно различающимися признавали значения при р<0,05.
Результаты исследования и их обсуждение. Острая кратковременная гипотермия 30 °С приводит к повышению активности Na, K-АТФазы на 38 % относительно контроля (баблунок). При глубокой гипотермии активность фермента остается повышенной, хотя несколько снижается относительно умеренной гипотермии. Таким образом, независимо от длительности гипотермии активность Na, K-АТФазы эритроцитов повышается.
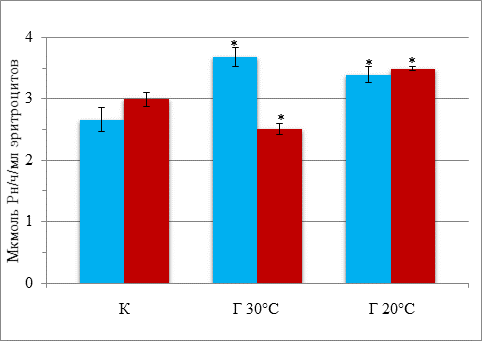
Активность Na, K-АТФазы эритроцитов при гипотермии и введении даларгина
![]() – без введения даларгина;
– без введения даларгина; ![]() – на фоне введения даларгина;
– на фоне введения даларгина;
К – контроль; Г30 °С и Г20 °С – гипотермия 30 °С и 20 °С соответственно.
* – достоверность различий относительно контроля
Ранее на отмытых от гемоглобина мембранах эритроцитов крыс нами было обнаружено снижение активности этого фермента при гипотермии 20 °С [6]. Чем же объяснить такие различия в изменении активности фермента в цельных эритроцитах и в белых тенях эритроцитов при гипотермии? Было показано, что последовательное удаление внутриклеточного содержимого и периферических белков мембран эритроцитов крыс – спектрина и актина, сопровождается прогрессивным падением активности Na, K-АТФазы [5]. Авторы показали, что как в гемолизате эритроцитов, так и в растворе смеси солюбилизированных белков мембран цитоскелета присутствуют факторы, активирующие Na, K-АТФазуэритроцитарной мембраны и головного мозга крыс, причем степень эффекта зависела от вида мембран и проявляется более выражено в случае мембранных препаратов, лишенных периферических белков. Недавно было показано, что в зависимости от способа получения теней эритроцитов и солюбилизированных белков мембранного скелета наблюдается как активирование, так и ингибирование Na, K-АТФазы удаленными с мембраны белками скелета [11]. Авторы пришли к выводу, что в смеси солюбилизированных белков мембранного скелета эритроцитов содержится фактор (факторы) Mg2+, Ca2+-зависимо модулирующие активность Na, K-АТФазы. Эти данные позволяют предположить, что внесение ЭДТА на стадии гемолиза эритроцитов и отмывания мембранных препаратов от внутриклеточного содержимого способствует удалению из препаратов мембран веществ, оказывающих модулирующее влияние на активность Na, K-АТФазы при гипотермии.
Активность и свойства транспортных АТФаз плазматических мембран в значительной степени определяются структурными особенностями липидного матрикса, в который погружены молекулы фермента [13]. Исследование структурных свойств мембран эритроцитов с помощью флуоресцентного зонда пиренане выявило изменение вязкости липидного бислоя после снижения температуры тела крыс до 30 и 20 °С [9]. В то же время выявлено зависимое от температуры тела снижение микровязкости зон белок-липидных контактов, которые представлены аннулярными липидами, составляющими микроокружение мембранных белков. Введение даларгина предотвращало изменение текучести аннулярных липидов.
В работе Хашимото и коллег [14] было показано, что уменьшение вязкости аннулярных липидов коррелирует с увеличением активности некоторых ферментов, в том числе Mg2+-АТФазы. Кроме того, в той же работе было обнаружено, что добавление докозагексаеновой жирной кислоты уменьшает вязкость аннулярных липидов сильнее, чем вязкость липидов всей мембраны в целом. Эти результаты позволяют предположить, что при гипотермии происходит избирательное накопление фосфолипидов с ненасыщенными жирнокислотными остатками в микроокружении мембранных белков. Это возможно за счет латеральной сегрегации липидов в мембране, а также за счет обмена с липидами и липопротеинами плазмы. При развитии гипотермии ускоряется гормонзависимый липолиз депонированных липидов и существенно возрастает уровень свободных жирных кислот в плазме крови [12]. В ходе снижения температуры тела в спектре жирных кислот плазмы крови крыс возрастает содержание ненасыщенных жирных кислот, что отражает участие последних в мембранных процессах, препятствующих понижению «текучести» липидов мембран клеток. Следует отметить, что введение даларгина предотвращает обусловленную холодовым стрессом секрецию гормонов и, соответственно, мобилизацию депонированных липидов [12].
Причиной активации Na, K-АТФазы при гипотермии может быть также увеличение неспецифической проницаемости мембраны эритроцитов для Na+. В этих условиях активация АТФазы является необходимым условием для восстановления ионного баланса внутри клетки. Для проверки этого предположения было исследовано содержание ионов натрия и калия в плазме крови и в эритроцитах. Изменение активности Na, K-АТФазы после гипотермии 30 °С не оказало значимого влияния на баланс одновалентных катионов в эритроцитах (таблица). Концентрация ионов Na+ иK+ во вне (ex)- и внутриклеточной (in) среде оставалось без изменений. Соответственно, отношение Naex+/Nain+ и Kex+/Kin+ совпадает у контрольных и подвергнутых гипотермии 30 °С крыс. После гипотермии 20 °С отношение Naex+/Nain+значительно снижается, а отношениеKex+/ Kin+ – существенно возрастает. Такое соотношение процессов указывает на повышение проницаемости эритроцитарных мембран для этих ионов.
Баланс одновалентных катионов в плазме крови и эритроцитах крыс в условиях гипотермии и введении даларгина (M±m; n = 6-8)
|
Состояние животного |
Na+, моль/л |
К+, моль/л |
||||
|
плазма (ex) |
эритроцит (in) |
ex/in |
плазма (ex) |
эритроцит (in) |
ex/in |
|
|
Контроль |
133,9±1,21 |
18,6±0,21 |
7,20 |
4,76±0,41 |
91,4±0,63 |
0,051 |
|
Контроль+ даларгин |
137,4±1,16 |
19,2±0,34 |
7,16 |
5,10±0,23 |
92,6±0,83 |
0,057 |
|
Гипотермия 30°С |
138,8±1,79 |
19,2±0,42 |
7,23 |
5,53±0,39 |
90,2±0,91 |
0,061 |
|
Гипотермия 30°С + даларгин |
135,1±1,65 |
18,6±0,64 |
7,26 |
4,87±0,29 |
92,6±0,92 |
0,052 |
|
Гипотермия 20°С |
117,9±2,07* |
23,7±0,49* |
4,97 |
6,46±0,26* |
76,3±1,67* |
0,084 |
|
Гипотермия 20°С + даларгин |
117,7±1,16* |
21,6±0,38* |
5,45 |
6,29±0,21* |
77,6±0,42* |
0,080 |
* – достоверные (р<0,05) относительно контроля различия.
Возникновение спазма периферических сосудов, в совокупности со сдвигом кривой диссоциации оксигемоглобина влево, приводит к тканевой гипоксии, нестабильности клеточных мембран, повышению травматизации форменных элементов крови [2]. Установлено, что даларгин способен нормализовать периферический сосудистый тонус в условиях стрессорной вазоконстрикции [1]. При этом ведущее значение в механизмах протекторного эффекта даларгина имеет увеличение уровня продукции NO, обусловленное изменением активности NO-синтаз. Можно предположить, что протекторный эффект даларгина на стрессобусловленные изменения гемодинамики имеет место при умеренной гипотермии, но не при глубокой. В определенной мере об этом свидетельствуют данные о влиянии даларгина на содержание одновалентных катионов в плазме крови и эритроцитах при гипотермии. Введение даларгина не оказало влияния на концентрацию одновалентных катионов в плазме и эритроцитах у контрольных животных и у животных с температурой тела 30 °С (таблица). При гипотермии 20 °С даларгин не предотвращает изменение соотношения Naex+/ Nain+ и Kex+/ Kin+. В крови даларгин быстро подвергается протеолизу [7], с чем, по-видимому, и связано отсутствие защитного эффекта пептида на распределение исследованных катионов вне и внутри эритроцитов после глубокой гипотермии.
Заключение
Острое кратковременное снижение температуры тела приводит к повышению активности Na,К-АТФазы эритроцитов, что является компенсаторной реакцией, направленной на поддержание ионного гомеостаза клетки, нарушенного под действием низкой температуры. После снижения температуры тела до 20 °С активность Na,К-АТФазы остается повышенной, но это не предотвращает нарушение ионного гомеостаза эритроцитов. Эти данные свидетельствуют о нарушении барьерных свойств мембран эритроцитов при глубокой гипотермии. В условиях гипотермии 30 °С введение даларгина полностью предотвращает повышение активности Na,К-АТФазы, вызываемое низкой температурой. Однако при глубокой гипотермии даларгин не предотвращает активацию Na, К-АТФазы, а также изменение ионного состава эритроцитов.



