Основным способом лечения больных с диспластическим коксартрозом (ДКА) в настоящее время является тотальное эндопротезирование тазобедренного сустава – ТЭПТС [5; 6]. Однако по мере увеличения количества больных с имплантированными эндопротезами неуклонно возрастает и число ревизионных вмешательств [2]. Проблема при подготовке больного с ДКА к операции заключается в отсутствии четкого алгоритма выбора дизайна бедренного компонента эндопротеза для его имплантации. Отсутствие полной информации о форме проксимального отдела костномозговой полости бедренной кости приводит к тому, что во время тотальной артропластики при обработке канала под бедренный компонент эндопротеза, как правило, удаляется избыточное количество костной ткани. Это приводит к асептической нестабильности бедренного компонента в среднем уже через 3-4 года после его первичной имплантации, появлению болей в тазобедренном суставе и снижению качества жизни пациентов [3; 4]. Поэтому возникает необходимость в более точном индивидуальном предоперационном планировании тотальной артропластики и выборе формы и размеров бедренного компонента эндопротеза [1; 7].
Цель работы: улучшить результаты первичной тотальной артропластики у больных с диспластическим коксартрозом путем индивидуального подхода в выборе типа и размеров бедренного компонента эндопротеза с учетом морфометрических характеристик костномозговой полости бедренной кости.
Материал и методы
Объектом исследования явились 114 пациентов, находившихся на лечении в ФГБУ «СарНИИТО» Минздрава России в период с 2007 по 2012 г. Им было выполнено 71 оперативное вмешательство с применением различных конструкций эндопротезов. Пациенты были распределены на группы: I – основную, состоящую из 64 человек с ДКА I–II степени (средний возраст 51,24 ± 2,18 года) и группу сравнения (II группа), состоящую из 50 человек (средний возраст 51,36 ± 2,26 года). Пациентам I группы во время операции индивидуально подбирали компоненты эндопротеза по разработанному алгоритму (свид-во о гос. регистрации программы для ЭВМ № 2016612412 РФ), позволяющему оперативно осуществить подбор типа и размера бедренного компонента эндопротеза при введении параметров: пол, возраст, ширина и форма костномозговой полости бедренной кости. Пациентам II группы подбор компонентов эндопротеза проводили по стандартному методу прямого планирования.
Пациентам были применены, кроме клинического, лучевого, денситометрического методов также электрофизиологический и биомеханический методы исследования. Исследования проводили до операции, через 3, 6 и 12 месяцев после нее, и далее – один раз в год.
Биомеханические исследования выполняли для уточнения особенностей изменений общих интегративных показателей функции нижних конечностей - статических, кинематических и динамических. Обследования выполнялись в лаборатории биомеханики СарНИИТО на аппаратно-программном комплексе «МБН – Биомеханика». Оно включало в себя определение ритмовых и динамических показателей в условиях привычного темпа ходьбы с определением коэффициента ритмичности (КР). При изучении статических показателей в условиях произвольного стояния определяли степень опоры (СО), среднее смещение центра тяжести во фронтальной плоскости (Х), максимальное смещение центра тяжести во фронтальной плоскости (δX), среднее смещение центра тяжести в сагиттальной плоскости (Y), максимальное смещение центра тяжести в сагиттальной плоскости (Δy), пути пробега кинезиограммы (L).
Электронейромиографическое (ЭНМГ) и электромиографическое (ЭМГ) исследования больным выполняли на приборе Keypoint фирмы «Алпайн Биомед АпС» (Дания). При выполнении ЭНМГ- и ЭМГ-исследований до операции определяли состояние нервной и мышечной систем, проводили оценку и анализ полученных данных, выбирали индивидуальную тактику ведения больного, что позволяло повысить положительные результаты тотальной артропластики у пациентов с диспластическим коксартрозом, добиться полноценного восстановления анатомической конфигурации и локомоторной функции нижних конечностей. При ЭНМГ-исследовании бедренного, большеберцового и малоберцового нервов с обеих сторон, F-волн L3-S1 уровней спинного мозга оценивали имеющееся или нет нарушение проводимости малоберцового и большеберцового нервов и корешков спинного мозга, состояние мионеврального аппарата нижних конечностей, зависимость выраженности отклонения нейрофизиологических от нормальных показателей. Исследования проводили в сравнении с показателями возрастной нормы и степенью отклонения от нее, устанавливая уровень поражения: нерв и/или корешок спинномозгового нерва. Объективно оценивали параметры мышечных ответов, стимулируя нерв в дистальной и проксимальной точках.
Полученные числовые данные подвергали статистической обработке с помощью программ STATISTICA-6,0 (Statsoft@ Inc., USA).
Результаты исследования и их обсуждение
Результаты биомеханического исследования пациентов с ДКА позволили выявить особенности функционального статуса. У пациентов обеих исследуемых групп отмечалась патология основной стойки (нарушение статического баланса) из-за неустойчивости и нестабильности, которая позволяла переместить общий центр массы (ОЦМ) в более физиологичное положение с малыми мышечными энергозатратами. У 25 пациентов I группы имелась приводящая контрактура в тазобедренном суставе. Пациенты передвигались, компенсируя функциональные ограничения в пораженном тазобедренном суставе наклоном таза в сторону переносимой нижней конечности и наклоном корпуса тела в сторону (здоровой) опорной конечности. Результаты исследования отражены в таблицах 1 и 2.
Таблица 1
Показатели стабилометрии пациентов с ДКА до операции ТЭПТС
|
Группы |
Показали стабилометрии |
|||
|
L, мм |
S, мм² |
Положение по оси Х, мм |
Положение по оси Y, мм |
|
|
Норма |
436,3±4,3 |
98,7±9,7 |
1,2±0,1 |
-29,3±2,7 |
|
I группа (n=40) |
506,7±3,4* |
578,2±33,1* |
23,4±2,3** |
-8,65±4,6** |
|
II группа (n=24) |
504,8±16,4** |
582,5±33,1** |
24,2±2,5** |
-9,7±4,3** |
Примечания: все показатели регистрировались с пораженной стороны, * – при значении р≤0,05; ** – при значении р≤0,001 (при сравнении с биомеханической нормой), где р – критерий Манна-Уитни для независимых выборок.
Таблица 2
Показатели электроподографии пациентов с ДКА до операции ТЭПТС
|
Группы |
Показатели электроподографии |
||||||||
|
ЦШ, с. |
ПО, % |
ПП, % |
ДО, % |
ПДО, % |
ВДО, % |
ОО, % |
НВД, % |
Коэффициент ритмичности |
|
|
Норма |
1,3±0,2 |
63,7± 5,9 |
37,8± 3,8 |
25,7± 1,2 |
12,8± 0,7 |
12,7± 0,7 |
37,3± 3,2 |
50± 0,4 |
1±0,01 |
|
I группа (n=40) |
1,7±0,2 ** |
61,1± 0,4 * |
36,2± 0,4 * |
31,6± 0,4 ** |
15,2± 0,4 * |
11,4± 0,4 ** |
32,2± 0,2 ** |
48,5± 0,2 ** |
0,78±0,1 ** |
|
II группа (n=24) |
1,7±0,2 ** |
61,4± 0,4 * |
36,4± 0,6 ** |
31,8± 0,4 * |
15,8± 0,5 * |
11,9± 0,3 ** |
32,7± 0,1 ** |
48,5± 0,1 ** |
0,78±0,1 ** |
Примечания: ЦШ – цикл шага, ПО – период опоры, ПП – период переноса, ДО –двойная опора, ПДО – период двойной опоры, ВДО – время двойной опоры, ОО – фаза одиночной опоры, НВД – начало второй двойной опоры.
Результаты стабилометрического исследования больных обеих групп показали, что они имеют асимметрию и нестабильность основной стойки в вертикальном положении. Во фронтальной плоскости было отмечено смещение общего центра массы тела в сторону контрлатеральной конечности. Эти данные свидетельствовали о стандартной компенсации приспособительных механизмов стойки при ДКА. В сагиттальной плоскости у больных обеих групп были признаки нестабильности: колебания тела по оси Y, значительные изменения пути (L) и площади (S) статокинезиограммы, увеличение колебаний центра давления за пределы нормальной зоны баланса.
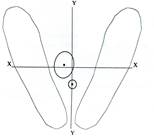

Стабилометрическое исследование пациента К., 46 лет: а – смещение ОЦМ;
б – колебания центра давления за нормативной зоной баланса
При стабилометрическом исследовании отмечено повышение амплитуды колебаний общего центра массы во всех плоскостях исследования, что указывает на недостаточную опороспособность больной конечности.
Временные параметры шага у пациентов обеих групп характеризовались увеличением времени цикла шага (ЦШ) и увеличением времени периода опоры (ПО) на контрлатеральной стороне. Время ПО было значительно сокращено на стороне поражения, что также явилось следствием перераспределения нагрузки за счет функционального напряжения не больной конечности. Из-за этого у пациентов обеих групп время начала второй двойной опоры (НВДО) и цикл шага (ЦШ) были уменьшены на больной стороне до 42,8%. Показатели асимметрии периодов ДО были также умеренно нарушены у пациентов I и II групп из-за изменений в анатомии тазобедренного сустава при ДКА и болевого синдрома.
После тотальной артропластики повторное биомеханическое обследование, проведенное через 12 месяцев, показало положительную динамику основных показателей, свидетельствующих об уменьшении степени асимметрии нагрузки нижних конечностей, повышении коэффициента ритмичности ходьбы (табл. 3).
Таблица 3
Сравнительные биомеханические параметры нижних конечностей до и через 12 месяцев
после тотальной артропластики тазобедренного сустава при ДКА
|
Мес. |
Параметр (%) |
Min |
Max |
M |
m |
σ |
ДИ -95% |
ДИ +95% |
Ме |
25% |
75% |
Cv% |
|
0 |
Степень опорности БК |
33,70 |
48,80 |
44,02 |
1,05 |
4,08 |
41,76 |
46,28 |
45,30 |
41,15 |
47,19 |
9,26 |
|
Степень опорности ЗК |
51,20 |
66,30 |
55,64 |
1,04 |
4,04 |
53,40 |
57,88 |
54,70 |
52,81 |
57,70 |
7,26 |
|
|
Степень асимметрии нагрузки |
2,40 |
32,60 |
12,79 |
2,21 |
4,86 |
8,07 |
17,51 |
9,89 |
7,10 |
16,62 |
38,00 |
|
|
Коэффициент ритмичности |
0,31 |
0,97 |
0,64 |
0,05 |
0,17 |
0,69 |
0,91 |
0,83 |
0,77 |
0,90 |
21,26 |
|
|
12 |
Степень опорности БК |
31,70 |
54,92 |
45,34 |
2,41 |
6,81 |
39,64 |
51,03 |
45,09 |
43,36 |
49,59 |
15,03 |
|
Степень опорности ЗК |
45,08 |
68,30 |
54,67 |
2,41 |
6,81 |
48,97 |
60,36 |
54,91 |
50,42 |
56,65 |
12,46 |
|
|
Степень асимметрии нагрузки |
0,54 |
36,00 |
11,59 |
3,40 |
4,21 |
3,74 |
19,44 |
9,84 |
9,52 |
11,24 |
36,32 |
|
|
Коэффициент ритмичности |
0,62 |
0,99 |
0,88 |
0,05 |
0,13 |
0,77 |
0,99 |
0,93 |
0,81 |
0,97 |
14,98 |
Примечание: БК – больная конечность; ЗК – здоровая конечность.
Для определения степени гипотрофии мышц, окружающих пораженный тазобедренный сустав, 60 больным до и после операции проведено ЭМГ-исследование, которое позволило выявить и детально охарактеризовать состояние электрогенеза и степень вовлечения в патологический процесс мышц ягодичной группы. На более пораженной стороне амплитуда биопотенциалов не превышала 334,2±19,4 мкВ для большой ягодичной мышцы и 286,8±29,9 мкВ для средней; частота составляла 151,5±16,0 и 180,0±23,2 Гц соответственно. На менее пораженной стороне амплитуда составляла 308,3±51,0 мкВ для большой ягодичной мышцы и 297,4±23,4 мкВ для средней; частота не менее 198,2±22,7 и 289,4±24,6 Гц соответственно. При сравнении показателей электрогенеза мышц было отмечено, что практически во всех случаях (84%) более выраженные сдвиги ЭМГ-паттерна произвольной активности регистрировались в средней ягодичной мышце. Анализ результатов ЭМГ больных с ДКА показал, что у 48 больных из 60 электрофизиологические данные биоэлектрической активности мышц ягодичной группы были низкими, у 12 пациентов дефицит мышечной активности носил функциональный характер. В остальных случаях, наряду со снижением функциональной активности, выявлены признаки миодистрофии.
С целью изучения степени нарушения активационных свойств мышц ягодичной группы всем больным было проведено двустороннее обследование: ЭНМГ-исследование с определением латентных периодов поздних ответов (ЛП F-волн-антидромных разрядов) мотонейронов спинного мозга, регистрируемых на стимуляцию малоберцового и большеберцового нервов. Это позволило определить степень вовлечения в патологический процесс нервных стволов и асимметрии проводимости на пораженной и контрлатеральной сторонах. При анализе полученных результатов статистически значимой зависимости степени снижения ЭНМГ-показателей от возраста больных не было выявлено (табл. 4).
Таблица 4
Результаты ЭНМГ-исследования периферических нервов нижних конечностей больных с ДКА
|
Нерв |
Сторона |
ЛП F-волны (мс) |
СПF (м/с) |
|
Малоберцовый нерв |
Более пораженная |
43,5±3,5 |
48,3±8,9* |
|
|
Менее пораженная |
40,2±5,4 |
50,3±3,4 |
|
Большеберцовый нерв |
Более пораженная |
46,2±2,3* |
44,8±4,8* |
|
|
Менее пораженная |
44,1±3,1 |
40,1±8,6* |
Примечание: * – р<0,05.
У 38% больных показатели ЛПF-волн на стороне большего поражения сустава были сниженными до 46,2±2,3 мс, на противоположной конечности – до 44,1±3,1 мс и достоверно отличались от данных остальных пациентов (38,6±2,4 мс). В 9 случаях отмечена еще и асимметрия показателей ЛП, превышающая допустимые значения (в норме не более 1 мс). В 30% случаях скорость проведения импульса на уровне корешка была значительно ниже данных нормы (в норме не менее 50-52 м/с). У 32% пациентов показатели ЛП F-волн с 2 сторон были без существенной разницы и соответствовали нижней границе нормы.
При сопоставлении амплитуд М-ответов при стимуляции нерва на разных уровнях в 87,3% случаев выявлено снижение амплитуды проксимального М-ответа относительно значений дистального более чем на 15%. В среднем величина блока проводимости моторных аксонов нерва достигала 38,0±6,3% (p<0,05). Также было выявлено изменение показателей поздних ответов, регистрируемых на стимуляцию малоберцового нерва. У 10 больных асимметрия ЛП превышала 1,5 мс (p<0,05). При сопоставлении амплитуд М-ответов блок проводимости на уровне проксимального отрезка нерва составлял 29,6±4,8% (p<0,05) и также был выше допустимых значений.
Через 6-12 месяцев после тотального эндопротезирования положительная динамика ЭНМГ и ЭМГ-данных была отмечена у 76% пациентов I группы и 35% больных II группы в виде улучшения средних значений невральной проводимости как на уровне терминалей, так и на уровне L5,-S1 корешков спинномозговых нервов. Так, СПИ на уровне корешков спинного мозга повысилась с 44,8 до 52,3±2,7 м/с (р<0,05).
Заключение
Отдаленные результаты биомеханических исследований статической и кинематической функций нижних конечностей, проведенных через один год после тотальной артропластики, показали более значимое уменьшение степени асимметрии нагрузки нижних конечностей и повышении коэффициента ритмичности ходьбы у тех пациентов, которым индивидуально подбирали компоненты эндопротеза по разработанному алгоритму.
Об эффективности выбора и установки бедренного компонента эндопротеза тазобедренного сустава с применением разработанного алгоритма свидетельствовали и показатели электрогенеза мышц ягодичной группы. У пациентов I группы прирост амплитуды ЭМГ-кривых составил 35-48% к исходным данным (404,3±12,3 мкВ), уровень электрогенеза большой ягодичной мышцы увеличился в среднем в 3-4 раза. У 24% больных ЭМГ-данные приближались к возрастной норме. У пациентов II группы значимого повышения показателей суммарной ЭМГ по сравнению с первичными данными выявлено не было. Однако в большинстве случаев отмечалось увеличение амплитуды ЭМГ-кривых большой ягодичной мышцы, которое не превышало 50-80 мкВ. Улучшение показателей ЭМГ-паттерна свидетельствовало о создании условий для повышения миоадаптационных свойств мышц ягодичной группы у больных, которым предоперационное планирование тотальной артропластики тазобедренного сустава проводили с учетом алгоритма выбора бедренного компонента эндопротеза.



