Антрациклиновые антибиотики даунорубицин и доксорубицин были введены в клиническую практику более 40 лет назад для лечения широкого спектра онкологических заболеваний, таких как острая миелоидная лейкемия и, в случае с доксорубицином, многие сóлидные опухоли. Сами по себе и в комбинации с другими препаратами антрациклины являются компонентами основного, вспомогательного и паллиативного лечения [1].
Несмотря на интенсивное клиническое применение антрациклинов, их механизмы действия являются объектом для дискуссий вследствие использования различных концентраций и условий эксперимента. Однако некоторые данные не подлежат сомнению. Во-первых, в терапевтических дозах и при внутривенном способе введения механизм действия антрациклиновых антибиотиков обусловлен взаимодействием с топоизомеразой II путем стабилизации тройного комплекса ДНК-топоизомераза II-антрациклин [11]. Во-вторых, ограничивающим фактором приема антрациклиновых антибиотиков является кумулятивная кардиотоксичность и развитие резистентности опухолей [8].
Кардиотоксичность, которую вызывают антрациклиновые антибиотики, ограничивает их клиническое применение. Пациенты, принимающие антрациклины, страдают от аритмии, гипотензии, угнетения сократимости сердца, возможно возникновение миокардитов. В кардиомиоцитах антрациклины являются причиной сосудистой дегенерации, митохондриальных включений, миофибриллярных мерцаний и трепетаний, увеличения количества лизосом и некроза. Максимальная рекомендованная доза для даунорубицина составляет 500 мг, а для доксорубицина – 450-600 мг на весь курс лечения. Это доза представляет собой сумму доз, которые принял пациент, даже если между циклами приема были промежутки в месяцы и годы. При превышении рекомендованных доз развивается дилятационная кардиомиопатия и сердечная недостаточность [7]. Кроме кардиотоксичности частым осложнением после терапии антрациклиновыми антибиотиками является токсическое действие на другие паренхиматозные органы, например нефротоксичность [2].
Развитие резистентности опухолевых клеток снижает эффективность противоопухолевой терапии и требует увеличения доз препарата, что в случае антрациклиновых антибиотиков недопустимо. Развитие резистентности опухолей связывают сo взаимодействием между антрациклинами и транспортными белками Р-гликопротеином и белком множественной лекарственной резистентности MRP через N3’ атом даунозамина. Сверхэкспрессия транспортных систем в опухолевых тканях играет ключевую роль в удалении антрациклинов из клеток и уменьшению взаимодействия лекарство-мишень [3].
Клиническая востребованность даунорубицина и доксорубицина стимулировала интенсивный синтез аналогов и структурно близких соединений [4, 5, 10]. Несмотря на доклинические исследования огромного количества соединений данного класса, только малая часть антрациклинов и других интеркалирующих агентов доступна для клинического использования. Даунорубицин остается одним из наиболее эффективных агентов для лечения острых лимфоидных и миелоидных лейкемий, но его активность в отношении сóлидных опухолей мала. Доксорубицин является наиболее активным препаратом для лечения сóлидных опухолей, особенно при раке молочной железы, мелкоклеточном раке легкого и раке яичников [6].
В связи с тем, что скрининговые исследования на противоопухолевые свойства новых соединений в настоящее время проводятся в основном в тестах in vitro, сравнение цитотоксичности эталонных препаратов сравнения на различных опухолевых линиях клеток является интересным. Кроме того, дальнейшее сравнение с данными по цитотоксичности, полученными на культурах нормальных клеток, представляется перспективным для прогнозирования токсикологического профиля веществ в опытах in vivo. Целью данной работы является сравнение цитотоксичности антрациклиновых антибиотиков даунорубицина и доксорубицина в отношении опухолевых и нормальных линий клеток.
Материалы и методы
В работе использовано оборудование Центра коллективного пользования научным оборудованием для создания генно-модифицированных линий животных и изучения эффективности соединений на оригинальных клеточных и трансгенных моделях нейродегенеративных заболеваний человека (соглашение 14.621.21.0008, идентификатор RFMEFI62114X0008).
Исследуемые соединения
Исследуемые соединения даунорубицин (DNR) и доксорубицин (DOX) были синтезированы на ОАО «Омутнинская научная опытно-производственная база» (п. Восточный, Кировская область). Формулы представлены на рисунке.
Скелет антрациклина состоит из тетрациклической системы с сопряженным хинон-гидрохиноновыми кольцами, аминосахара даунозамина, связанного гликозидной связью с С7 и короткой боковой цепи с карбонильной группой при С13. Относительно малые изменения в этом скелете приводят к большим изменениям в спектре противоопухолевой активности. Антрациклины с первичным спиртом на конце боковой цепи (DOX и эпирубицин) показывают активность как к сóлидным, так и гематологическим опухолям. Антрациклины с метильной группой (DNR и идарубицин) в основном используются для лечения острой миелобластной лейкемии и связанной со СПИДом саркомой Капоши.
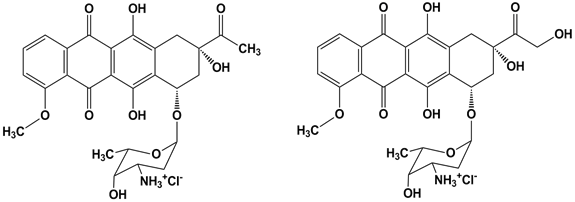
Даунорубицин Доксорубицин
Культуры клеток
В эксперименте были использованы культуры опухолевых клеток человека А549 (карцинома легкого, ATCC® CCL-185™), HCT116 (карцинома кишечника, ATCC® CCL-247™), MCF7 (аденокарцинома молочной железы, ATCC® HTB-22™), RD (рабдомиосаркома, ATCC® CCL-136™), а также культуры нормальных клеток эмбрионального почечного эпителия человека HEK293 (ATCC® CRL-1573™) и собаки MDCK-M (ATCC® CCL-34™).
Культуры клеток А549, HCT116, RD и НЕК293 выращивались в среде DMEM, культура клеток MCF7 выращивалась в среде EMEM, культура клеток MDCK-M – в среде DMEM/F12 (все среды произведены в ООО НПП «ПанЭко»). В культуральные среды были добавлены 10 % эмбриональной телячьей сыворотки (HyClone®, Thermo Scientific), 2мM L-глутамина (ООО НПП «ПанЭко») и 1% гентамицина (ОАО Биохимик) в качестве антибиотика. Культивирование происходило при 37oC и 5 % CO2 во влажной атмосфере.
Определение цитотоксичности МТТ-тестом
Цитотоксичность даунорубицина и доксорубицина была определена с помощью МТТ-теста [9]. Клетки были посеяны в концентрации 1·104 клеток/200 мкл в 96-луночный планшет и культивировались при 37 oC во влажной атмосфере с 5 % CO2. После 24 часов инкубации к культурам клеток были добавлены различные концентрации тестируемых соединений (от 100 до 1,56 мкМ/л), и далее клетки культивировались в тех же условиях 72 часа. Каждая концентрация веществ была выполнена в трех повторностях. Все вещества были растворены в ДМСО (Panreac Química S.L.U), конечная концентрация ДМСО в лунке не превышала 0,1 % и не была токсична для клеток. Контрольными лунками выступали лунки, в которые добавляли растворитель в конечной концентрации 0,1 %. После инкубации в каждую лунку было добавлено 20 мкл MTT (3-[4,5-диметилтиазол-2-ил]-2,5-дидифенил тетразолия бромид, 5 мг/мл, Sigma-Aldrich), и планшеты инкубировались еще 2 часа. Далее из планшетов была удалена среда и в каждую лунку добавлено 100 мкл ДМСО для растворения образовавшихся кристаллов формазана. С помощью планшетного анализатора (Victor3, PerkinElmer) определяли оптическую плотность при 530 нм за вычетом измеренного фонового поглощения при 620 нм. Значение концентрации, вызывающее 50 % ингибирование роста популяции клеток (IC50), было определено на основе дозозависимых кривых с помощью программного обеспечения OriginPro 9.0.
Результаты и обсуждение
Результаты исследования цитотоксического эффекта антрациклиновых антибиотиков приведены в таблице. Оба препарата проявляют сильно выраженный противоопухолевый эффект. Очевидно, что в отношении ряда культур – карциномы легкого А549 и кишечника НСТ116 – даунорубицин и доксорубицин действуют аналогично. Линии клеток рабдомиосаркомы RD, аденокарциномы молочной железы MCF7 и нормального эмбрионального эпителия почки собаки MDCK-M менее чувствительны к действию даунорубицина. Дозы, при которых проявляется эффект даунорубицина, на этих линиях клеток в 2–5 раз выше, чем дозы доксорубицина.
Цитотоксичность даунорубицина и доксорубицина в МТТ-тесте
|
Соеди-нение |
IC50, мкМ |
|||||
|
A549 |
HCT116 |
RD |
MCF7 |
HEK293 |
MDCK-M |
|
|
DNR |
0,51±0,01 |
0,21±0,00 |
2,45±0,07 |
1,44±0,31 |
11,17±0,19 |
0,32±0,00 |
|
DOX |
0,53±0,02 |
0,19±0,01 |
0,53±0,03 |
0,56±0,03 |
151,68±13,82 |
0,19±0,00 |
Несмотря на то, что применение доксорубицина не показано для лечения рака прямой кишки и тонкого кишечника, цитотоксичность его по отношению к клеточной линии НСТ116 в нашем эксперименте получилась выше, чем по отношению к клеточным линиям, более близким по клиническим показаниям для данного препарата (А549 и MCF7). Даунорубицин, который в клинической практике не применяется для лечения рака легкого и кишечника, в нашем эксперименте проявил высокую цитотоксичность по отношению к клеткам А549 и НСТ116.
Интересна разница в чувствительности к исследуемым антрациклинам нормальных клеток, принадлежащих к одной ткани, но разному виду млекопитающих. В качестве представителей нормальных клеток были выбраны клетки нормального эмбрионального эпителия почки собаки и человека, так как одним из побочных эффектов антрациклинов является нефротоксичность.
Линия клеток нормального эмбрионального эпителия почки собаки MDCK-M обнаружила повышенную чувствительность к действию и даунорубицина, и доксорубицина, причем токсичность этих антрациклинов в отношении данной линии выше, чем токсичность к опухолевым линиям клеток. В противоположность этому, линия клеток нормального эмбрионального эпителия почки человека НЕК293 менее чувствительна к действию антрациклиновых антибиотиков. Причем, если IC50 даунорубицина в отношении этой линии только в 5–50 раз выше, чем в отношении опухолевых культур клеток, то IC50 доксорубицина в 270–800 раз выше, чем в отношении опухолевых культур. Токсичность доксорубицина в отношении линии НЕК293 в 13,5 раз меньше токсичности даунорубицина.
Разница в чувствительности клеток нормального почечного эпителия двух разных видов не может быть объяснена с точки зрения разной скорости пролиферации двух культур, так как обе культуры являются быстро пролиферирующими.
Таким образом, исследование показало, что токсикологический профиль антрациклиновых антибиотиков доксорубицина и даунорубицина in vitro в целом повторяет клинический профиль данных препаратов. Дальнейший интерес представляет исследование цитотоксичности других представителей антрациклиновых антибиотиков – идарубицина и эпирубицина, а также сравнительное исследование цитотоксичности пар клеточных линий одного генеза, но двух разных типов – опухолевого и нормального. Разница в токсичности антрациклинов по отношению к нормальным и опухолевым клеткам очевидна, однако требует дополнительных экспериментов с клетками разных типов тканей и видов млекопитающих.
Работа выполнена при поддержке Гранта РФФИ №15-04-0394015.



