Создание и производство отечественных пищевых микроингредиентов является важной задачей развития пищевой и перерабатывающей промышленности. Актуальность данного направления возрастает в настоящее время в условиях экономического кризиса и принятых санкций в отношении России. Новые экономические условия становятся испытанием и возможностью, как для поставщиков пищевых ингредиентов, так и для производителей пищевых продуктов. Рыночная ситуация требует быстрого реагирования, поиска новых возможностей сохранения и развития бизнеса, позволяет обновить взгляд на конкурентоспособность производимого продукта, на повышение качества, на соответствие стандартам, а также на потребности и желания потребителей.
В соответствии с Постановлением Правительства РФ №77 от 07.08.2014 г. пищевые микроингредиенты включены в перечень товаров, запрещенных к ввозу в РФ. Россия относится к странам, имеющим высокую импортозависимость по данной группе товаров, внутреннее производство не превышает 10% в натуральном выражении [5]. Пищевые микроингредиенты используются при производстве пищевого продукта на протяжении всего технологического цикла, поэтому даже в случае производства достаточного количества сырья в стране, без них невозможно решить вопросы продовольственной безопасности и производить качественные продукты питания.
Необходимость наличия в стране собственного развитого производства пищевых микроингредиентов была очевидна и ранее, а события последних месяцев способствовали принятию решения о подготовке Программы развития производства микроингредиентов на период до 2025 года. Разработка проекта Программы осуществляется совместными усилиями двух организаций – Союза производителей пищевых ингредиентов и ВНИИ пищевых добавок. В основу проекта Программы положена Концепция развития отечественного производства пищевых микроингредиентов, разработанная ВНИИПД на период до 2025 года [4].
Целью исследования является поиск антимикробной активности среди продуктов органического синтеза – енамино-, енгидразино- и енаминопроизводных амидов ацилпировиноградной кислоты с целью создания перспективных пищевых микроингредиентов, обладающих консервирующим действием.
Задачи исследования: изучить бактериостатическую активность енамино-, енгидразино- и енаминопроизводных амидов ацилпировиноградной кислоты.
Материал и методы исследований
Енаминопроизводные и енгидразинопроизводные ацилпировиноградных кислот получены на основе взаимодействия ацилпировиноградных кислот с первичными аминами и гидразонами ароматических кетонов [2]. Енаминопроизводные амидов ацилпировиноградных кислот получены дециклизацией 4-ариламино-2-трет-бутил-2,5-дигидро-5-оксофуран-2-илацетатов под действием первичных аминов[1].
Бактериостатическую активность определяли методом двукратных серийных разведений в жидкой питательной среде[6]. При этом использовали смыв суточной культуры выращенной на мясопептонном агаре, стерильным физиологическим раствором хлорида натрия. Готовили исходное разведение с концентрацией 500 млн. микробных тел в одном мл смыва по бактериальному стандарту. Полученную смесь разводили стерильным МПБ в 100 раз. Это разведение бактериальной культуры с концентрацией 5 млн. микробных тел в 1 мл является рабочим раствором. Последний в количестве 0,1 мл вносили в 2 мл МПБ. Исследуемые вещества растворяли в ДМФА в соотношении 1:100 и разводили мясопептонным бульоном. Микробная нагрузка составляла 250000 микробных тел на 1 мл питательной среды. Результаты опытов фиксировали после 18-20 часов выдержки контрольных и опытных культур в термостате при температуре 37ºС. Регистрировали наличие роста бактерий или его отсутствие за счет бактериостатического действия соединения.
Бактериостатическую активность соединений оценивали по величине минимальной ингибирующей концентрации в мкг/мл, которая задерживала рост бактериальных культур. Для всех исследуемых соединений были определены МПК в отношении фармакопейных штаммов: Гр + S. аureus АТСС 6538 – Р, Гр – E. Coli ATCC 25922. Статистическая обработка результатов исследования проведена с вычислением средних арифметических (М), их среднестатистических ошибок (m) и критерия достоверности (р). Различия считали достоверными при р<0,05. В качестве эталона сравнения использовали диоксидин.
Результаты исследований и обсуждение
Результаты исследования бактериостатической активности енамино- и енгидразинопроизводных ацилпировиноградных кислот приведены в таблице 1.
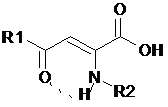
Таблица 1
Бактериостатическая активность енамино- и енгидразинопроизводных
ацилпировиноградных кислот
|
№ |
R1 |
R2 |
МПК, мкг/мл |
|
S. aureus |
E. coli |
|||
|
1 |
|
|
1000 |
1000 |
|
2 |
|
|
3,9 |
3,9 |
|
3 |
|
|
31 |
15,6 |
|
4 |
4-СН3С6Н4 |
|
15,6 |
15,6 |
|
5 |
|
|
15,6 |
15,6 |
|
6 |
|
|
31 |
31 |
|
7 |
|
|
31 |
31 |
|
8 |
|
|
250 |
250 |
|
9 |
|
|
62 |
62 |
|
10 |
|
|
15,6 |
125 |
|
Диоксидин |
|
62-1000 |
3,9-62 |
|
Установлено, что на проявление ПМА в ряду енаминопроизводных АПК влияет заместитель в енаминогруппе. Присутствие тимольного радикала приводит к увеличению активности по отношению к тест-штаммам от 32 до 128 раз (соединения 2-6). Среди енгидразинопроизводных арилпировиноградных кислот наиболее активны соединения 9 и 10, содержащие в енгидразинной группе о-гидроксифенилкарбонильный фрагмент[3].
Результаты исследования бактериостатической активности замещенных амидов 2-(2´(4)-бром (хлор) фениламино)-5.5-диметил-4-оксо-2-гексеновых кислот приведены в таблице 2.
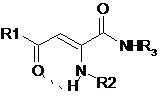
Таблица 2
Бактериостатическая активность енаминопроизводных амидов
ацилпировиноградных кислот
|
№
|
R1 |
R2 |
R3 |
МПК, мкг/мл |
|
|
S. aur. |
E. coli |
||||
|
1 |
|
2-BrС6Н4 |
2-JС6Н4 |
1000 |
1000 |
|
2 |
|
4-BrС6Н4 |
4-О2NС6Н4 |
1000 |
1000 |
|
3 |
|
4-BrС6Н4 |
|
500 |
500 |
|
4 |
|
|
4-BrС6Н4 |
1000 |
1000 |
|
5 |
|
|
4-С2Н5ОСОС6Н4 |
1000 |
1000 |
|
6 |
|
|
2-СН3-5-О2NС6Н3 |
15,6 |
15,6 |
|
7 |
|
|
|
125 |
250 |
|
8 |
|
|
|
500 |
500 |
|
9 |
4-СН3С6Н4 |
|
2,6-(CH3)2C6H3 |
15,6 |
31 |
|
10 |
|
|
2,6-(CH3)2C6H3 |
31 |
62 |
|
11 |
|
|
2,6-(CH3)2C6H3 |
7,8 |
15,6 |
|
12 |
|
|
2,4,6-(CH3)3C6H2 |
3,9-7,8 |
3,9-1000 |
|
13 |
4-СН3С6Н4 |
|
|
7,8 |
15,6 |
|
14 |
|
|
|
3,9 |
7,8 |
|
Диоксидин |
|
62-1000 |
3,9-62 |
||
Установлено, что на степень выраженности бактериостатического действия енаминопроизводных амидов ацилпировиноградных кислот оказывает влияние природа галогена в фениламиногруппе во втором положении углеродной цепи. Соединения с 2,4-ди-хлорфенильным радикалом (6,7) в отличие от 2- и 4(2,4)-бром(дибром)фениламино-производных проявляют более высокую бактериостатическую активность в отношении S. aureus и E. coli.
Высокая бактериостатическая активность соединений 9-14 обусловлена присутствием N,N-диэтиламиноэтильного заместителя в енаминогруппе и фрагментов тимола, 2,6-ксилидина, мезитилена в амидном звене молекулы ацилпировиноградной кислоты.
Заключение
Проведенные исследования позволили установить, что енамино- и енгидразинопроизводные ацилпировиноградных кислот и енаминопроизводных амидов ацилпировиноградных кислот являются перспективными для дальнейшего изучения и создания на их основе пищевых микроингредиентов, обладающих консервирующим действием.
Рецензенты:Семериков В.В., д.м.н., доцент, главный эпидемиолог Министерства здравоохранения Пермского края, г. Пермь;
Вдовина Г.П., д.фарм.н., профессор, заведующая кафедрой фармакологии Пермского государственного медицинского университета им. академика Е.Г. Вагнера, г. Пермь.



