В настоящее время преэклампсия и эклампсия является так называемой управляемой причиной материнской смертности, предотвратимость смертельных исходов составляет от 60 до 85 %. Но, несмотря на многочисленные методы исследования причин, диагностики и лечения, частота данной патологии не имеет тенденции к снижению [9]. Течение тяжелой преэклампсии может быть многоликим, и не случайно ее назвали «greafimostor» – «великим обманщиком» [7].
Главным звеном патогенеза преэклампсии, определяющим её клинические проявления, является эндотелиальная дисфункция. В результате развивается гипоксия в тканях маточно-плацентарного комплекса, доказано локальное повреждение эндотелия, что в последующем приобретает генерализованный характер и, как следствие, нарушается регуляция сосудистого тонуса, сосудистой проницаемости, что лежит в основе клинических проявлений преэклампсии – гипертензии, протеинурии, отеков, маточно-плацентарной недостаточности, изменений со стороны свертывающей системы крови. В итоге нарушается микроциркуляция в жизненно важных органах с развитием полиорганной недостаточности [1, 2, 3, 4, 5, 9, 11, 12].
Преэклампсия характеризуется вариабельностью форм клинических проявлений. Даже известная классическая триада симптомов не является значимым прогностическим критерием [6]. Остается актуальным поиск неинвазивных методов диагностики, обладающих достаточной воспроизводимостью для их выполнения в условиях скрининговых исследований и позволяющих установить критерии тяжести преэклампсии [8, 10].
Цель исследования: Оценить динамику клинико-лабораторных показателей у родильниц с преэклампсией.
Материал и методы исследования. Под наблюдением находились 112 родильниц. Пациентки были разделены на четыре группы: основная группа А – выжившие пациентки с преэклампсией и развитием полиорганной недостаточности (ПОН) (n = 31), группа сравнения В1 – умершие пациентки с преэклампсией с развитием ПОН (материнская смертность) (n = 11), 2 группа сравнения В2 – пациентки с преэклампсией без развития ПОН (n = 20), группа С – контрольная (здоровые родильницы, n = 50). К основным принципам формирования групп обследованных женщин относились:
- однородность возрастного состава (детородный возраст, пределы колебаний: 18–43 лет);
- сопоставимость сроков беременности и паритета;
- сопоставимость характера экстрагенитальной патологии (исключены варианты декомпенсации экстрагенитальной патологии и её редкие формы);
- однородность сроков и способа родоразрешения; однородность проводимой терапии в различные сроки беременности;
- сопоставимость диагноза акушерской патологии с МКБ X пересмотра.
При анализе историй болезни пациенток выделены анамнестические, клинические, лабораторные и инструментальные факторы. Среди факторов при последующем анализе были идентифицированы те, которые имели отношение к риску развития тяжелой преэклампсии.
Наблюдение за беременными осуществлялось, начиная с момента их поступления в стационар для подготовки к родоразрешению, в родах, послеродовом периоде.
Биометрический анализ осуществлялся с использованием пакета STATISTICA - 6, возможностей программы MicrosoftExcel. Во всех процедурах статистического анализа критический уровень значимости р принимался равным 0,05. При этом значения p могли ранжироваться по 3 уровням достигнутых статистически значимых различий: p < 0,05; p < 0,01; p< ,001. Сравнение относительных величин проводилось с помощью точного критерия Фишера двустороннего или критерия c2 с поправкой Йетса.
Результаты исследования и их обсуждение:
По длительности преэклампсии в группе А – до 7 дней – 5,3 % (χ2=8,7), от 7–14 дней 13,3 % (χ2=17,1), более 14 дней 8,9 % (χ2=13,7), в группе В1 – до 7 дней – 1,7 % (χ2=7,9), от 7–14 дней 4,4 % (χ2=16,9), более 14 дней 3,5 % (χ2=14,2), в группе В2 – до 7 дней – 7,1 % (χ2=15,9), от 7–14 дней 2,6 % (χ2=6,8), более 14 дней 8 % (χ2=17,5). Все пациентки основной группы были досрочно разрешены. У 2 - 6,4 % (χ2=3,1) пациенток основной группы роды были через естественные родовые пути. Путем операции кесарево сечение 29 пациенток (93,5 %, χ2=32,8), из них у 18(58 %, χ2=22,4) интраоперационно было расширение объёма до экстирпации матки с трубами. Показанием для расширения объема операции послужило маточное кровотечение, не купирующееся после выполнения всех этапов его остановки.
Мы полагаем, что возможным фактором риска развития полиорганной недостаточности являлся объёма кровопотери у обследованных пациенток. Оказалось, что объём кровопотери при родоразрешении составил:
- в группе А – до 1000 мл у 18 (58 %, χ2= 22,4), от 1000 до 1500 мл – у 4 пациенток (12,9 %, χ2= 6), от 1500 до 2000 мл – у 3 (9,6 %, χ2= 4,6) рожениц, свыше 2000 мл у 6 (19,3 %, χ2=8,7) женщин;
- в группе В1 – до 1000 мл кровопотеря у 6 пациенток (54,5 %, χ2=19,4), от 1000 до 1500 мл у 1 (9 %, χ2=4,2) роженицы, более 2000 мл у 4 (36,3 %, χ2=14,2) пациенток;
в группе В2 – в 100 % случаев кровопотеря составила до 1000 мл.
Выявлена прямая положительная корреляционная связь объема кровопотери и развитием полиорганной недостаточности средней силы (r= 0,52), рис. 1.
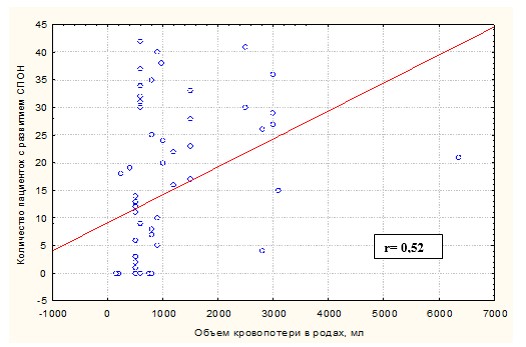
Рис.1. Корреляционная связь между уровнем кровопотери в родах и развитием ПОН у родильниц
Нами был проведен анализ клинико-лабораторных показателей в соответствии с сутками послеродового периода и рассмотрена взаимосвязь особенностей течения послеродового периода с развитием системного воспалительного ответа организма родильницы.
В группе А в первые сутки лейкоцитоз составил 14,7х109/л, на фоне проводимой антибактериальной и инфузионной терапии, отмечалось постепенное снижение лейкоцитоза. На 14 сутки он становится 8,9х109/л. В то время как в группе В1 даже к 14 суткам лейкоцитоз сохраняется до 11,3х109/л. Нарастание лейкоцитоза отмечалось у погибших пациенток на фоне прогрессирования ПОН, см. табл.1.
Таблица 1
Динамика показателей лейкоцитоза в послеродовом периоде у родильниц с тяжелой преэклампсией
|
Пациентки сутки после родов |
Группа А n=31 |
Группа В1 n= 11 |
Группа В2 n=20 |
Группа контроля |
|
1 сутки |
14,73±1,3 * |
20,17±1,8 |
7,58±1,2* |
4,3 |
|
3 сутки |
12,22±1,3 * |
17,83±1,2 * |
8,73±1,3* |
5,2 |
|
7 сутки |
10,54±1,2 * |
16,66±1,4* |
7,87±1,3* |
5,1 |
|
14 сутки |
8,96±1,5 |
11,33±1,6 |
8,25±1,6 |
- |
Примечание: * – различия показателей в сравнении с контрольной группой статистически значимы (p < 0,05).
Клиническая картина системного воспалительного ответа также менялась в зависимости от суток послеродового периода и динамики клинико-лабораторных показателей (табл.2).
Таблица 2
Динамика симптомов СВО в послеродовом периоде у родильниц с тяжелой преэклампсией (М±σ)
|
Показатель
|
1 сутки |
3 сутки |
7 сутки |
14 сутки |
||||||||
|
А n=31 |
В1 n=11 |
В2 n=20 |
А n=31 |
В1 n=11 |
В2 n=20 |
А n=31 |
В1 n=11 |
В2 n=20 |
А n=31 |
В1 n=11 |
В2 n=20 |
|
|
АД сис мм рт.ст. |
139,2±0,3 |
136,4±0,3 |
147,1±1,8 |
143,5±2,3 |
127,2±2,3 |
138,2±1,2 |
139,3±0,1 |
138,7±0,1 |
127,8±2,8 |
134,1±0,6 |
128,8±0,6 |
121,6±3,1 |
|
АД диас мм рт.ст. |
82,2±0,1 |
82,7±0,1 |
92,1±2,7 |
82,5±1,6 |
75,4±1,6 |
89± 2,3 |
97,1±1,1 |
78,7±1,1 |
82,1±0,9 |
79,2±0,7 |
74,3±0,7 |
80,1±0,4 |
|
ЧСС в мин |
82± 0,2
|
68± 0,1 |
78± 0,6 |
87± 0,7 |
86± 0,2 |
77± 0,3 |
90± 0,5 |
89± 0,6 |
80± 0,2 |
88± 0,3 |
104±0,4 |
76±0,1 |
|
Температура тела, С0 |
36,8±0,4 |
36,7±0,4 |
36,6±1,3 |
37,3±0,1 |
36,4±0,8 |
36,7±0,2 |
37,5±0,2 |
37,5±1,2 |
36,7±0,2 |
37,5±0,2 |
37,7±0,6 |
36,6±0,8 |
Изменялась и динамика нарастания билирубина. Так, в первые сутки в группе В2 этот показатель был в пределах нормы, в то время как в группе А – превышал данные в два раза по сравнению с группой В2 (но был еще в пределах оптимальных значений). В группе В1 уже в первые сутки общий билирубин был в четыре раза выше (35,7 мкм/л), чем в группе В2. К третьим суткам в группе А отмечалось незначительное снижение уровня общего билирубина до 11,6 мкм/л. Далее, в группе В1, несмотря на проводимую интенсивную терапию, уровень общего билирубина нарастал до 36,4 мкм/л. С седьмых суток отмечалась тенденция к снижению его уровня в группе В1, в то время как, в группе А было небольшое его увеличение. На 14 сутки в группах А и В1 отмечается снижение уровня билирубина до оптимальных значений (табл. 3).
Таблица 3
Показатели билирубина у родильниц с тяжелой преэклампсией
|
Показатели билирубин /мкм/л |
Группа А n=31 |
Группа В1 n= 11 |
Группа В2 n=20 |
Группа контроля |
|
1 сутки |
15,41±1,4 * |
35,79±1,7 |
8,89 ±1,2* |
10 |
|
3 сутки |
11,60±1,3* |
36,37±1,8 |
8,73 ±1,2* |
12 |
|
7 сутки |
14,56±1,4 * |
26,25±1,6 |
8,43±1,2* |
11 |
|
14 сутки |
12,98±1,6 |
19,60±1,5* |
8,33 ±1,6 |
|
Примечание: * – различия показателей в сравнении с контрольной группой статистически значимы (p < 0,05).
АСАТ в первые сутки в группе В1 увеличен практически в 3 раза до 141,7 u/l, тогда как этот показатель в группе А увеличен в 3 раза по сравнению с группой В2. На 3 сутки отмечается критическое увеличение АСАТ в группе В1 до 249,3 u/l. На 7 и 14 сутки АСАТ снижается до нормальных показателей в группе А 37,8 и 5,9u/l, а также в группе В1 24,6 и 43 u/l. Эти изменения можно связать с нарастанием печеночной недостаточности в группе сравнения В1, несмотря на проводимую терапию в условиях ОРИТ (табл. 3).
О нарастании почечной недостаточности свидетельствует изменение показателей мочевины и креатинина в изученных нами 3-х группах в зависимости от суток послеродового послеоперационного периода. На первые сутки в группах А и В2 показатели были в пределах нормы, а в группе В1 уже отмечалось незначительное увеличение до 10,3 мм/л. На 7 сутки в 3-х группах показатели были в пределах нормы. К 14 суткам, несмотря на проводимую комплексную, посиндромную терапию в условиях ОРИТ, в группе В1 уровень мочевины вырос до 12, 9 мм/л, см. табл. 4.
Таблица 4
Показатели мочевины у родильниц с тяжелой преэклампсией
|
Показатели мочевина/ мл/л |
Группа А n=31 |
Группа В1 n= 11 |
Группа В2 n=20 |
Группа контроля |
|
1 сутки |
5,98± 1,3* |
10,30±1.3* |
4,42 ±1,1* |
2,3 |
|
3 сутки |
6,90± 1,3* |
10,63±1,4* |
4,44 ±1,3* |
3,8 |
|
7 сутки |
6,94 ±1,7 |
8,96±1.7 |
5,29±1,6 |
4,1 |
|
14 сутки |
7,16±1.8 |
12,90±1,4* |
5,95±1,8 |
|
Примечание: * – различия показателей в сравнении с контрольной группой статистически значимы (p < 0,05).
Таким образом, при анализе течения послеродового периода у родильниц с тяжелой преэклампсией можно считать, что ведущее значение имели объем кровопотери и выраженность системно-воспалительного ответа, которые напрямую влияли на развитие почечно-печеночной дисфункции, проявляющейся изменением ферментативной активности печени и приводящее к некрозу гепатоцтов у умерших пациенток. Кризис клинико-лабораторных показателей отмечается на 3 и 7 сутки послеродового периода. Своевременный перевод такого контингента пациентов в специализированный стационар, вероятнее всего, позволит существенно снизить осложнения и летальность в послеродовом периоде.
Рецензенты:
Кравченко Е.Н., д.м.н., профессор, заведующая кафедрой акушерства и гинекологии ПДО ОмГМУ, г. Омск;
Безнощенко Г.Б., д.м.н., профессор, ПДО ОмГМУ, г. Омск.



