В настоящее время заметно увеличивается антропогенная нагрузка на прибрежные морские акватории. Наиболее сильный пресс на водные акватории отмечается в местах расположения крупных промышленных центров и портов. Для прибрежных вод дальневосточных морей, активно используемых в хозяйственной деятельности населения береговых районов, характерна самая высокая загрязненность одновременно всеми видами поллютантов (нефтеуглеводороды, фенолы, тяжелые металлы и т.д. Возрастающая антропогенная нагрузка на морскую среду вызывает значительные экологические изменения в прибрежных акваториях, принимающих наибольшее количество загрязняющих веществ [11]. Загрязнение водоемов химическими токсическими соединениями, в том числе с мутагенным и генотоксическим действием, влияет не только на состав микробных ценозов, но и приводит к изменениям в генетическом аппарате и соответственно эколого-физиологических свойств собственно микроорганизмов [10]. Вместе с тем экологические и эпидемиологические последствия этих изменений еще не определены, но можно предположить, что подобные приспособления могут сопровождаться приобретением микроорганизмами признаков, представляющих опасность для гидробионтов, наземных организмов и человека [13].
Рядом ученых были проведены исследования о влиянии природных факторов среды на изменение биологических свойств у бактерий рода Bacillus, E. coli и возбудителей сапрозоонозов [1; 9]. Например, доказано, что низкая температура изменяет биохимические, адгезивные свойства и вирулентность у патогенных бактерий, в частности у иерсиний, сальмонелл и листерий, обитающих в почве и воде (Сомов, Бузолева, 2004). Но в отношении сапрофитных микроорганизмов такие сведения отсутствуют в литературе.
Цель работы – изучить патогенные свойства бактерий рода Pseudomonas, выделенных из морской среды с разной степенью загрязнения.
Для достижения цели необходимо было собрать коллекцию морских псевдомонад на основании идентификации изолятов, полученных из вод акваторий с разной антропогенной нагрузкой. Полученные штаммы идентифицировали и проверяли с помощью определенных тестов на свойства, характеризующие факторы патогенности бактерий (ферментативные свойства в отношении органических субстратов, гемолитическую активность, адгезивные и инвазивные свойства, т.е. способность адгезировать на поверхности эпителия и проникать внутрь макроорганизма.
Материалы и методы
Для исследований были использованы штаммы бактерий рода Pseudomonas разных видов (Ps. cepacia – 133k, 160k; Ps. fluorescence – 1,8, 3,5, 3,6; Ps. malthophyla – 51; Ps. putida – 136k, 145k, 4, 130k, 140k, 577,6), выделенные из морских сред, отличающихся по степени антропогенной нагрузки – бухта Киевка, б. Круглая и б. Золотой Рог.
Для проведения микробиологических иcследований были выбраны прибрежные акватории Японского моря, отличающиеся природными особенностями, характером и степенью антропогенный нагрузки. Район работ включал акватории бухты Золотой Рог, испытывающие значительное влияние промышленных, бытовых и речных стоков, бухты Круглая, а также бухты Киевка, не обремененные значительными нагрузками антропогенного характера (рис. 1).
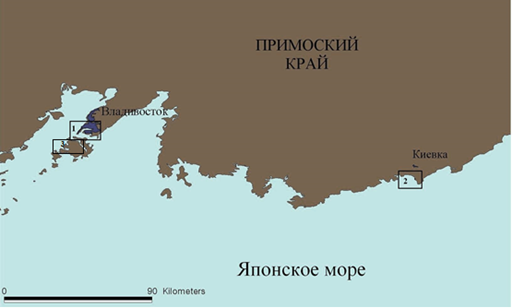
Рис. 1. Карта-схема районов работ: бухта Золотой Рог(1), бухта Круглая (3), бухта Киевка (2)
Бухта Золотой Рог впадает в северный берег пролива Босфор Восточный, между мысом Тигровым и мысом Голдобина, с северо-запада бухта ограничена полуостровом Шкота, вследствие чего для нее характерен низкий водообмен. Бухта используется для судоходства круглый год. Объем годового стока в бухту от разнообразных источников в 4,6 раза превышает объем воды ее акватории. Основными источниками загрязнения являются сточные системы городской канализации, судоремонтные предприятия, крупные городские порты. Часть акватории практически постоянно покрыта нефтяной пленкой, толщина которой у берегов может достигать 100 мкм, в донных осадках толщина отложений нефтесодержащих отходов составляет от 1 до 3 метров. В воде и грунтах высоко содержание техногенных металлов, фенолов, хлоорганических и поверхностно-активных соединений [3].
Бухта Киевка вдается в берег между мысом Суткового и мысом Островной. Северозападный и восточный берега бухты высокие, а берег вершины отмел и окаймлен песчаным пляжем. К берегу вершины бухты выходит низменная долина, по которой протекает река Киевка. На побережье отсутствуют жилые постройки, в летний период времени бухта испытывает незначительную рекреационную нагрузку. Бухта более открыта имеет место активный водообмен, по сравнению с другими выбранными, мониторинговые исследования позволяют отнести ее воды к категории «чистые» [4].
Бухта Круглая защищенная от юго-восточных ветров, незначительно вдается в северо-западный берег полуострова Брюса в 1,4 мили к WSW от мыса Брюса. Входные мысы бухты скалистые и обрывистые, к вершине бухты берег понижается и переходит в широкий галечный пляж. На берегу располагается санаторно-оздоровительный комплекс. Несмотря на то что техногенного загрязнения здесь не наблюдается, но в летний период времени имеет место рекреационная нагрузка [8].
Для выделения в чистую культуру морских бактерий использовали известные микробиологические методы [12] и среду для морских гетеротрофных микроорганизмов – СММ [14]. Определение видов исследуемых изолятов проводили на основании таксономических признаков по схеме Берджи [7].
Определение липолитической, протеолитической, амилолитической, гемолитической и лецитиназной активности проводили в соответствии с известными методами, описанными в литературе [12], высевая суточную культуру на соответствующие среды: с агаровой средой, содержащей 3 % липидного гомогенизата; 25%. снятого молока; 0,2% крахмала; 5% стерильной дефибринированной крови; 20% стерильной желточной взвеси [5; 12] Активность ферментов определяли по проявлению реакции на этих средах (рис. 2).
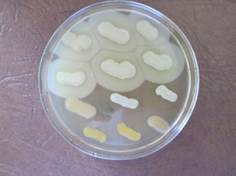
Рис. 2. Пример учета липазной активности штаммов на среде ГРМ
Для определения чувствительности микроорганизмов к антибиотикам использовали метод диффузии антибиотика в ГРМ агар с применением бумажных дисков. При определении чувствительности методом диффузии в агар чистую культуру бактерий засевали «газоном» на питательный агар в чашке тампоном, смоченным в стандартизованной (108 КОЕ/мл) суспензии микроорганизма. Затем на поверхность агара укладывали стандартные бумажные диски, пропитанные антибиотиками (карбеницилин, тетрациклин, ампицилин, цефотаксим, ципрофлоксацин, цефтозидим, цефоперазон), которые диффундируют в агар, создавая градиент концентрации. На чашку диаметром 90 мм равномерно укладывали 6-7 дисков. После инкубирования при комнатной температуре измеряли диаметры зон задержки роста вокруг дисков и по специальным таблицам определяли степень чувствительности к тому или иному [6]. Диаметр зон задержки роста микроорганизмов выражали в мм. Учитывали все случаи встречаемости чувствительности (слабо и высокочувствительный) и трактовали как чувствительный штамм, и отдельно учитывали нечувствительные к тому или иному антибиотику штаммы.
К факторам патогенности относят проявление у микроорганизмов гемолитической, цитопатической активности и адгезивных свойств. Для исследования гемолитической активности использовали 5% кровяной агар [12].
Для постановки опыта с целью изучения адгезивных свойств исследуемых штаммов была использована методика В. И. Бриллис (1986). В качестве экспериментальной модели были взяты эритроциты человека О (I) группы Rh (+) крови. Взвесь бактерий готовили в концентрации 109 клеток/мл, бактерии инкубировали при 370С. Адгезию изучали под световым микроскопом на микроскопе Micros mc 20. При оценке адгезивных свойств микроба использовали показатели: средний показатель адгезии (СПА), коэффициент участия клеток в адгезивном процессе (К) и индекс адгезивности микроорганизма (ИАМ). Подсчет вели на 100 клетках, просматривая все предметное стекло. Микроорганизмы считали неадгезивными при ИАМ меньше 1,75, низкоадгезивными – от 1,76 до 2,5, среднеадгезивными – от 2,51 до 4,0 и высокоадгезивными при ИАМ выше 4,0. Для исследования цитопатических свойств микроорганизмов использовали культуру клеток Vero E6. Монослой клеток выращивали в течение 3 суток на культуральных 96-луночных планшетах с использованием среды Игла МЕМ (minimal essential medium) с двойным набором аминокислот и витаминов, дополненной L-глютамином (1 мг/мл) и 7% сыворотки эмбрионов коров. Для инокуляции клеточных культур готовили суспензию клеток псевдомонад, выращенных на питательной среде для морских гетеротрофных организмов [14]. В эксперимент были взяты разведения культуры по стандарту мутности от 10-9 до 10-1 клеток/мл. Инокуляцию проводили суспензией 22-часовой культуры. Через определенные интервалы времени (24, 48 часов) оценивали цитотоксические и инвазионные свойства по инфицированию культуры клеток бактериями, по изменению морфологии отдельных клеток и деструкции монослоя при микроскопическом исследовании (рис. 3). Цитопатические свойства псевдомонад считали выраженными при наблюдении в поле зрения микроскопа дегенеративных изменений монослоя Vero E6 (гибель более 50 % клеток).
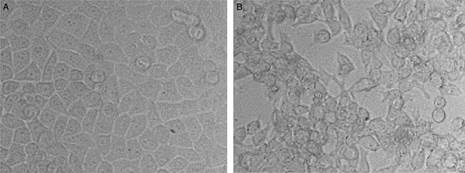
Рис. 3. Визуальная оценка цитопатогенного действия морских микроорганизмов на монослой клеток Vero E6., выращенного в течение 3 суток на среде Игла МЕМ
Результаты и обсуждения
На первом этапе исследования были выделены из морской воды 32 морфотипа псевдомонад, из них 14 изолятов из б. Золотой Рог, 9 – из б. Круглая, 9 – из б. Киевка.
По результатам проведенных работ установлено, что свойства у штаммов бактерий, выделенных из акваторий с разной степенью антропогенной нагрузки, проявляются по-разному.
Данные, полученные при исследовании ферментативных свойств штаммов, выделенных из б. Киевка, оказались малорезультативными. Протеолитической активностью обладали 33% штаммов, а штаммов, разлагающих углеводы и липиды не было выявлено вовсе. Исследование штаммов б. Круглая показало, что 67% из них проявляют различные ферментативные свойства, наиболее часто встречаемой являлись липолитическая и лецитиназная активность. В б. Золотой Рог 64% штаммов обладали ферментативной активностью, причем большинство из этих штаммов (67%) обладали практически всем спектром исследуемых свойств, 22% обладали также гемолитической активностью.
При исследовании антибиотикочувствительности бактерий оказалось, что наиболее устойчивыми были штаммы, выделенные из б. Золотой Рог. 65% штаммов показали устойчивость ко всем антибиотикам, используемым в эксперименте. У 35% штаммов наиболее активное подавление роста вызвали ципрофлоксацин и цефоперазон, наименее активным оказался ампициллин (у 7% штаммов). Штаммы б. Круглая были устойчивы к 6-ти антибиотикам из 7-ми используемых в опыте. Наибольшее подавление роста наблюдали при воздействии ципрофлоксацина (100% подавление роста), наименьшее – ампициллин (22%). Среди штаммов, выделенных из б. Киевка 22% оказались устойчивыми ко всем антибиотикам. Наименьшее подавление роста клеток отмечено при воздействии ампициллина (44% штаммов) и цефтозидима (56%). Таким образом, сравнительное исследование показало, что в акваториях, страдающих от мощного антропогенного загрязнения, в микробных сообществах преобладают микроорганизмы устойчивые к лекарственным веществам. (рис. 4 а). Были исследованы свойства морских бактерий, которые характеризовали бы их потенциал с точки зрения патогенности, адгезивные свойства. Исследования показали, что наиболее выраженными адгезивными свойствами обладают штаммы, выделенные из поверхностных вод б. Золотой Рог.
В 43% случаев у штаммов, выделенных из б. Золотой Рог, проявлялись сильноадгезивные свойства, когда как у штаммов б. Круглая только в 9% случаев, а у штаммов из б. Киевка – в 2%.
Более слабые адгезивные свойства проявили 50% штаммов из бухты Золотой Рог, из бухты Круглая – 78% и 24% из бухты Киевка.
Наименьшие адгезивные свойства показали штаммы, выделенные из бухты Киевка (53% случаев), а также вовсе неадгезивные свойства показали штаммы в 21% случаев (рис. 4 б).
При изучении цитотоксических свойств исследуемых штаммов при исходной концентрации клеток - 109 клеток/мл не было получено четких результатов. Практически все культуры при исходной концентрации клеток (109 клеток/мл) в 50% случаев разрушали клетки монослоя.
Разведение культур штаммов дало более четкие результаты в отношении их токсичности к чувствительным тест-клеткам. Так 79% штаммов, выделенных из б. Золотой Рог были патогенными даже при разведении культуры бактерий до 105 кл/мл. У коллекции штаммов, выделенных из б. Круглая такими цитопатическими свойствами обладали 22 % из всех изолятов, а из б. Киевка – 11 % (рис.4 в).
А) 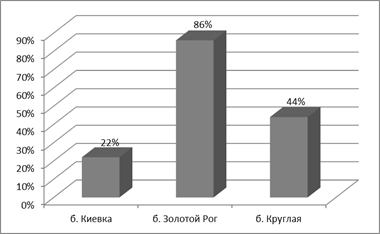
Б) 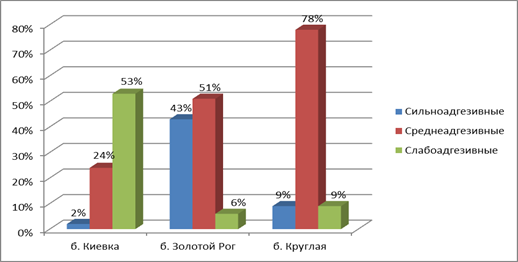
В) 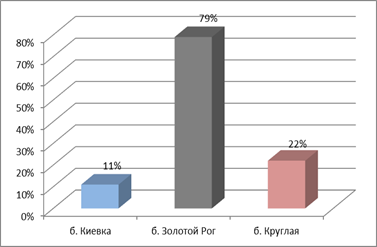
Рис. 4.Сравнительная характеристика антибиотикочувствительности (А), адгезивных свойств (при ИАМ от 2,51 до 4,0 и выше ) (Б) и ЦПД (гибель клеток составила 50% и выше при разведении культуры до 105 кл/мл ) (В) морских бактерий из районов с разной степенью антропогенной нагрузки
Выводы
Доминирующими видами, выделенными из различных районов были, были Ps. рutida и Ps. cepacia, которые были обнаружены во всех исследуемых районах. Б. Золотой Рог характеризовалась большим процентом пигментирующих бактерий – 79%, так как пигментация является средством защиты бактериальных клеток в грязной среде.
Факторы патогенности более выражены у микроорганизмов из загрязненной акватории. Штаммы, выделенные из б. золотой Рог по всем показателям патогенности преобладают над штаммами, выделенными из бухт Киевка и Круглая.
В сравнении антибиотикочувствительности штаммов наиболее устойчивыми оказались штаммы, выделенные из б. Золотой Рог, что обуславливается высокой устойчивостью штаммов к тяжелым металлам.
В значительных концентрациях штаммы, выделенные из всех районов, оказывают разрушающее действие на живые клетки. Однако, при дальнейшем разведении культур бактерий наибольший цитопатический эффект показали штаммы из б. Золотой Рог. Следовательно, даже при малых количествах эти штаммы оказываются опасными для клеток живых организмов. В исследовании адгезивных свойств штаммы псевдомонад, выделенные из б. Золотой Рог, более агрессивны. Это связанно с тем, что среда влияет на поверхностные структуры бактериальных клеток, что в свою очередь влияет на адгезивность клеток.
На примере б. Золотой Рог, где имеется смешанное загрязнение вод, было показано, что загрязнение среды порождает более агрессивные штаммы, которые обладают выраженной фактической патогенностью и высокой вирулентностью. Работа сделана на стыке общей и медицинской микробиологии, поэтому такие исследования проводятся впервые и полученные материалы свидетельствуют о том, что необходимо продолжить изучение свойств морских сапрофитных бактерий, обитающих в условиях хронического антропогенного загрязнения.
Работа выполнена при финансовой поддержке Российского научного фонда (соглашение № 14-50-00034).
Рецензенты:
Кузнецова Т.А., д.м.н., заведующая лабораторией иммунологии ФГБУ НИИ эпидемиологии и микробиологии имени Г.П. Сомова, г. Владивосток;
Мартынова А.В., д.м.н., профессор кафедры биохимии, микробиологии и биотехнологии Школы естественных наук Дальневосточного Федерального университета, г. Владивосток.



