Aктуальность. На современном этапе, по данным ВОЗ, успешность имплантации составляет 96-97%, тем не менее, остаются малоизученными вопросы установки имплантов у пациентов, страдающих онкологическими заболеваниями, остеопорозом, у которых на фоне приёма препаратов для специфического лечения развивается серьезный побочный эффект – ассоциированный с бифосфонатами (БТС) остеонекроз челюстей (BRONJ) [1-4]. Несмотря на то, что количество таких больных небольшое, вопросы лечения этой категории пациентов требуют особых подходов при выборе лечения, разработки новой стратегии, фундаментальных представлений о клеточных взаимодействиях, роли иммуноцитов в барьерных свойствах покровных тканей. На современном этапе отсутствуют установки каких-либо стандартов оказания медицинской помощи этой категории больных [11, 23, 27]. Бифосфонаты в основном используется благодаря бесспорным свойствам ингибировать резорбцию кости остеокластами при лечении различных заболеваний, таких как остеопороз, множественная миелома, опухоли, которые метастазируют в кости и злокачественная гиперкальциемия [13, 21].
Применение этих препаратов остро дискутируется, анализируется количество результатов, которые получены in vitro и in vivo в естественных условиях в экспериментах на животных [5, 16].
Существующее положение в стоматологическом менеджменте оказания услуг и помощи больным с онкологией, остеопорозами определило направление наших исследований, посвящённых получению новых данных для четкого понимания механизмов остеонекроза челюстей. Продолжение исследований и разработка практических рекомендаций может привести к новым знаниям в области стоматологии, поэтому изучение механизмов эпителио-мезенхимальных взаимодействий в тканях полости рта является наиболее актуальным [6, 9, 17, 25].
Целью нашего исследования является морфологический анализ материала больных с онкопатологией, в частности, с миеломой, а также остеопорозом для разработки новых данных для дополнений к современной классификации методов хирургического лечения больных на фоне приёма бифосфонатов (BRONJ), и возможности получения прогностической оценки вероятности успеха после установки имплантов.
Материал и методы. Материалом для анализа послужили данные исследований с 2000 года по 2015 год, содержащие сведения о состоянии слизистой оболочки полости рта у больных с онкопатологией, миеломой, остеопорозом, с адентией локальной и генерализованной, врождённой и приобретённой в результате травм в возрасте от 20 до 85 лет, имеющие дефекты зубных рядов с атрофией или без изменений челюстей, удалявших зубы, или утративших зубы в результате кариеса, а также пародонтита или пародонтоза. В качестве контроля исследована СОПР людей без сопутствующей патологии, получивших в результате травмы утрату одного или нескольких зубов. В работе использованы результаты собственных исследований 2-х случаев миеломы с проявлениями остеонекроза и при отсутствии внешних признаков остеонекроза в условиях репаративной регенерации после установки имплантов, а также в период ремиссии миеломной болезни.
Весь спектр клинических обследований слизистой оболочки полости рта проводился в динамике – в процессе подготовки и установки имплантов. Решающим параметром для возможности установки имплантатов являлось наличие достаточного объема кости в области предполагаемой имплантации. Установка внутрикостных имплантатов требует достаточного количества и качества костной ткани в необходимом участке челюсти. При недостатке кости, в зависимости от морфологии дефекта, выбирали метод наращивания гребня. Преимущественно использовали теменные кортикальные костные трансплантаты, подбородочные и взятые с ветви, которые имеют внутримембранное происхождение и потому резорбируются меньше, чем имеющие энхондральные источники развития. Эта особенность репаративной регенерации объясняется быстрой реваскуляризацией и медленной резорбцией костей внутримембранного происхождения.
Все пациенты были условно разделены на группы:
1) согласно возрастной классификации периодизации Г. Крайга: ранняя взрослость – 20–39 лет, средняя взрослость – 40–59 лет, поздняя взрослость – 60 лет и более с учётом сопутствующей патологии и наличием или отсутствием хирургического вмешательства по удалению зубов (табл.1).
Таблица 1
Распределение материала по возрастным группам и патологии
|
Возраст |
Хирургические операции по удалению постоянных зубов |
Онкология, Миелома |
Папиллома на СОПР |
ССС Патология |
Эндокринная патология |
остеопороз |
Пародонтит/пародонтоз |
|||
|
были |
нет п/к |
диабет |
аденома гипофиза |
тиреотоксикоз |
||||||
|
20-39 |
23 |
45/12 |
0 |
3 |
0 |
3 |
0 |
3 |
0 |
3/11 |
|
40-59 |
155 |
9/18 |
3 |
5 |
29 |
21 |
3 |
4 |
12 |
4/13 |
|
60 и более лет |
56 |
3/6 |
0 |
7 |
63 |
47 |
0 |
0 |
17 |
3/59 |
|
Контроль |
0 |
36 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
ИТОГО |
292/36 |
3 |
15 |
92 |
71 |
3 |
7 |
29 |
10/83 |
|
2) по локализации и характеру дефектов зубных рядов в соответствии с классификацией Е.И. Гаврилова (табл. 2).
Таблица 2
Распределение пациентов по классификации зубных рядов с дефектами
|
Возраст, лет |
Количество наблюдений по классам, абс. |
||||||
|
1-й |
2-й |
3-й |
4-й |
5-й |
6-й |
7-й |
|
|
20–39 |
8 |
5 |
9 |
8 |
3 |
5 |
4 |
|
40–59 |
9 |
7 |
13 |
11 |
1 |
9 |
5 |
|
60 и более |
5 |
17 |
6 |
17 |
4 |
13 |
7 |
|
Итого |
22 |
29 |
28 |
36 |
8 |
27 |
16 |
4) по характеру и степени атрофии челюстей с частичной или полной адентией в соответствии с классификациями Келлера и Шредера (табл. 3).
Таблица 3
Распределение пациентов по характеру и степени атрофии челюстей с частичной или полной адентией
|
Возраст, лет |
Количество наблюдений по типам, абс. |
||||||
|
по Келлеру |
по Шредеру |
||||||
|
1-й |
2-й |
3-й |
4-й |
1-й |
2-й |
3-й |
|
|
20–39 |
4 |
0 |
0 |
0 |
3 |
1 |
0 |
|
40–59 |
1 |
0 |
2 |
1 |
1 |
2 |
1 |
|
60 и более |
0 |
1 |
2 |
1 |
0 |
2 |
2 |
5) при планировании дентальной имплантации в соответствии с классификацией М.З. Миргазизова (табл. 4).
Таблица 4
Распределение пациентов по видам дентальной имплантации
|
Возраст, лет |
Кол-во наблюдений по классам (М.З. Миргазизов, 2003)1, абс. |
|||||
|
1-й |
2-й |
3-й |
4-й |
5-й |
6-й |
|
|
20–39 |
2 |
2 |
4 |
3 |
2 |
3 |
|
40–59 |
4 |
4 |
4 |
14 |
11 |
13 |
|
60 и более |
1 |
3 |
2 |
1 |
3 |
2 |
1 Все классы характеризовались следующими свойствами костной ткани: Q1–2, V1–2, T1–2.
где Q – качество кости (1-4); V – объем кости (1- 4); T– топографические особенности зоны имплантации (1-4).
1 – нормальные параметры (благоприятные условия);
2 – незначительные отклонения, требующие учета без вмешательств);
6) контрольная группа – 36 практически здоровых людей 20–85 лет, утративших зубы в результате травмы, и которым проводилась предимплантационная подготовка полости рта.
При недостатке кости, в зависимости от морфологии дефекта, выбирали метод наращивания гребня. С этой целью использовали методику «золотого стандарта» с аутотрансплантацией костных блоков.
Все пациенты обследованы согласно протоколу с заполнением медицинской карты стоматологического больного формы № 043/у, забор биоптатов производили в рамках Хельсинской декларации с информированного согласия пациентов или, в случае недееспособности, опекунов (2000) и с разрешением этического комитета ФГАОУ ВПО Дальневосточный Федеральный Университет.
Для морфологического исследования при удалении зубов или их корней, имплантации и микрохирургических пародонтологических операций иссекались фрагменты слизистой оболочки десны объемом 1 мм3. Забор материала производился во время хирургического или в ранние сроки после травматического удаления зубов, всего изучено 2879 биопсий. Также материал забирали во время подготовки пациента к установке имплантов (при коррекции атрофии челюстей) и в случае отторжения имплантов (4 случая за период с 2011 по 2015 гг.) для получения полной характеристики взаимодействия эффекторных иммуноцитов в слизистой оболочке полости рта. Параллельно проводился цитологический анализ с поверхности слизистой оболочки полости рта для расширения диагностического ресурса успешности имплантации и прогнозирования исходов и перспектив установки имплантов, а также для разработки мер профилактики осложнений имплантации.
Основным методом морфологического исследования явилось иммуногистохимическое фенотипирование на основе кластеров дифференцировки (Cluster of Differentiation – CD) – T-лимфоцитов (СD4+/СD8+), CD34, клеток Лангерганса (СD68+), интерстициальных макрофагов (СD163+). Интенсивность пролиферативных процессов в эпителиальной пластинке оценивалась по митотическому индексу посредством маркера Ki-67: количество митозов на 100 клеток. Апоптоз изучен Тunel методом для световой микроскопии. Также для изучения апоптических процессов при подготовке полости рта и при имплантации получена характеристика Р53. Иммуноморфологическое исследование проводили в лабораториях патоморфологии и иммунной гистохимии университета г. Ниигата (Япония) и Международном медицинском научно-образовательном центре (IMERC, Ниигата, Япония).
Кроме того, при анализе биопсий использовались рутинные методики (окраски гематоксилином и эозином, по Ван-Гизону, Victoria blue, по Браше и альциановым синим).
Изучение гистологических срезов и мазков-отпечатков осуществлялось с помощью микроскопа Olympus BX52 с оригинальным программным обеспечением для морфометрии.
Статистическая обработка полученных данных, проверка статистической значимости различий между группами по параметрам распределения и сравнение групп выборок проведено с применением методов вариационной статистики, параметрических и непараметрических методов корреляционного анализа.
Результаты собственных исследований. Установлены особенности слизистой оболочки больных миеломной болезнью, пациентов с онкопатологией, а также с остеопорозами, которые заключаются в большем, по сравнению с нормой, количеством апоптозирующих клеток не только в ростковых слоях эпителиальных пластов, но и в собственной пластинке слизистой оболочки полости рта, при этом отмечается сниженная пролиферативная активность кератиноцитов (рис. 1а, 1б, 1в). Также нами отмечена лимфоцитарная инфильтрация.
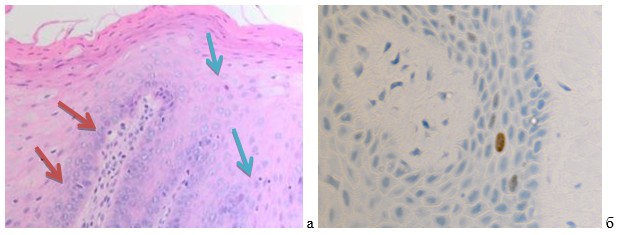
Рис. 1а-б. Слизистая оболочка десны человека 56 лет при миеломной болезни в зоне установки импланта
Наблюдается апопотоз эпителия в камбиальном и шиповатом слоях, а также в собственной пластинке. А) Апоптозирующие клетки указаны красными стрелками. Лимфоцитарная инфильтрация (указано зелёными стрелками). Микрофото. А-окраска г/э; б) ИГХ (Ki67). Ув.х 400.
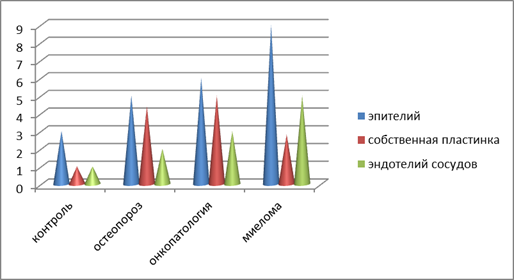
Рис. 1в. Диаграмма уровня апоптоза в структурах слизистой оболочки на фоне различной патологии пациентов при имплантации
Методом иммунной гистохимии выявлены отклонения в содержании макрофагов CD68 в слизистой оболочке обследованных больных. Учитывая, что CD68 играет роль в фагоцитарной активности тканевых макрофагов, как во внутриклеточном лизосомальном метаболизме, так и во внеклеточных взаимодействиях клетка-клетка и клетка-патоген, анализ результатов показал, что защитные свойства ткани снижены (рис. 2а). На фоне снижения количества CD68, отмечается многочисленная инфильтрация как эпителиальных пластов, так и прилежащей соединительной ткани эффекторных антигенпрезентирующих иммуноцитов (рис. 2 б, 2в, 2 г).
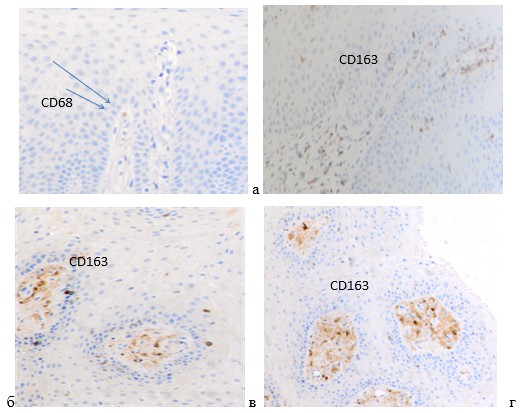
Рис. 2. Слизистая оболочка десны человека. ИГХ. А) CD68; б, в, г) СD 163.
Микрофото. Ув. 400
При этом нами отмечено, что количество эффекторных клеток CD163 преобладает в собственной пластинке слизистой оболочки десны в зоне имплантации.
Маркёр Р53 позволил выявить клетки преимущественно в базальных камбиальных слоях эпителия (рис. 3), что соответствует данным анализа апоптоза в различных пластинках слизистой оболочки с учётом того, что ядерный белок р53 активируется при повреждениях генетического аппарата, а также при стимулах, которые могут привести к подобным повреждениям, или являются сигналом о неблагоприятном состоянии клетки (стрессовом состоянии). Учитывая отсутствие реституции эпителиоцитов в период острой миеломы, до явных морфологических проявлений, трансформация в клетках связана, скорее всего, с нарушением регуляции синтеза сигнальных межклеточных мессенджеров. Об этом свидетельствует и миграция дендритных антиген представляющих клеток в большей степени из эпителиальных пластинок в подлежащую соединительную ткань. И мы считаем, что данное утверждение, как раз в связи с фактом функции белка р53, которая не проявляется при наличии стволовых клеток, свидетельствует об утрате камбиального регенераторного потенциала с последующим отсутствием дифференцировки и специализации клеток, выполняющих барьерные функции, что и приводит в последующем к нарушению и отсутствию физиологической и репаративной регенерации, сопровождаясь обнажением костной ткани, а затем её некрозом. Данные о том, что в регуляции активности белка р53 ведущая роль принадлежит посттрансляционным модификациям белка и его взаимодействиям с другими белками, объясняют, почему наблюдается уменьшение концентрации свободных рибонуклеотидов, которое, по нашему мнению, происходит потому, что отсутствует свой собственный камбий в эпителиальной пластинке слизистой оболочки. Поэтому этот факт мы считаем как ещё одно косвенное свидетельство уменьшения камбия и отсутствие его пролиферации в период до развития яркой картины разрушения мягких тканей и остеонекроза.
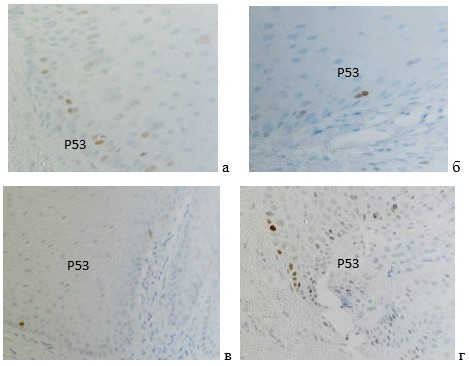
Рис. 3. Слизистая оболочка десны человека. ИГХ. Р53. Микрофото. Ув. 400
Установлено, что высокая активность CD34 проявляется в эндотелии кровеносных сосудов всех калибров, включая мелкие капилляры 5-7 ммк (рис. 4).
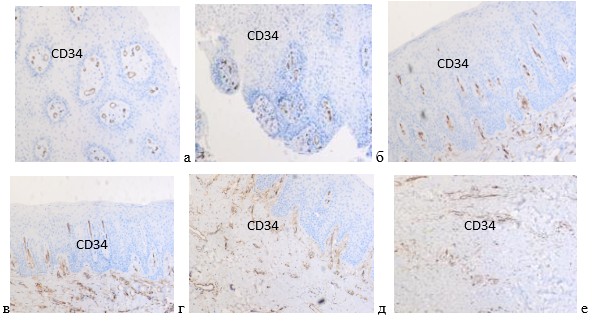
Рис. 4. Слизистая оболочка десны человека. ИГХ. CD34. Микрофото. Ув. 400
Так как CD34 является мембранным белком и представлен молекулами межклеточной адгезии, вероятно, опосредованно способен связывать стволовые клетки со стромальными клетками. Служит белковым скаффолдом для присоединения специфичных гликанов, который позволяет стволовым клеткам прикрепляться к лектинам, вырабатываемыми клетками стромы, или связываться с селектинами сосудистого эндотелия.
Обсуждение собственных результатов. Известно, что бисфосфонаты являются первичными агентами в эффективном фармакологическом арсенале против RANKL - остеокласт-опосредованной потери костной массы путем подавления экспрессии генов NFATc1 и Caii при остеопорозе, болезни Педжета, злокачественных новообразованиях с метастазами в кости, мульформной миеломы и гиперкальциемии при злокачественных новообразованиях [7, 10, 15]. Также их назначают при несовершенном остеогенезе и профилактике остеопороза [8]. Однако ограничить патогенез деструкции кости только депрессией остеокластов и снижением ангиогенеза недостаточно, необходимы дальнейшие более глубокие исследования, чтобы патогенетически обоснованно применять бифосфанаты [26]. Структурно-функциональные корреляции, молекулярные и клеточные механизмы, лежащие в основе действия бисфосфонатов также рассматриваются в плане поиска новых молекулярных мишеней. Выявленные нами особенности пролиферативной активности кератиноцитов и распределения иммуноцитов в эпителиальной пластинке слизистой оболочки показали, что в патогенезе остеонекроза челюстей на фоне длительного приёма бифосфанатов механизм повреждения ткани челюсти и развития остеонекроза связан не только с влиянием бифосфонатов на активность остеокластов и ингибированием резорбции кости. Наши данные по иммуноцитам согласуются с данными о том, что содержание интерлейкина (ИЛ) -6 и остеопротегерина в слизистой оболочке у пациентов с некрозом были значительно повышены в сравнении с данными у больных без патологии, в то время как концентрация гидроксиметилглутарил кофермента А редуктазы и VEGF значительно уменьшалась [18, 24]. Результаты нашего исследования свидетельствуют о важности мониторинга оценки лечения бисфосфонатами на основе выявления соотношения и распределения количества иммуноцитов в структурах слизистой оболочки, а также производства IL-6, RANKL, остеопротегерина, и VEGF, для того, чтобы выявить начальные микроскопические и биохимические изменения, ведущие к остеонекрозу [19]. Ранняя диагностика может предотвратить или уменьшить заболеваемость вследствие деструктивных поражений костной ткани челюсти [12, 14, 16, 20].
Заключение. Механизм остеонекроза челюстей у стоматологических пациентов с онкопатологией, миеломной болезнью, остеопорозом связан с нарушениями в системе взаимодействия антигенпрезентирующих макрофагов CD68, эффекторных макрофагов CD163, повышенным апоптозом, сниженным регенераторным потенциалом и отсутствием реституции, которая может быть связана с нарушением не только межклеточных эпителио-мезенхимных взаимодествий, но и синтезом сигнальных молекул. Наиболее показательны отклонения в активности клеток, маркирующихся Р53, которые могут служить ярким критерием доклинических проявлений морфологических изменений в системе эпителио-мезенхимных взаимодействий в слизистых оболочках десны в зоне имплантации. Появление большого количества клеток, меченных Р53, свидетельствует о развитии повышенного апоптоза, как отклонения от нормальной физиологической и даже репаративной регенерации, отсутствии реституции, снижении регенераторного потенциала и исчезновении собственных камбиальных кератиноцитов, а также нарушении выработки факторов дифференцировки лимфоцитов вследствие апоптоза эффекторных кератиноцитов. Отсутствие барьерных тканей, ведёт к микробной контаминации костной ткани челюсти и остеонекрозу на фоне нарушения остеосинтеза.
Работа выполнена при поддержке научного фонда ДВФУ, в рамках государственного задания 2014/36 от 03.02.2014 г. и Международного гранта ДВФУ (соглашение № 13-09-0602-м от 6 ноября 2013 г.).
Рецензенты:
Красников Ю.А., д.м.н., профессор школы искусства, культуры и спорта, Дальневосточный федеральный университет, г. Владивосток;
Скляр Л.Ф., д.м.н., доцент ГБУЗ ККБ №2 центр СПИД, г. Владивосток.



