Общепринятой является точка зрения о том, что хроническая венозная недостаточность (ХВН) развивается на фоне повреждения венозных клапанов после тромбоза вен нижних конечностей. Однако, патогенез ХВН точно не известен [5,10]. Поэтому, для улучшения клинических результатов необходимо более полное и глубокое исследование патогенетических механизмов развития и течения хронической венозной недостаточности, что позволит выработать новые медицинские технологии в ранней диагностики и лечение этих заболеваний [2,6].
Цель работы: исследовать метаболические нарушения при хронической венозной недостаточности нижних конечностей у женщин.
Для реализации поставленной цели нами было обследовано 34 женщины с посттромбофлебитическим синдромом (ПТФС) и 51 женщина с варикозной болезнью. Группу сравнения составили 30 здоровых женщин. Пациентки основных групп находились на стационарном лечении в сосудистом отделении ГБУЗ РМ «Республиканская клиническая больница № 4» г. Саранска.
Все обследуемые пациентки получали терапию, включающую дезагреганты, препараты, улучшающие микроциркуляцию, и антибиотики. При ПТФС применялись антикоагулянты, всем больным с варикозной болезнью выполнена флебэктомия. Результаты лечения оценивали на 3-и и 8-е сутки (в конце терапии).
Критериями включения в исследование служили женщины с заболеваниями вен нижних конечностей (посттромбофлебитический синдром, варикозная болезнь); пациентки с 3-ей или 4-ой степенью ХВН при варикозной болезни; добровольное согласие пациентов на участие в исследовании и использование результатов их обследования. Из исследования исключались мужчины с заболеваниями вен нижних конечностей; пациентки с посттромбофлебитическим синдромом, которые принимали до включения в исследование лекарственные препараты, направленные на повышение тонуса вен, улучшение лимфодренажной функции и микроциркуляторных расстройств.
Интенсивность метаболических нарушений определяли по накоплению малонового диальдегида (МДА) плазмы и эритроцитов (Колясова О.Е., Маркина А.А., Федорова Т.Н., 1984). Об антиоксидантной активности крови судили по уровню в ней каталазы (Бурлакова Е.Б., Архипова Г.В., Голощапов А.Н., 1982). Гидрофобный компонент эндогенной интоксикации (ЭИ) оценивали, определяя общую и эффективную концентрацию альбумина (ОКА и ЭКА) флуоресцентным методом на анализаторе АКЛ-01 с помощью набора реактивов «Зонд - альбумин». Рассчитывали индекс токсичности (ИТ) по формуле: ИТ = (ОКА/ЭКА) - 1 и резерв связывания альбумина (РСА) по формуле: РСА = ЭКА/ОКА (Грызунов Ю.А., Добрецов Г.Е., 1994). Оценивали содержание общих и свободных SH-групп по методу В.Ф. Фаломеева (1981г); исследование проводили не позднее 3 часов после забора и центрифугирования крови. Рассчитывали индекс детоксикации (ИДТ) по формуле: ИДТ = SH свободные/SH общие; коэффициент МДАпл/Капл, который свидетельствует о сдвиге реакций ПОЛ в прооксидантную или антиоксидантную сторону. Рассчитывали модифицированный лейкоцитарный индекс интоксикации (ЛИИм) по В.К. Островскому и соавт. (1983).
Статистическая обработка полученных результатов проведена с использованием t-критерия Стъюдента. Вычисления производились на персональном компьютере Pentium III с помощью программы «Medstat» (автор В.А. Акимов (С) Copyright 1993) и программы «Primer of Biostatistics 4.03» (Copyright 1998). Данные считались достоверными при уровне значимости p<0,05 (Закс Л., 1976; Поляков И.В., Соколова Н.С., 1975).
Корреляционный анализ параметрических данных проводился по методу Пирсона с использованием программы «Microsoft Excel» и таблицы минимальных значений коэффициентов корреляции Пирсона. При ±1>r>±0,7 отмечалась сильная, при ±0,69>r>±0,3 - средняя, при ±0,29>r>±0 - слабая прямая или обратная корреляционная связь.
Степень достоверности различий рассчитывали по отношению к группе сравнения (p), по отношению к соответствующему значению до лечения (pl).
Результаты исследований. Клинически эндогенная интоксикация при хронической венозной недостаточности проявлялась слабостью и недомоганием. Одновременно с этим происходило увеличение ЛИИм на 41,7% относительно группы сравнения при ПТФС и 58,3% при варикозной болезни.
При ХВН почти на четверть увеличивалось содержание МДА плазмы и эритроцитов, а уровень каталазы плазмы снижался на 13,7% (p<0,05) относительно группы сравнения у пациенток с ПТФС и на 23,3% (р<0,05) при варикозной болезни.
Консервативное лечение ПТФС приводило к недостоверному снижению уровня МДА плазмы и эритроцитов уже к 3-м суткам на 19,8% (p1>0,05) и 9,4% (p1>0,05). К 8-м суткам МДА плазмы, продолжая снижаться на 23,1% (p1<0,05) от исходного, достиг уровня, характерного для здоровых женщин. МДА эритроцитов к концу лечения, наоборот, несколько повысился, но остался ниже исходного показателя на 7,8% (p1>0,05), хотя и был выше, чем в группе сравнения. Согласованно с динамикой вторичных продуктов ПОЛ изменялась активность каталазы плазмы. Активность фермента несколько увеличилась к третьим суткам на 13,4% (p1<0,05), далее снизилась, превышая исходное значение на 12,2% (p1<0,05) и практически не отличалась от показателя у здоровых женщин (рис.1).
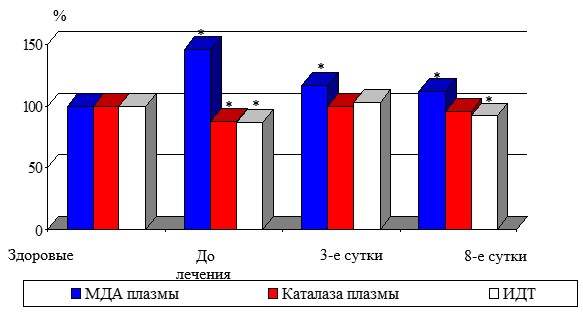
Рис. 1. Динамика показателей ПОЛ и АОС при посттромбофлебитическом синдроме
Примечание: * - достоверность показателя по отношению к группе сравнения (p<0,05)
Динамические изменения в системе ПОЛ-АОС при варикозной болезни на фоне терапии заключались в следующем: происходило недостоверное снижение уровня МДА плазмы к 3-м суткам на 5,5% (р1>0,05), а к 8-му дню - на 16,7% (р1<0,05), что было на уровне показателя в группе сравнения. МДА эритроцитов несколько уменьшился в процессе лечения на 6,9% (p1>0,05), что было на 17,1% (p>0,05) выше, чем в группе сравнения. Снижение вторичного продукта липопероксидации служит хорошим прогностическим признаком эффективности лечения. Активность каталазы увеличилась к 3-м суткам на 14,6% (р1<0,05), к 8-му дню - на 21,7% (p1<0,05). По сравнению с показателем, у здоровых женщин активность каталазы плазмы после лечения в третьей группе была практически на том же уровне (рис. 2). Отношение МДА/КА до лечения составило 3,95±0,14 усл.ед., что было на 19% выше контрольного показателя (p<0,05). На 8-ые сутки после флебэктомии коэффициент снизился на 24% (p1>0,05), что было на 9,6% (p<0,05) меньше, чем в группе сравнения.
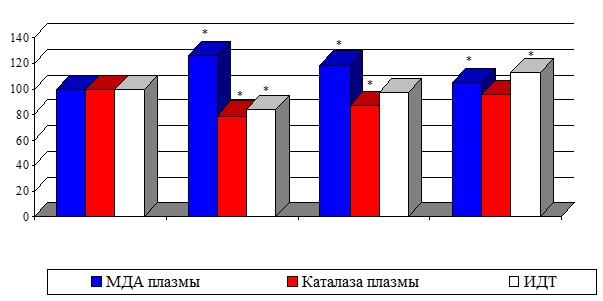
Рис. 2. Динамика показателей ПОЛ - АОС при варикозной болезни
Примечание: * - достоверность показателя по отношению к группе сравнения (p<0,05)
При анализе содержания тиоловых групп у пациенток с ПТФС выявлено снижение показателя общих SH-групп крови на 7,2% (p<0,05) относительно здоровых женщин. В свою очередь, свободные SH-группы достоверно не отличались от величины в группе сравнения. Однако наблюдалось уменьшение ИДТ по сравнению со здоровыми женщинами. Наиболее значимое повышение суммарных SH-групп было отмечено в первые трое суток терапии. К 8-м суткам темп прироста значительно уменьшился и составил в общем 8,4% (р1<0,01). Уровень свободных SH-групп уменьшился к третьим суткам лечения на 2,4% (p1>0,05). Но в дальнейшем произошло увеличение их концентрации в крови на 5,4% (p1<0,01) по сравнению с исходным показателем. ИДТ вырос к 3-м суткам почти на 18,2% (р1<0,05), но к окончанию терапии произошло некоторое снижение показателя и он стал равным индексу у здоровых женщин.
При варикозной болезни отмечалась тенденция к снижению общих и в меньшей мере свободных тиоловых групп по сравнению с группой сравнения. Эти изменения, больше чем в других обследованных группах, приводили к уменьшению индекса детоксикации на 15,8% (р<0,05). Снижение количества тиоловых групп является показателем уменьшения неспецифической резистентности организма [1].
В результате лечения к 8-м суткам после флебэктомии произошло увеличение концентрации общих тиоловых групп на 5,1% (p1>0,05) и снижение уровня свободных SH-групп на 12,2% (p1<0,05). Возможно, именно этот механизм дезактивации гидроперекисей имеет место при лечении варикозного расширения вен. Положительные сдвиги в системе ПОЛ-АОС привели к повышению индекса детоксикации на 15,6% (р1<0,01) на третьи сутки лечения и на 34,4% (р1<0,01) - на восьмые. При этом ИДТ стал выше, чем в контрольной группе, на 13,2% (р<0,05).
Нами не отмечено достоверного изменения ОКА в крови пациенток с посттромбофлебитическим синдромом, однако ЭКА была снижена почти на четверть. Резерв связывания альбумина (РСА) отражает долю центров альбумина, не блокированных метаболитами или токсинами. В группе пациенток с посттромбофлебитическим синдромом он был снижен на 22,7% (р<0,01). Индекс токсичности, отражающий взаимосвязь между выработкой и элиминацией токсичных продуктов, увеличился значительно, почти на 88,2% (р<0,001) по сравнению со здоровыми женщинами. Это свидетельствует о выраженном эндотоксикозе у данной категории больных.
Проводимая терапия посттромбофлебитического синдрома не оказывала значительного воздействия на общую концентрацию альбумина. ЭКА выросла к 3-м суткам на 9,6%, а к 8-м - на 20,8% (р1<0,05). Резерв связывания альбумина в начале лечения увеличился на 11,8%, а к концу терапии - на 17,6% (р1<0,05) по сравнению с исходным показателем, при этом остался ниже, чем в группе сравнения на 9,1% (p<0,05). Индекс токсичности был ниже исходного уровня на 30,2% (р1<0,01), что превышало показатель в группе сравнения на треть.
У пациенток с варикозной болезнью больше, чем в других группах, происходило накопление белковых катаболитов. Так, креатинин повысился на 14,0% (р<0,05), а мочевина - на 17,0% (р<0,05). В результате лечения с 3 суток происходило статистически значимое увеличение общего белка крови, которое к концу терапии достигло 8,1% (р1<0,05), при этом уровень его не отличался от контрольного показателя. Снижение креатинина и мочевины на 19,6% и 16,8% (р1<0,05), соответственно, также можно расценить как показатель уменьшения уровня интоксикации.
У пациенток с варикозной болезнью происходило уменьшение ОКА на 7,5% (р<0,05) и ЭКА на 25,0% (р<0,01). Резерв связывания альбумина изменялся меньше, чем при посттромбофлебитическом синдроме, - на 18,2% (р<0,01), а индекс токсичности возрастал в 1,68 раза. На 8-ые сутки после флебэктомии также изменялась связывающая способность альбумина: ОКА выросла на 7,0% (p1<0,05) и достоверно не отличалась от показателя в контрольной группе. Более значимый прирост ЭКА на 17% (р1<0,05) к 8-му дню не привел к нормализации показателя до уровня их у здоровых женщин. Полученные данные могут указывать на вовлечение альбуминовой фракции в процесс заживления послеоперационной раны.
Резерв связывания альбумина в ходе лечения также изменился и к 8-м суткам увеличился на 5,6 % (p1<0,05). Снижение индекса токсичности на 9,3% (p1<0,05) к 8-му дню не достигло уровня показателя в группе сравнения, превысив его в 1,5 раза.
Таким образом, консервативное лечение посттромбофлебитического синдрома, протекавшего в течение длительного времени, не приводит к полному устранению метаболических нарушений, о чем свидетельствуют повышенные уровни продуктов ПОЛ, сниженный резерв связывания альбумина и высокий индекс токсичности. В тоже время увеличение индекса детоксикации указывает на переход патологического процесса в стадию компенсации. Хирургическое лечение варикозной болезни нижних конечностей способствует коррекции метаболических нарушений, что свидетельствуют полученные результаты.
Рецензенты:
Мосина Л.М., д.м.н., профессор кафедры госпитальной терапии медицинского института ФГБОУ ВПО «Мордовский государственный университет им. Н. П. Огарева», г. Саранск;
Бякин С.П., д.м.н., профессор кафедры госпитальной хирургии медицинского института ФГБОУ ВПО «Мордовский государственный университет им. Н. П. Огарева», г. Саранск.



