Анализ современной научной литературы показал, что, несмотря на развитие и успехи трансплантологии, назрела необходимость создания in vitro искусственных органов, которые смогли бы стать альтернативой донорским органам [1; 6]. Для лечения терминальной стадии хронической сердечной недостаточности можно было бы использовать тканеинженерное сердце в качестве трансплантата, что позволило бы избежать назначения иммуносупрессивной терапии и существенно ускорить время ожидания донорского сердца.
Разработка методик создания подобных органов ‒ довольно длительный процесс, требующий всестороннего изучения и выборов способов получения тканеинженерных каркасов, их морфологических, механических свойств, возможности их последующей рецеллюляризации и влияния, которое данные матриксы будут оказывать на стволовые клетки [3]. В развитии современной тканевой инженерии приоритетным направлением является разработка биоинженерных каркасов и биоматериалов, применение которых позволило бы решать как этические, так и иммунологические проблемы трансплантологии. Каркас тканеинженерного органа не должен вызывать иммунного отторжения при трансплантации, а также обладать токсичностью по отношению к засеянным на него клеткам и организму-реципиенту,
Один из наиболее разработанных способов получения каркасов для тканеинженерных органов ‒ децеллюляризация, то есть удаление клеток из нативных органов, в результате чего получают близкие к нативным органам по составу и свойствам матриксы [2]. Далее вновь образованные конструкции рецеллюляризируют аутологичными стволовыми клетками. Таким образом, получают тканеинженерные органы, состоящие, как и нативные, из стромы (донорской) и паренхимы, образованной из клеток самого пациента [4; 7]. В дальнейшем донорский децеллюляризированный каркас может подвергаться биодеградации, замещаясь вновь образованным стволовыми клетками внеклеточным матриксом.
В мировой литературе имеются единичные морфологические оценочные данные, отсутствуют четкие критерии, характеризующие пригодность каркаса децеллюляризированного органа для использования в тканевой инженерии [5; 8].
Цель исследования ‒ охарактеризовать морфологические изменения внеклеточного матрикса сердца крысы в процессе децеллюляризации.
Материал и методы
Все эксперименты проводили после одобрения протокола исследования локальным этическим комитетом (Кубанский государственный медицинский университет, Россия) в лаборатории международного научно-исследовательского клинико-образовательного центра регенеративной медицины на базе Кубанского государственного медицинского университета. В работе использовали 20 взрослых крыс-самцов линии Lewis весом 230±35 г. Децеллюляризации сердца была отработана на 10 органах, 10 крыс составили группу нативного контроля.
Эксплантация органов
Перед выделением органокомплекса «легкие - сердце» животные интраперитонеально получали летальную дозу барбитуратов (150 мг/кг). Крысам вводили гепарин в дозе 100 ЕД и спустя 1 ч проводили диссекцию органов. После стернотомии выделяли органокомплекс «сердце – легкие». Органокомплекс очищали от окружающей жировой ткани, передняя и задняя полые вены отсекались, устья полых вен лигировали, аорта канюлировалась на расстоянии 2–2,5 см от сердца, лигировали плечеголовной ствол, левую общую сонную артерию, левую подключичную артерию, отсекли легкие, фиксировали в биореакторе. Начинали децеллюляризацию сердца путем перфузии сердца через аорту децеллюляризирующими растворами: фосфатным буфером с добавлением 1%-ного пенициллина-стрептомицина в течение 1,5 часов, деионизированной водой – 1,5 часа, 4%-ным водным раствором дезоксихолата натрия в комбинации с 0,002М Na2-ЭДТА ‒ 3,5 часа, фосфатным буфером с добавлением 1%-ного пенициллина-стрептомицина в течение 1 часа, свиной панкреатической ДНКазой I (2000 ЕД растворили в 200 мл фосфатного буфера с кальцием и магнием) – 2,5 часа, фосфатным буфером с добавлением 1%-ного пенициллина-стрептомицина в течение 18 часов со сменой раствора каждые 6 часов.
Морфологический анализ
Полученные образцы децеллюляризированных, нативных и рецеллюляризированных сердец фиксировали в 10%-ном нейтральном забуференном формалине, дегидратировали и заключали в парафин автоматическим методом при помощи гистопроцессора Leica TP1020 (Германия) по стандартной методике. Далее осуществляли заливку образцов в парафин с получением парафиновых блоков на модульной установке Leica EG1150H (Германия).
Парафиновые срезы толщиной 5 мкм получали при помощи ротационного микротома Leica RM2235 (Германия) и помещали на высокоадгезивные стекла с полилизиновым покрытием.
Для общегистологической оценки препараты депарафинизировали и гидратировали. Полученные срезы окрашивали гематоксилином и эозином по Ван Гизону.
Для оценки структуры децеллюляризированных и рецеллюляризированных сердечных матриксов применялся метод сканирующей электронной микроскопии. Образцы ткани фиксировали в 2,5%-ном растворе глютеральдегида (Мerk, Германия) в 0,1 М какодилатном буфере (Prolabo, Франция) в течение 2 часов. После промывания образцы были обезвожены в спиртах возрастающей концентрации, высушены в течение ночи в термостате при 37 оС и подвергнуты напылению золотом. Исследование проводилось на сканирующем электронном микроскопе JSM6490, JEOL (Япония).
Результаты исследования и их обсуждение
Для проведения децеллюляризации сердца нами был выбран детергент-энзиматический метод, позволяющий наиболее полным образом удалять клетки из тканей, но в то же время щадящий по отношению к белкам волокон внеклеточного матрикса сердца. Методика ретроградной перфузии органа через аорту и коронарные артерии действующими веществами позволяла доставить их во все без исключения отделы органа. Скорость тока жидкости не устанавливали выше физиологических значений, чтобы не произошло разрыва сосудов или пролапса аортальных клапанов и, как следствие, это не препятствовало проведению полной децеллюляризации. Отмечено, что наилучшим образом децеллюляризация проходит при использовании органов, взятых накануне процедуры и предварительно помещенных в холодильник при +4 °С. Возможно, это связано с полным прекращением всех процессов жизнедеятельности в клетках миокарда и, как следствие, уменьшением резистентности к децеллюляризирующим агентам.
В начале децеллюляризация происходила в правом желудочке, как в имеющем наименьшую толщину миокарда, затем в левом и, наконец, в верхушке и перегородке сердца, расположенных дистальнее всего по отношению к устью коронарных сосудов. В результате ткани после удаления клеток теряли характерный для нативного органа темно-красный цвет и становились прозрачными, приобретая молочно-белую окраску.
Окраска гематоксилином и эозином препаратов нативного сердца выявила продольные пучки поперечнополосатой сердечной мышечной ткани с периферически расположенными клеточными ядрами, межмышечную рыхлую соединительную ткань, многочисленные сосуды и капилляры (рис. 1А).
В препаратах децеллюляризированных сердец интактные мышечные волокна, клетки и клеточные ядра не выявлялись, однако визуализировались тончайшие, рыхло расположенные эозинофильные волокна внеклеточного матрикса сердца, которые в нативном органе окружают кардиомиоциты со всех сторон, формируя строму органа (рис. 1Б).

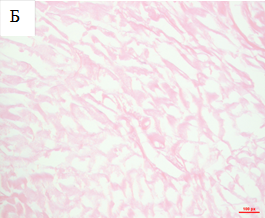
Рис. 1. Нативное (А) и децеллюляризированное (Б) сердце крысы. Гематоксилин и эозин. Увеличение: об. х40, ок х10.
Окраска пикрофуксином по Ван Гизону, тропная к соединительнотканным волокнам в нативной ткани, позволила подробнее визуализировать волокна внеклеточного матрикса, их гистоархитектонику и локализацию в миокарде. Основная часть волокон окружала несколько мышечных пучков одновременно, а также была расположена в области базальных мембран и адвентиции коронарных сосудов (рис. 2А).
В децеллюляризированной ткани внеклеточный матрикс, состоящий преимущественно из коллагена, оставался неизмененным. Оставались сохранными упорядоченная структура и преимущественно параллельное расположение коллагеновых волокон в матриксе. Отчетливо визуализировались неизмененные базальные мембраны сосудов как мелкого, так и крупного калибра. Набухания либо иных патологических изменений структуры, ориентации волокон, тинкториальных свойств соединительной ткани обнаружено не было (рис. 2Б).
![]()
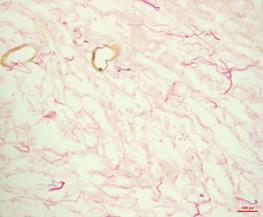
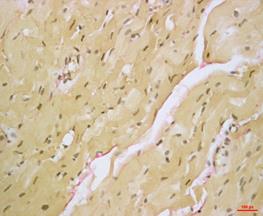
![]()
Рис. 2. Нативное (А) и децеллюляризированное (Б) сердце крысы. Пикрофуксин по Ван Гизону. Увеличение: об. х40, ок х10.
Оценка состояния внеклеточного матрикса нативного сердца крысы на ультраструктурном уровне, а также его сохранность после проведения децеллюляризации проводилась при помощи сканирующей электронной микроскопии, позволившей визуализировать на малом увеличении клетки и мышечные волокна, на увеличении в 50 000 раз ‒ тончайшие волокна внеклеточного матрикса сердца, их ход и структуру.
В образцах нативных тканей при помощи сканирующей электронной микроскопии визуализировалась структура миокарда, отмечалось наличие продольно ориентированных мышечных волокон, клеток и межклеточного вещества. В децеллюляризированных органах при сохранности пористой структуры внеклеточного матрикса клетки не обнаруживались. Выявлялись взаимопереплетенные, ветвящиеся сети волокон внеклеточного матрикса диаметром до 60-100 нм. Расстояние между отдельными волокнами достигало 300-400 нм (данные не представлены).
Выводы
В децеллюляризированном детергент-энзиматическим методом матриксе сердца крысы отсутствуют сохранные клетки и клеточные ядра, однако структура внеклеточного матрикса остается неповрежденной, что доказано применением рутинных методик гистологической окраски тканей и сканирующей электронной микроскопии. Полученные таким образом децеллюляризированные ткани могут быть использованы в качестве матриксов для создания тканеинженерного сердца.
Работа частично финансирована грантом Правительства Российской Федерации для государственной поддержки научных исследований, проводимых под руководством ведущих ученых в российских образовательных учреждениях высшего профессионального образования от 19 октября 2011 г. № 11.G34.31.0065. Работа частично выполнена на оборудовании Ведущего центра трансляционной регенеративной медицины (ACTREM) Каролинского института (Швеция).
Рецензенты:
Павлюченко И.И., д.м.н., профессор, декан фармацевтического факультета ГБОУ ВПО «КубГМУ» Минздрава России, г. Краснодар;
Каде А.Х., д.м.н., профессор, заведующий кафедрой общей и клинической патофизиологии ГБОУ ВПО «КубГМУ» Минздрава России, г. Краснодар.



