Микроволновое излучение используется в активно развиваемых в настоящее время телекоммуникационных системах: сотовых телефонах, устройствах Bluetooth, WiFi и WiMAX, поэтому изучение его влияния на биосистемы различного уровня организации является актуальной задачей [5]. Производство, передача, распределение и использование электроэнергии сопровождается воздействием на организм низкочастотных электромагнитных полей [7]. Изучению влияния электромагнитных полей, как высоких, так и низких частотных диапазонов на живые организмы посвящено достаточно большое количество работ. Однако не было проведено комплексных исследований воздействия микроволнового излучения на структуры репродуктивной системы. Имеющиеся данные носят противоречивый характер и в ряде случаев вызывают сомнения из-за отсутствия адекватных контрольных серий при проведении экспериментальных исследований.
Цель работы – исследовать эффекты воздействия низкоинтенсивного электромагнитного излучения на морфофункциональное состояние семенников белых крыс, а также некоторые биохимические показатели разных звеньев репродуктивного аппарата животных.
Материалы и методы исследования. Самцов белых крыс массой 215-240 г подвергали воздействию микроволновым излучением с частотой 42 ГГц («Явь-1-7,1»; λ = 7,1 мм) в течение 30 дней по 30 минут ежедневно. Эксперименты на животных осуществлялись в соответствии с требованиями Женевской конвенции (1985). По окончании экспериментальных воздействий в крови измеряли перекисный гемолиз эритроцитов (ПГЭ) [2], а также исходный уровень малонового диальдегида (МДА) и кинетические показатели перекисного окисления липидов (ПОЛ) в тканях медиобазального гипоталамуса и семенников [6]. Кроме того измеряли относительные массы гипофиза (мг%) и семенников (%) [8]. Уровни половых гомонов – тестостерона и лютропина – определяли методом иммуноферментного анализа. Уровень биосинтеза тестостерона оценивали посредством определения общей активности фермента биосинтеза тестостерона – Δ5-3β-гидроксистероиддегидрогеназы (ГСД) в гомогенатах семенников [3]. Срезы семенников толщиной 7 мкм изготавливали на микротоме "Microm HM - 400" (Германия). Срезы окрашивали гематоксилин-эозином. Полученные препараты изучались на универсальном микроскопе "Nu" (Германия), соединенным с цветной телевизионной камерой "Pixera" (США). Определяли продольные и поперечные диаметры семенных канальцев, количество клеток Лейдига из расчета на один каналец, а также площадь ядер средних клеток Лейдига; исследовали морфо-кинетические свойства эпидидимальных сперматозоидов [4]. Статистическую обработку полученных данных выполняли с использованием критерия Стьюдента (t), различия считали достоверными при p < 0,05 [1].
Результаты исследования и их обсуждение. Под действием электромагнитного излучения указанной частоты зафиксировано достоверное усиление перекисного гемолиза эритроцитов, в сравнении с контролем (50,2 ± 2,21 и 42,2 ± 3,49 % соответственно), что свидетельствует об усилении свободнорадикальных окислительных процессов в крови и развитии оксидативного стресса. Развитие окислительного стресса, сопряжённого с радикальным окислением ненасыщенного фосфолипида RH, можно выразить следующей схемой:
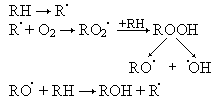
Усиление процессов свободнорадикального окисления (СРО) может означать ухудшение функционального состояния систем организма. В условиях воздействия микроволнового излучения (МВИ) в ткани семенников отмечалось усиление динамики процессов СРО. Исходный уровень МДА возрос почти на 38,5 %, по сравнению с контрольными значениями (табл. 1). Кинетические показатели ПОЛ в условиях вызванного стресса также достоверно возрастали, особенно асПОЛ.
Таблица 1
Изменение показателей липопероксидации в ткани семенников в условиях воздействия микроволнового излучения
|
Условия опыта |
n |
МДАисх, нмоль/0,05 г |
Кинетические показатели, нмоль МДА/ч |
|
|
спПОЛ |
асПОЛ |
|||
|
Контроль |
10 |
4,89 ± 0,151 |
45,97 ± 0,840 |
48,74 ± 0,702 |
|
МВИ |
10 |
6,77 ± 0,272 |
48,32 ± 2,003 |
55,21 ± 0,894 |
|
P |
|
P < 0,001 |
P > 0,05 |
P < 0,001 |
Под влиянием микроволнового излучения низкой интенсивности относительная масса семенников достоверно не изменяется, что говорит об относительно нейтральном внешнем эффекте данного стресс-фактора. Относительная масса гипофиза также менялась незначительно в результате воздействия микроволнового излучения. Таким образом, внешне данный физический стресс-фактор не оказал заметного влияния на сам гипофизарно-семенниковый комплекс. Вместе с тем, была исследована инкреторная функция гипофизарно-семенникового комплекса. В контрольной группе уровень тестостерона у животных составил величину 2,829 ± 0,0731 нг/мл. Под влиянием микроволнового излучения уровень тестостерона имел тенденцию к снижению и составил величину 2,614 ± 0,1160 нг/мл и достоверно не отличался от контрольного значения. Уровень лютропина практически не отличался от контрольного значения, что свидетельствует об отсутствии регуляторного влияния со стороны гипоталамо-гипофизарного комплекса на инкреторную функцию гонад в условиях проводимого эксперимента. В то же самое время уровни тестостерона и лютеинизирующего гормона коррелировали между собой в соответствии с коэффициентом положительной корреляции r = +0,634, что свидетельствует о слаженном механизме регуляции инкреторной функции гонад в условиях экспериментальных воздействий (табл. 2).
Таблица 2
Изменение уровней тестостерона и лютеинизирующего гормона в условиях воздействия низкоинтенсивного микроволнового излучения
|
Условия опыта |
n |
Тестостерон, нг/мл |
Лютеинизирующий гормон, мМЕ/мл |
Коэффициент корреляции, r |
|
Контроль |
6 |
2,829 ± 0,0731 |
0,425 ± 0,0538 |
+0,935 |
|
МВИ |
6 |
2,614 ± 0,1160 |
0,420 ± 0,0068 |
+0,634 |
|
P |
|
P > 0,05 |
P > 0,05 |
|
Активность фермента ГСД под влиянием микроволнового излучения достоверно не изменилась, по сравнению с контрольным показателем (214,1 ± 15,81 и 236,2 ± 29,33 у.е. соответственно), что также подтверждает факт отсутствия видимых изменений со стороны тестостеронпродуцирующей активности семенников в условиях экспериментального воздействия.
Говоря о регуляторном влиянии гипоталамуса как высшего центра регуляции вегетативных функций, следует сказать, что исходный уровень МДА в гипоталамической ткани превосходил контрольное значение незначительно (7,94 ± 0,506 и 5,45 ± 0,280 нмоль МДА / 0,05 г ткани соответственно), что можно связать с некоторым истощением системы антиоксидантной защиты в условиях многократного воздействия электромагнитного излучения. В то же самое время кинетические показатели ПОЛ, особенно аскорбатзависимое практически не отличались от соответствующих контрольных значений (рис. 1).
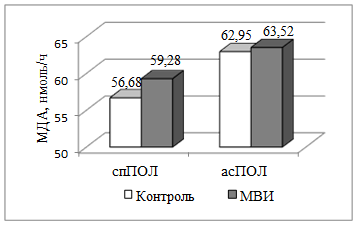
Рис. 1. Кинетические показатели ПОЛ в гипоталамической ткани в условиях экспериментального воздействия микроволнового излучения
В подтверждение всего вышесказанного были исследованы морфо-кинетические характеристики эпидидимальных сперматозоидов. К концу экспериментальных воздействий у животных отмечалось некоторое снижение общего количества эпидидимальных сперматозоидов на фоне прироста дефективных форм в 1,7 раз, в сравнении с контролем (P < 0,01). Ведущими нарушениями были облом и потеря хвоста сперматозоидов, что можно увязать с усилением колебаний клеточных структур, вызванных эффектом резонанса. Количество подвижных сперматозоидов сократилось более чем на четверть (P < 0,01); причем количество подвижных форм сократилось главным образом за счет прогрессивно-подвижных сперматозоидов, а именно за счет самых молодых высокоподвижных клеток. Указанное обстоятельство можно объяснить тем, что длительное воздействие низкоинтенсивного электромагнитного излучения постепенно истощает ресурс пролиферации, что и ведет, в конечном счете, к сокращению общего количества половых клеток на фоне прироста дефективных форм. Количество мертвых сперматозоидов возросло почти в 3 раза (табл. 3).
Таблица 3
Морфо-кинетические показатели эпидидимальных сперматозоидов в условиях воздействия микроволнового излучения
|
Показатели эпидидимальных сперматозоидов |
Контроль (n = 10) |
МВИ (n = 10) |
|
Общее количество, млн. |
50,0 ± 6,51 |
34,1 ± 1,38 |
|
Дефективные формы, % |
18,2 ± 2,22 |
30,5 ± 3,20 ** |
|
Подвижные формы, % |
81,0 ± 6,20 |
60,1 ± 2,45 ** |
|
Мертвые формы, % |
9,8 ± 0,82 |
30,2 ± 1,21 *** |
** P < 0,01; *** P < 0,001 – в сравнении с контролем.
У животных контрольной группы семенные канальцы на срезах имели округлую форму, тесно прилегая друг к другу. На каждом участке семенного канальца присутствовует 4 вида половых клеток, расположенных упорядоченно в соответствии со стадиями сперматогенного цикла. Между семенными канальцами, в интерстициальной ткани локализуются клетки Лейдига в количестве 7,3 ± 0,52 на один каналец.
В условиях воздействия микроволнового излучения наблюдалось полнокровие сосудов семенников и общее снижение половых клеток. Наблюдалось хаотичное расположение клеток сперматогенного эпителия на фоне в ряде случаев отслоения базальной мембраны. В отдельных случаях наблюдались множественные разрывы базальной мембраны, запустевание семенных канальцев, либо неравномерная высота сперматогенного эпителия. Сами семенные канальцы имели правильную округлую форму. Продольные и поперечные диаметры семенных канальцев мало отличались от таковых контрольной группы (рис. 2).
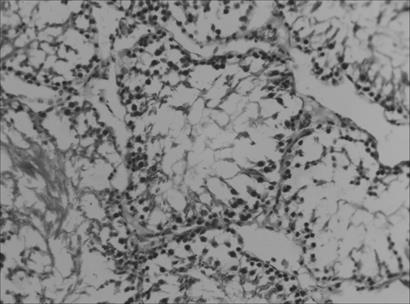
Рис. 2. Структура извитых канальцев семенников крыс в условиях воздействия микроволнового излучения. Окраска гематоксилин-эозином. Увел. 200х.
Под влиянием МВИ указанной частоты отмечался прирост общего количества клеток Лейдига на 42 % (10,4 ± 0,55 клеток), в сравнении с контролем (P < 0,001), причем пролиферация происходила за счет главным образом средних клеток. Вместе с тем, площадь средних клеток имела тенденцию к снижению, по сравнению с аналогичным показателем контрольной группы (15,3 ± 1,03 и 16,5 ± 2,31 мкм2 соответственно). Все это объясняет факт практически неотличимой от контроля тестостеронпродуцирующей активности семенников белых крыс, подвергавшихся воздействию низкоинтенсивного микроволнового излучения.
Последствия, вызываемые воздействием микроволнового излучения, позволяют поставить задачу протектирования негативных эффектов данного стресс-фактора за счёт использования таких корректирующих агентов, как антиоксиданты.
Заключение. Таким образом, под влиянием низкоинтенсивного электромагнитного излучения (микроволнового излучения) отмечалось угнетение сперматогенеза на фоне пролиферации лейдиговских клеток. Вместе с тем, можно считать, что низкоинтенсивное электромагнитное излучение миллиметрового диапазона практически не влияет на тестостеронпродуцирующую активность семенников. Однако, длительное электромагнитное излучение миллиметрового диапазона оказало негативное влияние на морфофункциональные показатели эпидидимальных сперматозоидов. Проведенное исследование позволяет сделать следующие фундаментальные выводы относительно механизма гонадотоксического действия низкоинтенсивного электромагнитного излучения:
1) под влиянием низкоинтенсивного электромагнитного излучения миллиметрового диапазона происходит изменение устойчивости мембран сперматозоидов; его действие на клеточные мембраны согласуется с теорией поддержания в мембране клеток акустоэлектрических колебаний (колебаний Фрёлиха);
2) длительное низкоинтенсивное электромагнитное излучение истощает ресурс пролиферации половых клеток;
3) за счет усиления динамики процессов СРО и эффекта резонанса возможно отрицательное влияние указанного излучения на быстро пролиферирующие и незрелые половые клетки.
Рецензенты:
Великородов А.В., д.х.н., профессор, зав. кафедрой фармацевтической химии Астраханского государственного университета, г. Астрахань;
Бойко О.В., д.м.н., профессор кафедры биохимии с курсом лабораторной диагностики ГБОУ ВПО «Астраханская государственная медицинская академия» Минздрава России, г. Астрахань.



