Одним из ведущих факторов патогенеза формирования дефектов гиалинового хряща при деструктивно-дистрофических заболеваниях является нарушение микроциркуляции с последующим развитием венозного застоя в метафизарной зоне бедренной и большеберцовой костей, приводящие к локальной ишемии, гипоксии окружающих тканей и дальнейшей кистозной перестройке субхондральной кости [3, 5].
Проблема лечения больных с дефектами суставной поверхности бедра и большеберцовой кости при деструктивно-дистрофических заболеваниях коленного сустава существует длительное время. В настоящее время наибольшее распространение получили способы пластического замещения дефектов суставной поверхности, основанные на использовании аутотрансплантатов[1, 2].
Наиболее широко применяемым из них является способ мозаичной хондропластики с использованием костно-хрящевых трансплантатов, взятых из мало- и ненагружаемых отделов сустава. Несмотря на многочисленные преимущества указанного способа, он не лишен недостатков негативно влияющих на процессы репаративногохондрогенеза и ухудшающих ближайшие и отдалённые результаты лечения. Так, отрицательными сторонами являются повышенная травматичность вмешательства, риск перелома аутотрансплантатови развития аваскулярного (асептического) некроза и кистозной перестройки в области имплантации вследствие неустраненного нарушения микроциркуляции и капиллярного стаза в глубоких слоях субхондральной кости.
Цель работы: улучшить результаты лечения больных с деструктивно-дистрофическими заболеваниями коленного сустава, сопровождающимися дефектами суставного хряща, за счет применения нового способа аутопластики суставных поверхностей.
Материалы и методы
В работе изучены результаты оперативного лечения 21 пациента, проходивших стационарное лечение в отделении травматологии и ортопедии №2 клиник Самарского государственного медицинского университета (СамГМУ) в период с 2009 по 2012 год включительно. Все больные имели деструктивно-дистрофическое заболевание коленного сустава, сопровождающееся наличием дефекта хряща коленного суставаIII-IVстепени по Оутербридж.
В качестве оперативного лечения им был применен новый способ аутопластики суставных поверхностей при деструктивно-дистрофических заболеваниях коленного сустава (Патент РФ на изобретение № 2484784, от 05 марта 2012г.). В основе операции лежит техника «классической» мозаичной хондропластики, однако дополнительно формируют несвободный мышечный лоскут, который проводят под основание костно-хрящевых аутотрансплантатов в зоне дефекта через специально созданный канал. В качестве мышечного лоскута может служить брюшко нежной мышцы.
В основе разработки нового способа оперативного лечения лежала серия экспериментов по моделированию и оперативному лечению дефектов гиалинового хряща, проведенная на базе Института экспериментальной медицины и биотехнологий Самарского государственного медицинского университета (СамГМУ). Результатом проведенной экспериментальной работы стало обоснование необходимости воздействия при восстановлении дефектов гиалинового хряща на субхондральную область метаэпифизов, как важнейшую составляющую гомеостаза хрящевой ткани.
При выполнении оперативного вмешательства все этапы выполняли в соответствии с формулой разработанного способа аутопластики.
Операцию выполняли под спинномозговой или эпидуральной анестезией. После обработки операционного поля выполняли артроскопическую диагностику по общепринятой стандартной методике. При обнаружении поврежденных внутрисуставных структур выполняли необходимые лечебные процедуры. Особое внимание уделяли оценке дефекта хряща. Выполняли дебридмент, дно дефекта зачищали по границе рубцовой ткани до видимой здоровой. Далее выполняли этап костно-хрящевой аутопластики.
Через стандартные артроскопические порталы производили забор донорских аутотрансплантатов длиной до 20 мм из малонагружаемых поверхностей мыщелков бедренной кости. При этом необходимо отметить, что забор трансплантатов из различных зон суставной поверхности через стандартные артроскопические порталы возможен при изменении положения нижней конечности. Далее через портал, соответствующий по локализации повреждению, перпендикулярно контуру субхондральной кости дефекта формировали реципиентныеканалы глубиной до 20 мм, адекватные по диаметру донорским трансплантатам и стенками между ними толщиной 2-3 мм. Затем осуществляли поочерёдную имплантацию донорских аутотрансплантатов в сформированные каналы в зоне поражения хряща так, чтобы хрящевая часть трансплантатов находилась на уровне окружающего дефект нормального суставного хряща. После размещения всех трансплантатов в области дефекта под визуальным контролем проводили несколько сгибательно-разгибательных движений, что позволяло окончательно отмоделировать противолежащие зоны суставных поверхностей.
На следующем этапе выполняли дополнительный разрез кожи по внутренней поверхности коленного сустава в проекции нежной мышцы длиной до 2-3 см. Выделяли нежную мышцу, располагающуюся наиболее медиально среди внутренних сгибателей голени. После чего формировали несвободный мышечный лоскут из брюшка нежной мышцы, укрепляли его на держалке.Через этот же доступ под контролем артроскопа формировали поперечный канал в мыщелке бедра длиной до 4 см под основание костно-хрящевых аутотрансплантатов в зоне дефекта. Затем несвободный мышечный лоскут из брюшка нежной мышцы проводили в сформированный канал мыщелка бедра с последующей трансоссальнойфиксацией. Производили ревизию, гемостаз, активное дренирование полости сустава, послойное ушивание операционных ран.
В тех случаях, когда возникали трудности при заборе и имплантации трансплантатов после артроскопии выполняли артротомию и только затем аутопластику суставной поверхности коленного сустава, соблюдая весь порядок действия.
Клинический пример
Больной П. находился на стационарном лечении в отделении травматологии и ортопедии №2 Клиник СамГМУ с 23.11.2009года по 09.12.2009 года с диагнозом: Рассекающий остеохондритправого коленного сустава (Болезнь Кенига). Правосторонний остеоартроз коленного сустава II стадии, болевой синдром. Хронический дефект хряща медиального мыщелка правого бедра III степени (по Оутербридж) (рис. 1).

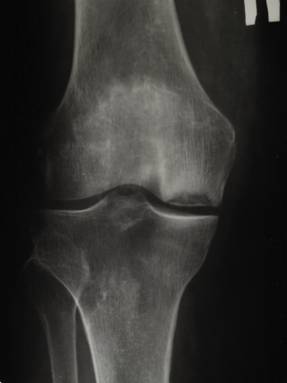
Рис. 1. Рентгенограмма правого коленного сустава пациента П. до операции (стрелкой указан дефект хряща медиального мыщелка бедра)
Проведено оперативное лечение: видеоартроскопия, дебридмент, артролиз, аутопластики суставной поверхностимедиального мыщелка правого бедра. Послеоперационный период протекал без особенностей. В послеоперационном периоде пациент выполнял лечебную физкультуру для прооперированного коленного сустава. Проведен курс магнитотерапии в виде местного воздействия на коленный сустав. Больной выписан на 16 сутки после оперативного лечения.
Послеоперационное обследование и лечение проводили в соответствии с планом диспансерного наблюдения больных с данной патологией. При очередном контрольном осмотре пациента через 12 месяцев рентгенологически определяются признаки остеоартрозаIIстадии, отмечаются признаки восстановления структурной целостности костной ткани медиального мыщелка и суставной поверхности в области оперативного вмешательства (рис. 2). Пациент перемещается самостоятельно, без дополнительных средств опоры и передвижения. Хромоты, болей, ограничения движений в суставах правой нижней конечности не выявлено.
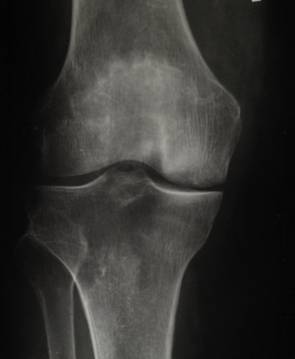
Рис. 2. Рентгенограмма правого коленного сустава пациента П.
через 12 месяцев после операции.
Результаты и обсуждения
В соответствии с принципами доказательной медицины клиническую оценку проводили на основании рекомендованных OARSI (OsteoarthritisResearchSocietyInternational) способов: в до- и послеоперационном периодах определялись WOMAC-индекс (WesternOntarioandMc-MasterUniversitiesArthroseindex), индекс Лекена, оценка по шкале Lysholm.Наиболее важные статико-динамические параметры опорно-двигательной системы при исследовании пациентов оценивали с помощью реовазографии, функциональной электромиографии, подометрии в лаборатории биомеханики клиник СамГМУ.
При оценке результатов проведенноголечения через 12 месяцев после выполнения хирургического вмешательства хороший клинический результат в виде значительного уменьшения болевого синдрома, отсутствия хромоты, увеличения объема активных и пассивных движений в коленном суставе и восстановления опорной функции конечности достигнут у всех больных. Средние показатели альгофункциональных индексов в позднем послеоперационном периоде (через 12 месяцев) были оценены как хорошие и составили: WOMAC-индекс – 9±2;индекс Лекена – 4±1; оценка по шкале Lysholm – 84±2.Также проведённый системный анализ результатов клинических, инструментальных и функциональных методов обследования показал, что использование предложенного способа аутопластики суставной поверхности обеспечило в позднем послеоперационном периоде достоверно выраженное структурно-функциональное восстановление поражённого коленного сустава и нижней конечности у большинства пациентов.
Вывод
Таким образом, применение нового способа аутопластики суставных поверхностей при деструктивно-дистрофических заболеваниях коленного сустава позволяет значительно улучшить результаты лечения больных с деструктивно-дистрофическими заболеваниями коленного сустава, сопровождающимися формированием дефекта суставного хряща.
Рецензенты:ПовелихинА.К., д.м.н., профессор кафедры травматологии, ортопедии и экстремальной хирургии ГБОУ ВПО «Самарский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г.Самара;
Чернов А.П., д.м.н., профессор кафедры травматологии, ортопедии и экстремальной хирургии ГБОУ ВПО «Самарский государственный медицинский университет»Министерства здравоохранения Российской Федерации, г.Самара.



