Сосудистый фактор как способ экспериментального инициирования деструктивно-дистрофических процессов в суставе привлекал внимание ученых с давних пор и переживает новую волну исследований в наше время. На смену грубым хирургическим вмешательствам по перевязке отдельных сосудистых стволов пришли более тонкие методы получения состояний, напоминающих рассекающий остеохондрит [9], остеоартрит [10]. В патогенезе последнего все большее внимание уделяется состоянию кровообращения, блокада микроциркуляторного русла, особенно в субхондральной кости, нарушает репаративный хондро- и остеогенез, в то время как декомпрессионно-дренирующие операции стимулируют физиологическую регенерацию [1]. Для нивелирования недостатков оперативных способов получения дегенеративной артропатии, на наш взгляд, следует обратить внимание на сердечно-сосудистые заболевания, как фактор, провоцирующий микроциркуляторную дисфункцию. В частности, при хронической сердечной недостаточности (ХСН) нарушение периферической гемодинамики должно способствовать активации катаболических процессов и структурно-функциональной перестройке суставных структур. Ожидаемые в эксперименте изменения должны отразить патогенетическую взаимосвязь между сердечно-сосудистой патологией и поражением опорно-двигательного аппарата у коморбидного пациента.
Особой ценностью всякой экспериментальной патологии в плане разработки потенциального способа лечения в будущем является возможность управления ею, т.е. исключение спонтанной обратимости и регресс дегенеративных процессов под определенным внешним воздействием. Можно предположить, что лекарственные средства, используемые в кардиологии и направленные на нормализацию гемодинамики при ХСН, способны воздействовать на капиллярное русло и в суставных структурах, особенно на ранних, доклинических этапах поражения опорно-двигательного аппарата. Это позволило бы оценить возможность обратной реорганизации тканей сустава, сравнить эффективность разных способов медикаментозной коррекции, что явилось теоретической предпосылкой к экспериментальному исследованию по использованию «сосудистых» препаратов для воздействия на суставные структуры.
На сегодняшний день, согласно Национальным рекомендациям Общества специалистов по сердечной недостаточности (ОССН), Российского кардиологического общества (РКО) и Российского научного медицинского общества терапевтов (РНМОТ) по диагностике и лечению ХСН (четвертый пересмотр) [2], к группам препаратов для лечения ХСН с доказанной способностью снижать смертность и заболеваемость, применяемым у всех больных, относятся ингибиторы ангиотензинпревращающего фактора (АПФ) либо антагонисты рецепторов ангиотензина II при непереносимости первых, бетта-адреноблокаторы (БАБ) либо ивабрадин, и антагонисты минералокортикоидных рецепторов (АМКР). Ингибиторы АПФ показаны больным ХСН вне зависимости от стадии, функционального класса, этиологии и характера процесса, они улучшают клиническую симптоматику, качество жизни, замедляют прогрессирование болезни и эффективны на самых начальных стадиях ХСН, включая бессимптомную дисфункцию ЛЖ [4]. Среди ингибиторов АПФ препаратом с наиболее доказанной эффективностью является периндоприл. Помимо гипотензивного действия, он, благодаря липофильности и высокой аффинности к тканям миокарда, эндотелию сосудов, почечным канальцам и клубочкам, обеспечивает выраженное вазопротективное действие [6]. Уменьшая эндотелиальную дисфункцию и апоптоз эндотелиальных клеток, он оказывает вазодилатирующее действие и антиоксидантные эффекты. Таким образом, периндоприл значительно улучшает состояние микроциркуляции и потенциально необходим для восстановления трофики структур сустава в условиях нарушенной периферической гемодинамики.
Среди БАБ небиволол является пролонгированным высокоселективным b1-адреноблокатором III поколения без внутренней симпатомиметической активности и обладает дополнительным вазодилататирующим действием благодаря модулированию синтеза оксида азота [8]. Ожидается, что он окажет протективное влияние на микроциркуляторное русло в тканях сустава.
Еще одной группой препаратов, прочно занявших одно из ведущих мест в лечении ХСН, являются АМКР. Спиронолактон – их классический представитель - тормозит активность альдостеронсинтетазы, снижает активность 5-альфа-редуктазы, ингибируя образование альфа-изомера альдостерона с большой минералокортикоидной активностью. Также препарат уменьшает образование свободных радикалов [7] и замедляет патологическое ремоделирование сердечно-сосудистой системы.
«Сосудистые» препараты для коррекции внутрисуставных нарушений не используются. При попытках поиска доступной информации об апробации периндоприла, небиволола и спиронолактона при дегенеративной артропатии – ни одной ссылки не найдено. Для подтверждения (или исключения) теоретически достижимого регресса начальных дистрофических изменений структур суставов нами решено провести сравнительный анализ эффективности монотерапии ХСН выше названными ингибитором АПФ, БАБ и АМКР.
Цель исследования - выявление и сравнительный анализ морфофункциональной реорганизации синовиальной мембраны (СМ) и суставного хряща (СХ) коленных суставов крыс с экспериментальной ХСН в условиях ее монотерапии периндоприлом, небивололом и спиронолактоном и при отсутствии лечения.
Материалы и методы. Исследование было выполнено на 25 половозрелых самцах крыс линии Wistar. Из них 5 животных составляли контрольную группу и находились на обычном режиме вивария в течение 28 дней. У остальных 20 животных в качестве модели ХСН был использован метод В.И. Инчиной с соавт. (2000) [5], заключающийся в ежедневном двухнедельном 20-минутном плавании крыс после подкожного введения 0,1 мл 1% раствора мезатона до глубокого утомления. Затем крысы были распределены на 4 группы по пять в каждой. Животные первой группы получали ежедневно интражелудочно (через зонд) в течение 14 дней небиволол (Небилет, «Берлин-Хеми АГ/Менарини Групп», Бельгия) в дозировке 0,49 мг/кг, второй группы – периндоприл (Престариум-А, «Лаборатория Сервье», Франция) в дозировке 0,49 мг/кг, третьей – спиронолактон (Верошпирон, «Гедеон Рихтер», Венгрия), 9,83 мг/кг. Дозировки препаратов соответствовали средним терапевтическим дозам для человека с учетом коэффициента межвидового переноса доз (5.9) по В.П. Фисенко (2000) [3]. Четвертая группа животных не получала лечение. После двухнедельного курса лечения крыс всех групп вывели из эксперимента передозировкой эфирного наркоза. После декапитации для морфологического исследования были взяты коленные суставы. Была проведена стандартная гистологическая проводка, приготовление серийных срезов толщиной 5-6 мкм осуществлялось на ротационном микротоме МПС-2. Парафиновые срезы окрашивали гематоксилином Майера и эозином. Для выявления метахромазии в межклеточном веществе суставного хряща использовали окраску 0,5% толуидиновым синим. На парафиновых срезах с использованием набора реактивов для иммуногистохимии («BioCenex», США) идентифицировали коллаген I, II, III и IV типов с помощью набора моноклональных антител, выявляли экспрессию каспазы-3, матриксной металлопротеиназы ММР-9. С помощью окуляр-микрометра МОВ-1-1.5*у 4,2 определяли толщину слоев СХ, используя окулярную сетку- вставку, подсчитывали относительную объемную плотность элементов микроциркуляторного русла. Статистическую обработку количественных данных и построение диаграмм произвели с помощью программы «MS Exсel 2007».
Результаты исследования и их обсуждение. СМ коленных суставов крыс контрольной группы состояла из 2-3 слоев уплощенных синовиоцитов и волокнистой ткани, строго упорядоченной и ориентированной вдоль оси сустава в поверхностном слое и перпендикулярно – в глубоком. Относительная объемная плотность сосудов СМ составила 12,2 ± 0,5%. Среди волокон преобладающим был коллаген III типа, в стенках артериол и венул - коллаген IV типа. Экспрессия маркера апоптоза каспазы-3 покровными клетками синовиальной оболочки составила 3,2 ± 0,3%. Гиалиновый хрящ коленного сустава крыс контрольной группы состоял из тангенциальной, переходной и радиальной зон. Тангенциальная зона была представлена 2-3 рядами хондроцитов овально-вытянутой формы и составила 12,0 ± 2,0 % от толщины всего СХ. Переходная зона содержала хондроциты округлой формы с четкими светлыми ядрами, расположенные в изогенных группах. Преобладающим белком хрящевой ткани был коллаген II типа. При окрашивании толуидиновым синим метахромазия хряща – показатель нарушения ориентационной упорядоченности гликозаминогликанов матрикса - не выявлялась. При иммуногистохимическом исследовании уровень экспрессии каспазы-3 хондроцитами СХ составил 5,0±0,05 %.
При морфологическом исследовании СМ коленных суставов крыс с моделированной ХСН, не получавших лечение, было выражено разволокнение, обнаруживались обширные участки фиброзного перерождения с атрофичными ворсинами и единичными сосудами микроциркуляции. Данная группа животных характеризовалась наиболее выраженной экспрессией ММР-9 и наименьшим содержанием коллагена III и IV типа в СМ. В СХ изменилось соотношение внутренних слоев, тангенциальная зона (регенерации хряща) была представлена единичными вакуолизированными хондроцитами, составляющими 0,5 ± 0,03% всей толщины хряща. Клетки промежуточного слоя дистрофичны, были выявлены как бесклеточные участки хряща, так и гипертрофированные изогенные группы хондроцитов. Матрикс хряща разволокнен, на наиболее нагружаемых участках суставных поверхностей появились узуры (Рис. 1). При гистохимическом исследовании СХ коленного сустава животных данной группы выявлена метахромазия в пределах клеточных территорий и интертерриториальных пространств. Экспрессия базисного для хряща коллагена II типа в данной группе была выражена минимально, однако в сравнении с контролем отмечено повышение экспрессии нехарактерных для хрящевой ткани сустава коллагенов I и IV типа. Экспрессия каспазы-3 хондроцитами СХ составила 21,4 ± 0,35 %.
Представители основных групп препаратов коррекции ХСН оказали неодинаковое влияние на структурные элементы коленных суставов крыс. Как показали наши исследования, СМ у животных с экспериментальной ХСН, получавших периндоприл (Рис. 2), была покрыта 3-4 слоями синовиоцитов, погруженных в упорядоченную структуру межклеточного вещества в виде пучков коллагеновых и эластических волокон. СМ была обильно васкуляризирована, сосуды имели неспавшийся просвет, относительная объемная плотность элементов микроциркуляторного русла составила 13,4±0,1%, что превышает аналогичный показатель всех остальных групп, в том числе контрольной (Диагр. 1). В условиях монотерапии небивололом васкуляризация СМ была выражена в меньшей степени, в субинтимальном фиброваскулярном слое отмечалось разволокнение. При лечении спиронолактоном был наименьший по сравнению с другими группами лечения показатель относительной объемной плотности сосудов (7,2±0,3%), разнонаправленность волокон присутствовала во всей СМ. Иммуногистохимические методы исследования позволили выявить наибольшую активность ММР-9 в группе лечения спиронолактоном, констатировано снижение экспрессии коллагена III и IV типов. При лечении периндоприлом в СМ, наоборот, наблюдалось сочетание низкой активности ММР-9 и выраженной экспрессии коллагена III и IV типов.
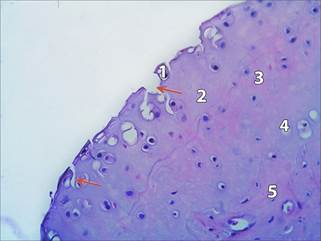
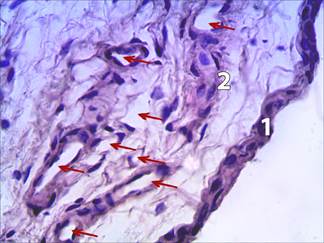
Рис 1. СХ коленного сустава крысы, не получавшей лечение. Микрофото. Окраска: гематоксилин Майера – эозин. Увеличение 300. Стрелками обозначены формирующиеся узуры.
1- вакуолизированный хондроцит тангенциальной (поверхностной) зоны, 2 - бесклеточный участок матрикса хряща, 3 – разволокнение матрикса, 4 – пустая лакуна, 5- субхондральная костная ткань.
Рис. 2. СМ коленного сустава крысы с экспериментальной ХСН, получавшей периндоприл. Окраска: гематоксилин Майера – эозин. Микрофото. Увеличение 600. Обилие сосудов микроциркуляции.
1 – синовиальная интима, включающая несколько рядов синовиоцитов, 2 – субинтимальный фиброваскулярный слой.
Стрелками обозначены элементы микроциркуляторного русла.
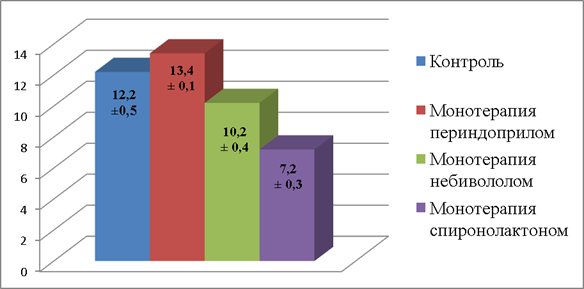
Диаграмма 1. Относительная объемная плотность сосудов синовиальной оболочки крыс контроля и групп, получавших лечение периндоприлом, небивололом, спиронолактоном (в %)
По оси абсцисс – группы исследования: контрольная, монотерапия периндоприлом, монотерапия небивололом, монотерапия спиронолактоном.
По оси ординат – показатели относительной объемной плотности сосудов в процентах. Различия достоверны при уровне значимости p≤ 0,05.
СХ крыс с экспериментальной ХСН, получавших периндоприл, состоял из четко дифференцированных тангенциальной, переходной и радиальной зон. Первая представляла собой 5-7 рядов молодых вытянутых хондроцитов с четкими ядрами, залегающих в матриксе, и составила 13,0±1,5% толщины СХ (Диагр. 2), что свидетельствует об активной регенерации.
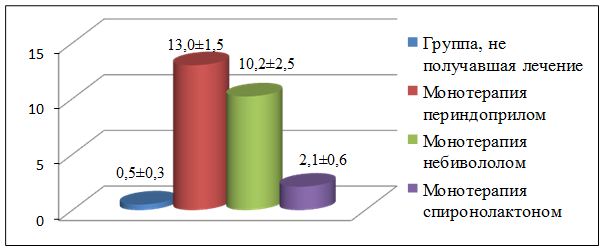
Диаграмма 2. Отношение толщины поверхностного слоя к общей толщине хряща (в %).
По оси абсцисс – группы исследования: не получавшая лечение, монотерапия периндоприлом, монотерапия небивололом, монотерапия спиронолактоном.
По оси ординат – отношение толщины поверхностного слоя к общей толщине хряща в процентах. Различия достоверны при уровне значимости p≤ 0,05.
При монотерапии небивололом хондроциты переходной зоны формировали хаотично расположенные изогенные группы, сочетающиеся с бесклеточными участками матрикса хряща, разволокнения не наблюдалось. При лечении спиронолактоном тангенциальная зона была представлена 1 рядом редких плоских клеток с тенденцией к узурации. Изогенные группы были гипертрофированы, содержали по 7-8 хондроцитов, в матриксе хряща обнаружено разволокнение. При окрашивании 0,5% толуидиновым синим метахромазия отсутствовала в группе животных, получавших периндоприл, и была максимально выражена в группе лечения спиронолактоном.
Наименьшая экспрессия коллагена II типа среди групп коррекции ХСН была выявлена нами у животных, получавших спиронолактон (Рис. 3), а наибольшая – при лечении периндоприлом. В последней группе был незначителен синтез коллагена I и IV типа. В группе небиволола и спиронолактона он возрастал, преобладая в группе лечения АМКР. Экспрессия проапоптотического маркёра каспазы-3 хондроцитами СХ была наименее выражена у животных, получавших периндоприл (Рис. 4), и наиболее выражена в группе лечения спиронолактоном (материалы представлены в таблице).
Экспрессия каспазы-3 хондроцитами
|
|
Монотерапия периндоприлом |
Монотерапия небивололом |
Монотерапия спиронолактоном |
|
Показатель экспрессии каспазы-3 (в %) |
10,6±0,5 |
12,8±0,4 |
16,3±0,1* |
*-различия достоверны при уровне значимости р≤0,05

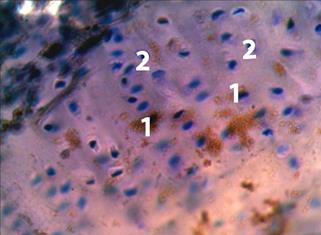
Рис 3. СХ коленного сустава крысы, получавшей спиронолактон. Экспрессия коллагена II типа. Иммуногистохимическая реакция с использованием Anti-Сollagen-II. Микрофото. Увеличение 600. 1 - хондроцит, экспрессирующий коллаген II типа (коричневое окрашивание цитоплазмы), 2 - хондроцит, не участвующий в экспрессии коллагена II типа (темно-синие ядра без коричневого окрашивания цитоплазмы).
Рис 4. СХ коленного сустава крысы, получавшей периндоприл. Экспрессия каспазы-3. Иммуногистохимическая реакция. Микрофото. Увеличение 600. 1- клетка, экспрессирующая каспазу-3 (коричневое окрашивание в цитоплазме), 2- клетка, не экспрессирующая каспазу-3 (синие ядра без коричневого окрашивания цитоплазмы).
Выводы. Данное морфологическое исследование позволило выявить, что экспериментальная ХСН может выступать в роли нетравматического фактора, инициирующего спонтанно необратимые дегенеративно-дистрофические процессы в компонентах суставов, о чем свидетельствуют данные в группе животных, не получавших лечение. Сравнительный анализ монотерапии ингибитором АПФ периндоприлом, БАБ небивололом и АМКР спиронолактоном продемонстрировал, что все указанные препараты оказывают положительное влияние на состояние тканей опорно-двигательного аппарата. При этом медикаментозная коррекция сосудистой недостаточности выявила неодинаковое воздействие лекарственных средств на суставы крыс.
Наибольшую эффективность в отношении регресса патологических изменений в СМ и СХ коленных суставов животных продемонстрировал периндоприл. Это препарат выбора из перечисленных для улучшения периферической гемодинамики и активации физиологической регенерации суставных структур. Монотерапия небивололом оказалась менее эффективной в плане обратной реорганизации компонентов суставов, спиронолактон оказал на них наименьшее влияние. Полученные данные значительно расширяют представление о патогенетических взаимосвязях между заболеваниями сердечно-сосудистой системы и опорно-двигательного аппарата и требуют дальнейших исследований на стыке морфологической, ревматологической и кардиологической дисциплин.
Рецензенты:
Чемезов С.В., д.м.н., проф., зав. кафедрой оперативной хирургии и клинической анатомии им. С.С. Михайлова ГБОУ ВПО ОрГМУ, г. Оренбург;
Стадников А.А., д.б.н., проф., зав. кафедрой гистологии, цитологии и эмбриологии ГБОУ ВПО ОрГМУ, г. Оренбург.



