Поражения печени являются широко распространенной патологией и занимают одно из ведущих мест в структуре заболеваемости и смертности населения. Причинами развития заболеваний печени могут быть вирусы, токсические вещества, гормональные и токсические нарушения, неправильное питание, хронические болезни пищеварительной системы и др. [7]. В настоящее время одним из наиболее рациональных методов лечения заболеваний печени принято считать фитотерапию, так как использование гепатопротекторов растительного происхождения обусловлено их высокой биологической активностью и относительной безвредностью [2]. Их лечебный эффект при токсических поражениях печени обусловлен преимущественно фенольными соединениями (флавоноидами, кумаринами, фенолкарбоновыми кислотами и др.), обладающими широким спектром биологического действия, включая антиоксидантные, мембраностабилизирующие, антитоксические и репаративные эффекты [4]. Исследование биологического действия фенольных соединений и растений, их содержащих, представляет научный и практический интерес. Одним из таких перспективных растительных объектов для получения гепатопротекторных средств может служить трава кориандра посевного, в которой содержатся флавоноиды, кумарины, фенолкарбоновые кислоты, микроэлементы и ряд других биологически активных веществ [6].
Цель исследования
Экспериментально обосновать целесообразность применения при токсическом гепатозе извлечений из травы кориандра посевного, содержащего флавоноиды, кумарины, фенолокислоты, витамины и ряд других биологически активных веществ.
Материал и методы исследования
Водные извлечения из травы кориандра посевного получены согласно фармакопее ХI. В состав комплекса веществ входят флавоноидные соединения (апигенин, лютеолин, кверцетин и др.), кумарины, фенолкарбоновые кислоты, органические кислоты, витамины и другие биологически активные вещества [6]. В качестве препарата сравнения использовали водные экстракты из кукурузных столбиков с рыльцами.
Суммарный комплекс веществ извлечений вводили животным в течение двух недель перорально с помощью металлического зонда в объеме 1 мл водного раствора на 100 г массы тела, что соответствовало 150 мг/кг в пересчете на сухой остаток. Эта доза экстрактов была выбрана на основе результатов анализа его токсических свойств путем определения на интактных крысах острой токсичности по Керберу [1] и гепатотоксичности по В.В. Гацура [3] с учетом рекомендаций фармакологического комитета по изучению общетоксического действия фармакологических средств [8].
Токсическая гепатопатия воспроизводилась с помощью четыреххлористого углерода [9] или спирта этилового [10]. В первом случае с этой целью на второй неделе применения извлечений (в контрольных опытах – дистиллированной воды) троекратно через день перорально металлическим зондом крысе вводили 50 % раствор четыреххлористого углерода (СCl4) в вазелиновом масле по 0,3 мл на 100 г массы животного. С целью развития алкогольной гепатопатии животным с конца первой недели опытов в течение семи дней перорально вводили 33 % раствор этанола из расчета 0,75 мл на 100 г массы тела [10].
По завершении введения извлечений животных декапитировали под легким эфирным наркозом и забирали для исследования кровь и печень. Часть печени помещали в 5 % раствор формалина. Срезы ткани печени готовили общепринятым методом заливки в парафиновые блоки, окраску проводили гематоксилин-эозином. Изучение гистологических срезов проводили с использованием светового микроскопа ЛОМО при увеличениях ×160 в проходящем свете. Снимки срезов производили на компьютеризированном микроскопе. Для морфометрических измерений использовали компьютерную программу для анализа изображений ImageJ 1.4. В сыворотке крови определяли содержание альбуминов, общего холестерина, общего билирубина, общего белка, триглицеридов с помощью автоматического биохимического анализатора ВS-120 (Minzey, Китай) со стандартным набором реактивов (Diasis, Германия). Кроме того, в сыворотке крови определяли активность аланинаминотрансферазы (АлТ), щелочной фосфатазы (ЩФ), содержание ТБК-активных продуктов общепринятыми методами.
В печени определяли содержание гликогена по реакции с фенолом после щелочного гидролиза гликогена, содержащегося в определенной навеске печени, и выражали в г/кг. Полученные результаты обрабатывались методом вариационной статистики по t-критерию стьюдента.
Результаты и их обсуждение
Исследования показали, что у интактных животных микроморфологическая картина печени в целом соответствовала нормальным вазоцитарным взаимоотношениям в строении печеночной дольки (рис.1), равно как и уровень биохимических показателей соответствовал нормальным величинам, что видно из таблиц 1 и 2.
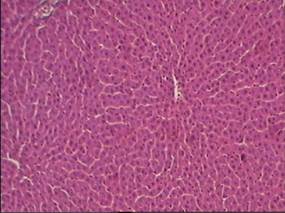
(увеличение 160)
Рис.1. Микроморфологическая картина печеночной дольки у интактных животных
Иная картина наблюдалась у животных контрольной группы с четыреххлористым и алкогольным гепатозом. На гистологических срезах печени у животных с четыреххлористым гепатозом отмечалось резкое нарушение структуры печеночных долек (рис. 2). В отдельных гепатоцитах имелась конденсация нуклеофильного вещества в сочетании с плазморексисом и плазмолизом. Цитолитические процессы были выражены во всех трех зонах ацинуса, но преимущественно – в центролобулярной зоне печеночной дольки. Эндотелиальные клетки в этих участках оказались набухшими. В средних зонах печеночных ацинусов видны были слияния пораженных паренхиматозных клеток с образованием жировых «кист», что свидетельствовало о жировой трансформации гепатоцитов. Структуризация печеночных балок нарушалась практически во всех отделах печеночной дольки. Определялась лимфоцитарная инфильтрация. Инфильтрат выходил за пределы пограничной пластинки. Формировались очаговые ступенчатые некрозы с тенденцией к образованию мостовидных портопортальных некрозов.
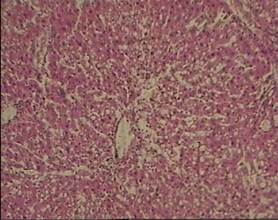
(увеличение 160)
Рис. 2. Микроморфологическая картина печеночной дольки у животных с четыреххлористым гепатозом
У животных контрольной группы с алкогольным гепатозом на гистологических срезах печени наблюдалось перивенулярное центролобулярное поражение гепатоцитов. В отдельных гепатоцитах имелась конденсация нуклеофильного вещества в сочетании с кариорексисом и плазмолизом. Некроз гепатоцитов имелся преимущественно в центре печеночных долек, в цитоплазме клеток появились вакуоли различной величины, клетки были увеличены в размерах, цитоплазма их была просветлена. Вместе с тем массового некроза клеток печени не наблюдалось. Определялось нарушение балочной структуры печеночных долек, резкая гиперемия центральных вен и кровеносных сосудов триад. Пространства Диссе были резко расширены (рис. 3). Признаков жирового стеатоза в гепатоцитах не отмечалось.
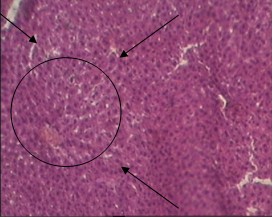
(увеличение 160)
Рис. 3. Микроморфологическая картина печеночной дольки у животных с алкогольным гепатозом
Гисто-морфологические нарушения в печени сочетались с существенными нарушениями биохимических показателей (таблица 1 и 2): у животных с четыреххлористым гепатозом в сыворотке крови отмечалось снижение содержания альбуминов, общего белка, повышение содержания общего билирубина, общего холестерина, триглицеридов, активности АлТ, щелочной фосфатазы, ТБК – активных продуктов, снижение содержания гликогена в печени; у животных с алкогольным поражением печени в сыворотке крови отмечалось снижение содержания альбуминов, общего белка, повышение содержания общего билирубина, общего холестерина, триглицеридов, активности АлТ, щелочной фосфатазы, ТБК – активных продуктов, а также снижение содержания гликогена в печени.
В группе животных с четыреххлористым гепатозом, получавших водное извлечение из кориандра, нарушение балочной структуры гепатоцитов было выражено умеренно (рис. 4). Наблюдалась некоторая декомплектация печеночных балок преимущественно в перипортальных зонах ацинуса. Количество гепатоцитов, находящихся в состоянии крупнокапельной жировой дистрофии, значительно уменьшилось по сравнению с контролем. Дистрофические изменения в большинстве других клеток ограничивались стадией мутного набухания, исчезновением зернистости, умеренным количеством клеток с признаками кариорекса и кариолизиса. Морфометрический подсчет количества жировых клеток на стандартной площади среза показал их снижение относительно контроля (100 %) до 32±4 % (Р<0,05). Расширение синусоидов, полнокровие центральных вен и сосудов портальных трактов в данной группе были выражены умеренно.
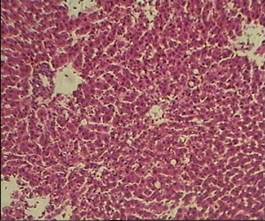
(увеличение 160)
Рис. 4. Микроморфологическая картина печеночной дольки у животных с четыреххлористым гепатозом, получавших водное извлечение кориандра посевного
В группе животных с алкогольным поражением печени, получавших извлечение из кориандра, в отличие от контрольных, нарушение балочной структуры гепатоцитов было выражено умеренно (рис. 3). Балочная структура долек в целом была сохранена. Центральные вены и кровеносные сосуды триад были без признаков гиперемии, свободны от содержимого. Определялась умеренная лимфоцитарная инфильтрация и активация пролиферативных процессов в зонах центральных вен (рис. 5). Гиперемии сосудов и диапедезных периваскулярных кровоизлияний не наблюдалось. Отмечались единичные клетки в состоянии гидропической дистрофии.
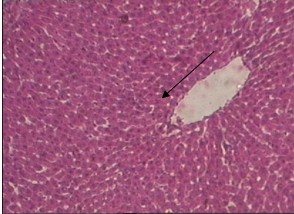
(увеличение 160)
Рис. 5. Микроморфологическая картина печеночной дольки у животных с алкогольным
гепатозом, получавших водное извлечение кориандра посевного
Степень морфологических изменений в печени в группе животных с четыреххлористым гепатозом, получавших водное извлечение из кукурузных столбиков с рыльцами, примерно соответствовало описанному выше (рис. 6). В срезах неравномерный слабый аутолиз. Неравномерное кровенаполнение синусоидных капилляров, варьирующее от слабого и слабо-умеренного кровенаполнения их до очагового полнокровия. Балочно-радиарное строение долек начинает стираться на фоне умеренно выраженной очагово-диффузной крупнокапельной жировой дистрофии гепатоцитов. Остальные печёночные клетки в состоянии умеренной мелкокапельной жировой дистрофии. Портальные тракты практически не расширены, в строме ряда из них очаговая умеренная лимфогистиоцитарная инфильтрация с единичными сегментоядерными лейкоцитами. Морфометрический подсчет количества жировых клеток на стандартной площади среза показал недостоверность различия относительно группы, получавшей извлечение из кориандра (Р3 ˃ 0,05). Изменения биохимических показателей соответствовали динамике микроморфологической картины печени.
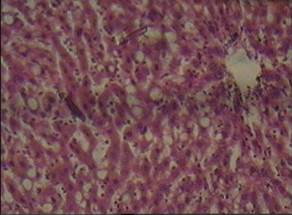
(увеличение160)
Рис. 6. Микроморфологическая картина печеночной дольки у животных с четыреххлористым гепатозом, получавших водное извлечение из кукурузных столбиков с рыльцами
В группе животных с алкогольным гепатозом, получавших в качестве лечения водное извлечение из кукурузных столбиков с рыльцами, наблюдались аналогичные контрольной группе микро-морфологические изменения в печени, однако они были выражены в меньшей степени, чем в контрольной группе, и близки к изменениям в группе животных, получавших извлечение из травы кориандра (рис. 7).
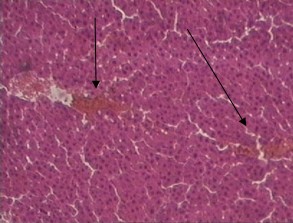
(увеличение 160)
Рис. 7. Микроморфологическая картина печеночной дольки у животных с алкогольным гепатозом, получавших извлечение из кукурузных столбиков с рыльцами
Изменения биохимических показателей в крови и печени в общем соответствовали динамике микроморфологической картины печени. Уровень гликогена в печени, содержание в крови триглицеридов, холестерина, ТБК-активных продуктов, альбуминов, активность АлТ, ЩФ у животных, получавших извлечение из кориандра, проявили тенденцию к нормализации.
Таблица 1
Влияние курсового ведения извлечений из травы кориандра посевного на биохимические показатели функционального состояния печени крыс с четыреххлористым гепатозом
|
№
|
Группы Животных |
Альбумины крови, г/л |
Общий белок крови, г/л |
Общий билирубин крови мкмоль/л |
Общий холестерин, ммоль/л |
Тригли- цериды крови, ммоль/л |
АлТ крови, мккат/л |
ЩФ крови, Ед/л |
ТБК-активные продукты плазмы крови, мкмоль/л |
Гликоген, г/кг |
|
1 |
Интактные животные n = 9 |
33,6±1,00
|
91,5±1,95 |
5,3±0,22 |
1,9±0,20
|
0,8±0,08
|
0,48± 0,150
|
226,3± 22,00 |
2,85±0,540
|
2,94± 0,242
|
|
2 |
Контрольные (гепатоз+ дист.вода) n = 7 |
32,8±0,70
Р1>0,05
|
66,6±5,10
Р1<0,01 |
34,6±1,26
Р1>0,05
|
2,7±0,35
Р1<0,05 |
2,0±0,40
Р1<0,05 |
0,99± 0,035
Р1<0,02 |
409,6± 60,50
Р1<0,05 |
7,84±0,486
Р1<0,001 |
1,53± 0,069
Р1<0,001 |
|
3 |
Получавшие водное извлечение кориандра, n = 8 |
38,8±1,20
Р1<0,05 Р2<0,01
|
80,8±1,48
Р1<0,01 Р2<0,05
|
23,5±2,53
Р1<0,001 Р2<0,02
|
1,6±0,20
Р1>0,05 Р2<0,05
|
0,5±0,06
Р1<0,05 Р2<0,01 |
0,63± 0,060
Р1>0,05 Р2<0,01
|
233,0± 28,10
Р1>0,05 Р2<0,05
|
5,83±0,140
Р1<0,001 Р2<0,01
|
5,36± 0,580
Р1<0,01 Р2<0,001
|
|
5 |
Получавшие водное извлечение кукурузных столбиков с рыльцами, n = 6 |
34,0±1,50
Р1>0,05 Р2>0,05 Р3>0,05 |
84,0±3,07
Р1>0,05 Р2<0,05 Р3>0,05 |
25,2±2,30
Р1<0,001 Р2<0,02 Р3>0,05 |
2,3±0,50
Р1>0,05 Р2>0,05 Р3>0,05 |
0,5±0,10
Р1>0,05 Р2<0,02 Р3<0,05 |
0,53± 0,128
Р1>0,05 Р2<0,02 Р3>0,05 |
242,5± 29,00
Р1>0,05 Р2<0,05 Р3>0,05 |
3,16±0,418
Р1>0,05 Р2<0,001 Р3<0,001 |
3,34± 0,173
Р1>0,05 Р2<0,001 Р3<0,02 |
Примечание:
n – количество опытов;
Р1 – вероятность различия к группе интактных животных;
Р2 – вероятность различия к контрольной группе животных;
Р3 – вероятность различия по отношению к группе животных, получавших водное извлечение из кориандра посевного.
Таблица 2
Влияние водного извлечения из травы кориандра посевного на биохимические показатели функционального состояния печени крыс при алкогольном поражении печени
|
№ n/n |
Серии опытов |
Альбу-мины крови, г/л |
Общий белок крови, г/л |
Общий билирубин крови, мкмоль/л |
Общий холесте-рин, ммоль/л |
Тригли-цериды крови, ммоль/л |
АлТ крови, мккат/л |
ЩФ крови, Ед/л
|
ТБК-активные продукты крови,мкмоль/л |
Гликоген, г/кг |
|
1 |
Интактные животные n=9 |
33,6±1,00 |
91,5±1,95 |
5,3±0,22 |
1,9± 0,020 |
0,80±0,080 |
0,48±0,050
|
226,3±22,00
|
2,85±0,540 |
2,94± 0,024
|
|
2 |
Контроль (животные с гепатопатией, получавшие дист.воду) n=9 |
30,9±0,20
Р1<0,05
|
65,7±1,91
Р1<0,001
|
14,7±0,46
Р1<0,001
|
2,1± 0,050
Р1<0,05
|
1,01±0,037
Р1<0,05
|
0,66±0,015
Р1<0,05
|
314,0±12,10
Р1<0,05
|
5,44±0,220
Р1<0,01
|
2,62± 0,0509
Р1<0,05
|
|
3 |
Животные с гепатопатией, получавшие водное извлечение кориандра n=9 |
31,3±0,06
Р1<0,05 Р2>0,05
|
68,0±1,06
Р1<0,001 Р2>0,05
|
10,5±0,18
Р1<0,001 Р2<0,001
|
1,88± 0,040
Р1>0,05 Р2<0,05
|
0,73±0,040
Р1>0,05 Р2<0,05
|
0,59±0,023
Р1<0,05 Р2<0,05
|
264,6±10,6
Р1>0,05 Р2<0,05
|
3,46±0,115
Р1>0,05 Р2<0,001
|
3,45± 0,264
Р1<0,05 Р2<0,05
|
|
4 |
Животные с гепатопатией, получавшие водное извлечение кукурузных столбиковс рыльцамиn=9 |
33,7±0,50
Р1>0,05 Р2<0,001 Р3<0,001
|
71,4±0,93
Р1<0,001 Р2<0,05 Р3>0,05
|
12,0±0,31
Р1<0,001 Р2<0,01 Р3<0,01
|
1,85± 0,080
Р1>0,05 Р2<0,05 Р3>0,05
|
0,70±0,070
Р1>0,05 Р2<0,05 Р3>0,05
|
0,65±0,019
Р1<0,05 Р2>0,05 Р3<0,05
|
270,4±16,2
Р1>0,05 Р2>0,05 Р3>0,05
|
3,55±0,127
Р1>0,05 Р2<0,001 Р3>0,05
|
3,15± 0,154
Р1>0,05 Р2<0,05 Р3>0,05
|
Примечание:
n – количество опытов;
Р1 – вероятность различия к группе интактных животных;
Р2 – вероятность различия к контрольной группе животных;
Р3 – вероятность различия по отношению к группе животных, получавших водное извлечение из кориандра посевного.
У животных, получавших извлечение из кориандра посевного в эксперименте с четыреххлористым гепатозом, содержание триглицеридов по сравнению с контролем понизилось на 75 % (p<0,01), общего билирубина на 32,1 % (p<0,02), общего холестерина на 40,8 % (p<0,05), ТБК-активных продуктов на 25,7 % (p<0,01), снизилась активность АлТ на 36,4 % (p<0,01), ЩФ – на 43,2 % (p<0,05), тогда как содержание альбуминов увеличилось на 18,3 % (p<0,01), общего белка на 21,3 % (p<0,05), а в печени повысилось содержание гликогена на 250,3 % (p<0,001). Изменения показателей у животных, получавших водное извлечение из кукурузных столбиков с рыльцами, приближались к таковым у животных, получавших извлечение из кориандра. Однако изменения в содержании гликогена в печени и активность ЩФ характеризовались меньшей степенью нормализации, чем в опытах с извлечением из кориандра.
Введение животным при курсовой алкоголизации водного извлечения кориандра посевного способствовало по сравнению с контролем понижению содержания триглицеридов на 27,7 % (p<0,05), общего билирубина на 28,6 % (p<0,001), общего холестерина на 10,5 % (p<0,05), ТБК-активных продуктов на 36,4 % (p<0,01), снижению активности АлТ на 10,6 % (p<0,05), ЩФ – на 15,7 % (p<0,05), а также повышению содержания гликогена в печени на 31,6 % (p<0,05). Снижение содержания ТБК-активных продуктов под влиянием водного извлечения из кориандра свидетельствует об уменьшении интенсивности процессов свободнорадикального окисления, что может быть связано с антиоксидантным действием фенольных соединений, содержащихся в извлечении [5].
Заключение
Динамика гистоморфологической картины печени и биохимических показателей свидетельствует, что суммарный комплекс веществ водного извлечения из травы кориандра посевного снижает глубину поражения печени при ее токсическом повреждении. Этот эффект по некоторым показателям превышает аналогичное влияние извлечений из кукурузных столбиков с рыльцами. Учитывая состав веществ комплекса водного извлечения из кориандра посевного, можно полагать о существенной роли антиоксидантного действия в его лечебном эффекте.
Рецензенты:
Погорелый В.Е., д.б.н., профессор кафедры фармакологии Пятигорского медико-фармацевтического института – филиала ГБОУ ВПО «Волгоградского государственного медицинского университета» Минздрава России, г. Пятигорск.
Попова О.И., д.фарм.н., профессор кафедры фармакогнозии Пятигорского медико-фармацевтического института – филиала ГБОУ ВПО «Волгоградского государственного медицинского университета» Минздрава России, г. Пятигорск.



