Введение
В последние десятилетия значительно возросло число оперативных вмешательств на пищеводе и желудке [4]. Это связано с ростом общей онкологической патологии и злокачественных новообразований верхних отделов пищеварительного тракта, увеличением возможности анестезиологических пособий и тем самым расширением показаний к радикальным операциям. Одним из наиболее частых видов оперативных вмешательств является гастрэктомия, как правило, заканчивающаяся наложением пищеводно-тонкокишечного анастомоза [2, 5, 6]. Проблема заживления последнего, несмотря на наличие современного шовного материала, сохраняет свою актуальность [8]. Авторами предлагается множество различных методик [1, 3], апробация которых требует проведения эксперимента, в том числе и на животных. Наиболее удобными в этом плане являются беспородные собаки [7], которые вместе с тем плохо переносят гастрэктомию. В доступной литературе мы не нашли описаний экспериментальных эзофаго-энтероанастомозов без выключения желудка из процессов пищеварения.
В связи с этим целью исследования явилось создание модели функционирующего пищеводно-тонкокишечного анастомоза у собак без гастрэктомии.
Материал и методы исследования
Пищеводно-тонкокишечный анастомоз был моделирован у 8 беспородных собак, массой тела от 6 до 11 кг. Все эксперименты выполнены в соответствии с «Правилами проведения работ с использованием экспериментальных животных», утверждёнными приказом МЗ СССР №755 от 12.08.1977 г., и основывались на положениях Хельсинской Декларации Всемирной Медицинской Ассоциации от 1964 г., дополненной в 1975, 1983, 1989 и 2000 гг. Животных выводили из опыта передозировкой наркозных средств.
Модель пищеводно-тонкокишечного анастомоза отрабатывалась в динамике, когда прослеживалось его заживление в сроки до 3 недель.
Животным под рометаровым наркозом выполняли верхнесрединную лапаротомию, до 12 см длиной. В 20-30 см от дуоденоеюнального перехода формировали 10-сантиметровую петлю тонкой кишки (будущую вставку) на сосудистой ножке, путём её пересечения. На пищевод накладывали круговые нити-держалки. Проксимальнее кардиального отдела желудка пищевод пересекали лезвием. С оральным концом тонкокишечной вставки накладывали двухрядный микрохирургический эзофагоэнтероанастомоз конец в конец (пролен 6/0 на атравматической игле 11 мм с использованием напольного операционного микроскопа фирмы «Аско») – рис. 1.
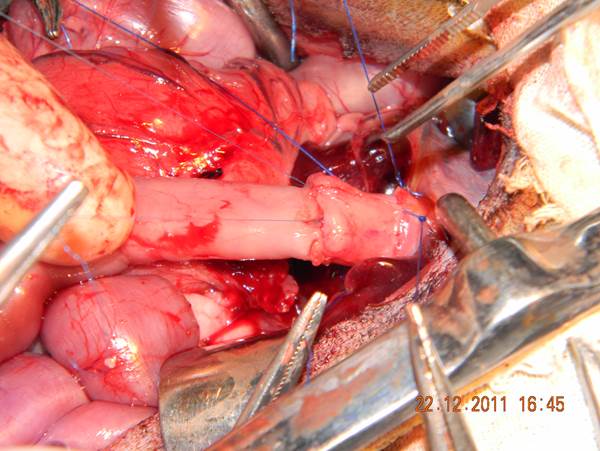
Рисунок 1. Пищеводно-тонкокишечный анастомоз.
Культю желудка погружали в его дно с помощью двух кисетных швов (викрил 4/0 на атравматической игле 15 мм). С аборальным концом тонкокишечной вставки в области верхней трети тела желудка формировали прецизионный двухрядный гастро-энтероанастомоз конец в бок (подслизистая основа и серозно-мышечный слой) непрерывной викриловой нитью 4/0 на атравматической игле 15 мм (рис. 2).
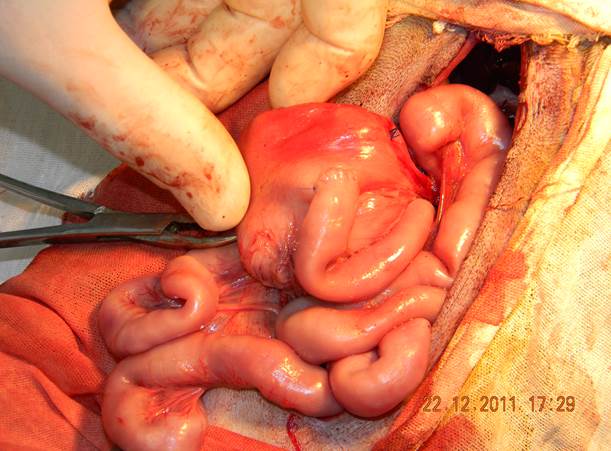
Рисунок 2. Тонкокишечно-желудочный анастомоз
Далее восстанавливали непрерывность тонкой кишки путём формирования прецизионного двухрядного анастомоза конец в конец (подслизистый и серозно-мышечный слои) между пересеченными ранее отделами непрерывным викрилом 4/0 на атравматической игле 15 мм. Накладывали отдельные швы на брыжейку тонкой кишки. Выполняли пилоропластику по Гейнеке-Микуличу. Лапаротомную рану ушивали наглухо.
Результаты и обсуждение
С начала нашего исследования мы столкнулись с серьёзными техническими трудностями из-за особенностей анатомического строения вентрикулокардиоэзофагеальной зоны у собак. Самой главной опасностью при работе на пищеводе является возможность возникновения пневмоторакса из-за того, что ножки диафрагмы вместе с тонкими, в виде плёнок, листками париетальной плевры прикрепляются к области кардии. Отделить их от пищевода без возникновения пневмоторакса невозможно, а последний, с учётом наличия единой плевральной полости у собак, может быть фатальным. Кроме этого, купол диафрагмы достигает верхушки мечевидного отростка. Поэтому для предотвращения пневмоторакса мы установили и выполняли ряд обязательных приёмов. Так, лапаротомный доступ не должен был заходить проксимальнее верхушки мечевидного отростка. Мобилизацию пищевода на 1,5-2 см от кардии мы выполняли путём наложения 3-4 зажимов на окружающую ткань (вместе с париетальной плеврой и, частично, с ножками диафрагмы) с её прошиванием Z-образным швом (викрил 4/0 на атравматической игле 15 мм). Далее в 1 см проксимальнее от предполагаемого пересечения накладывали круговые держалки на стенку пищевода вместе с ножками диафрагмы и плевральным листком, на расстоянии в 2-3 мм друг от друга (викрил 4/0 на атравматической игле 15 мм) с обязательным их завязыванием. Выбор петли тонкой кишки осуществляли в области наибольшей величины её брыжейки, в зоне достаточного кровоснабжения. В сосудистой ножке оставляли ствол третьей аркады, разветвляющийся на два ствола второй аркады и на четыре – в первой. При пересечении пищевода ориентировались на кардиальные вены, а в дальнейшем – на слизистую оболочку, которая имеет белесоватый цвет, в отличие от розовой в желудке.
Ещё одной особенностью оперативного вмешательства у собак является выраженная адгезивная способность при пересечении кишки, когда слизистая оболочка быстро выворачивается, прилипая к серозной и затрудняя визуализацию других слоёв. Для предотвращения подобного явления мы первоначально проводили поперечное рассечение лезвием только серозно-мышечного слоя проксимального конца подготовленной петли тонкой кишки. Далее отделяли с помощью зажима «Москит» более выраженный в пищеводе, чем в кишке, серозно-мышечный футляр от подслизистой основы. Накладывали подслизисто-подслизистый непрерывный шов, формируя заднюю губу, с проведением иглы в косопоперечном направлении; выполняли полное пересечение лезвием кишки. Для предотвращения резкого выворачивания слизистой оболочки кишки и быстрого её прилипания к серозной, иссекали лезвием вывернутую её часть и выполняли подслизисто-подслизистый непрерывный шов, формируя переднюю губу анастомоза, также с проведением иглы в косопоперечном направлении. С помощью зажима «Москит» отделяли серозно-мышечный футляр задней стенки пищевода. Формирование анастомоза заканчивали наложением непрерывного микрохирургического серозно-мышечного шва, с созданием сфинктероподобной структуры, путём наворачивания отделённого серозно-мышечного футляра пищевода на серозную оболочку передней стенки кишки, а затем после поворота анастомоза на 180° и на заднюю стенку.
Пилоропластику по Гейнеке-Микуличу выполняли с целью предотвращения острого расширения желудка.
Во время создания модели эзофагоэнтероанастомоза первые две собаки погибли из-за пневмоторакса. В последующих опытах животные выживали, и мы наблюдали заживление пищеводно-тонкокишечного анастомоза, который к 21 суткам представлял собой нежный тонкий рубец с плотно прилегающими друг к другу однородными слоями сшитых органов. Животным в послеоперационном периоде вводили обезболивающие препараты, антибиотики широкого спектра действия и проводили инфузионную терапию. Пить разрешали с третьих суток, а жидкую пищу собаки начинали принимать с пятых суток послеоперационного периода.
Выводы
1. Вставка петли тонкой кишки на сосудистой ножке между пищеводом и желудком является экспериментальной моделью у собак и может без гастрэктомии позволить исследователям изучать особенности различных пищеводно-тонкокишечных анастомозов.
2. Для получения положительных результатов при формировании модели эзофагоэнтероанастомоза следует учитывать особенности анатомии вентрикулокардиоэзофагеальной области у собак.
3. Моделированный пищеводно-тонкокишечный анастомоз у собак является функционирующим и позволяет изучать его свойства в динамике.
Рецензенты:
Железнов Л.М., д.м.н., профессор, заведующий кафедрой анатомии человека ГБОУ ВПО «Оренбургская государственная медицинская академия» Минздрава РФ, г. Оренбург.
Гелашвили П.А., д.м.н., профессор, заведующий кафедрой морфологии и патологии НОУ ВПО Медицинский институт «Реавиз», г. Самара.



