Введение
Имплантированный материал и живой организм при контакте подвержены взаимовлиянию, как правило, негативного характера. Имплантация сетчатых протезов запускает каскад сложных гистопатологических процессов, являющихся ответной реакцией организма на внедрение инородного тела. Реакция организма на имплантат определяется в основном его поверхностными свойствами: химическим составом, структурой и морфологией [1; 3; 4]. В связи с этим существующие способы регулирования биологических свойств медицинских изделий направлены на изменение физико-химических свойств поверхности с использованием физических, химических и физико-химических методов модифицирования. Особый интерес представляют методы модифицирования, которые позволяют изменять физико-химические, структурные и функциональные свойства поверхности, не влияя на объемные характеристики изделия, такие как прочность, эластичность, электро-физические параметры [2; 5-7]. Интересным с этой точки зрения и перспективным нам представляется наноразмерное алмазоподобное углеродное покрытие, разработанное в научно-исследовательской лаборатории «Проблемы разработки и внедрения ионно-плазменных технологий» ФГАОУ ВПО «Белгородский государственный национальный исследовательский университет». Предлагаемое покрытие имеет следующие характеристики: химическую и биологическую инертность, химическую стойкость в кислотах, щелочах, отсутствие токсических реакций, отсутствие влияния на химический состав и Рh окружающих тканей; возможность достижения сплошности покрытия при толщине порядка десятка-сотен нанометров, температуру формирования покрытия не выше 50 градусов, что не приводит к деградации свойств полимерного материала протеза; высокие адгезионные свойства к полимерной основе, отсутствие изменений рельефа поверхности после нанесения покрытия.
Цель исследования
Экспериментальное изучение ответной реакции тканей при имплантации синтетических эндопротезов, поверхность которых модифицирована наноразмерным алмазоподобным углеродным покрытием.
Материалы и методы исследований
Экспериментальные образцы эндопротезов были изготовлены в НИЛ «Проблемы разработки и внедрения ионно-плазменных технологий» ФГАОУ ВПО «Белгородский государственный национальный исследовательский университет». С этой целью на полипропиленовые эндопротезы «Эсфил легкий» (ООО «Линтекс», г. Санкт-Петербург) наносили наноразмерное алмазоподобное углеродное покрытие при помощи импульсного вакуумно-дугового распыления графитового катода, толщина покрытия р ̴ 70 нм. Экспериментальные исследования проводили на лабораторных крысах линии Vistar, массой 180–200 г, прошедших карантинный режим и не имевших внешних признаков каких-либо заболеваний. В контрольные и опытные группы вошли животные одного возраста, полученные из питомника одновременно. Разброс в группах по исходной массе не превышал 10%. Все манипуляции проводились с соблюдением принципов, изложенных в Конвенции по защите позвоночных животных, используемых для экспериментальных и других целей. Оперативные вмешательства выполнялись в асептических условиях. После обработки операционного поля экспериментальные образцы эндопротезов (1,5×1,5 см) помещались подкожно в переднюю брюшную стенку без дополнительной фиксации, для исключения влияния шовного материала на раневой процесс. В качестве контроля использовали полипропиленовый сетчатый эндопротез «Эсфил легкий» без покрытия. Животных выводили из эксперимента на 7, 21 и 180-е сутки. Изъятый материал (участок мышечно-апоневротического слоя передней брюшной стенки с эндопротезом) фиксировали иммерсионным способом в 10%-ном растворе формалина. Кусочки для гистологического исследования вырезали вертикально через все слои вместе с имплантатами и заливали в парафин по стандартной методике. Срезы толщиной 5 мкм, также изготовленные перпендикулярно поверхности брюшной стенки через все ее слои, окрашивали гематоксилином и эозином. Гистологические препараты сканировались с помощью системы для сканирования, архивирования и анализа изображений Mirax Desk (Carl Zeiss). Анализ микроскопических картин и морфометрию проводили на сканированных микропрепаратах с помощью программы Pannoramic Viewer 1.14. Средствами этой же программы, а также с помощью программы захвата изображений Fast Stone Capture производили микрофотографирование.
Результаты исследований и их обсуждение
Первоначально мы оценили характер реакции тканей при имплантации сетчатого протеза «Эсфил легкий» без покрытия. На 7-е сутки эксперимента вокруг имплантата определялась выраженная воспалительная реакция и формирование грануляционной ткани. Циркулярно вокруг элементов имплантатов формировалась зона клеточного инфильтрата шириной 150-200 мкм с нечеткими границами. В составе инфильтрата преобладали полиморфноядерные лейкоциты. Во внутренних слоях инфильтрата определялись гигантские многоядерные клетки инородных тел в количестве от 1 до 4-х по периметру одного среза участка имплантата. За пределами зоны инфильтрата определялась соединительная ткань отечного вида. На 21-е сутки эксперимента вокруг имплантата выявлено выраженное формирование грануляционной ткани и начальные признаки формирования соединительнотканной капсулы. В составе окружающего слоя грануляционной ткани, имеющего толщину около 200 мкм, в значительном количестве присутствовали элементы воспаления (полиморфноядерные лейкоциты, лимфоциты и гистиоцитарные элементы). Грануляционная ткань не имела послойного строения, свойственного поверхности раневых дефектов. Во внутренних участках клеточного инфильтрата вокруг имплантата определялись гигантские многоядерные клетки инородных тел в количестве до десяти на периметр среза одного элемента сетчатого имплантата. На 180-е сутки после имплантации сетчатого протеза «Эсфил легкий» без покрытия по всем поверхностям материала определялась сформированная соединительная ткань в виде капсулы толщиной 80-100 мкм. Структура ее была неоднородная. Превалировали участки из концентрически организованной плотной волокнистой, очагово-гиалинизированной соединительной ткани с малочисленными клетками типа фиброцитов. Однако до трети площади инкапсулирующей соединительной ткани определялась умеренно выраженная лейкоцитарная инфильтрация со значительным содержанием эозинофилов. В этих же зонах присутствовало умеренное количество кровеносных капилляров. Клетки инородных тел отсутствовали. Однако на внутренней поверхности капсулы сегментарно располагались пласты эпителиоидных гистиоцитов. Граница между инкапсулирующей соединительной тканью и окружающими участками соединительной ткани прослеживалась достаточно четко. Таким образом, при имплантации сетчатого протеза «Эсфил легкий» наблюдалась типичная последовательность изменений в зоне введения инородного тела. В интервале с 7 до 21-х суток наблюдалось нарастание гигантоклеточной реакции макрофагов на имплантат. Воспалительные изменения сохранялись достаточно долго: на 21-е сутки определялась грануляционная ткань с признаками неполной зрелости. Через 6 месяцев имплант полностью инкапсулировался. Но сформированная соединительнотканная капсула была неоднородная: участки преобладающего фиброза даже с участками гиалиноза сочетались с зонами воспалительной инфильтрации. Не наблюдалось полной интеграции структур капсулы в окружающую соединительную ткань, между ними прослеживалась четкая граница.
Далее мы оценили характер реакции при имплантации эндопротезов с наноразмерным алмазоподобным углеродным покрытием. На 7-е сутки эксперимента вокруг сетчатого протеза с наноразмерным алмазоподобным углеродным покрытием определялась равномерная зона грануляционной ткани с визуально меньшей плотностью клеточного состава в сравнении с протезом «Эсфил легкий» без покрытия. Наружная граница инфильтрата также нечеткая, но определяемая ширина составляла всего 100-150 мкм. В клеточном составе преобладали незрелые фибробласты. Инфильтрат имел рыхлое строение, не содержал характерных для грануляционной ткани капиллярных структур. Гигантские клетки инородных тел отсутствовали. Поверхность имплантата в гистологических препаратах содержала непрерывный серо-коричневый слой покрытия толщиной 1,5–2 мкм. Контакт покрытой наружной поверхности с окружающими реактивными тканями плотный, без проникновения элементов инфильтрата в толщу имплантата (рис. 1).
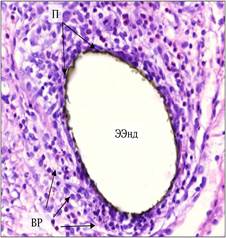
Рис. 1. Реакция соединительной ткани на экспериментальный образец эндопротеза с наноразмерным алмазоподобным углеродным покрытием (ЭЭнд) на 7-е сутки после имплантации: на поверхности протеза непрерывный слой покрытия (П), зона воспалительной реакции (ВР) узкая, с умеренной плотностью клеточного состава. Окраска гематоксилином и эозином. Микрофото. Х400
На 21-е сутки после имплантации экспериментального образца эндопротеза вокруг него сформировался непрерывный слой грануляционной ткани шириной 100-160 мкм. Контакт с окружающими реактивными тканями плотный. В клеточном составе грануляционной ткани преобладают фибробласты, лейкоциты в равной пропорции представлены полимофноядерными элементами и малыми лимфоцитами. На этом сроке уже заметны процессы созревания грануляционной ткани в фиброзную, что проявлялось наличием четко различимых равномерно распределенных участков тонковолокнистого строения и зон гомогенного оксифильного межклеточного матрикса. Гигантские клетки инородных тел отсутствовали (рис. 2).
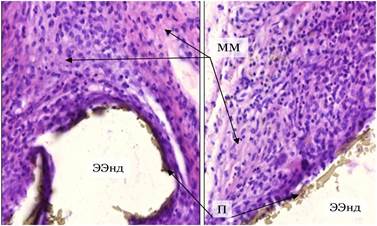
Рис. 2. Морфологические изменения в зоне имплантации эндопротеза с наноразмерным алмазоподобным углеродным покрытием (Ээнд) на 21-е сутки: в клеточном составе преобладают фибробластические элементы, четко определяются зоны формирования межклеточного матрикса (ММ), покрытие имплантата (П) участками фрагментировано, но определяется по всей площади. Окраска гематоксилином и эозином. Микрофото. Х400
Через 6 месяцев после имплантации эндопротеза с наноразмерным алмазоподобным углеродным покрытием выявлены существенные особенности в сравнении с материалом без покрытия. Общая картина имела вид полной инкапсуляции материала с капсулой, структурно полностью интегрированной в окружающую соединительную ткань. Структура капсулы была представлена 5-10 компактными слоями коллагеновых волокон, между которыми равномерно распределено небольшое число фиброцитов. Элементы воспалительного инфильтрата, эпителиодиные гистиоциты на внутренней поверхности капсулы, гигантские клетки инородных тел отсутствовали. Внутренние слои капсулы имели концентрическую ориентацию вокруг сетчатых структур имплантата, снаружи плавно переходили в пучки коллагеновых волокон подкожной соединительной ткани. Толщина капсулы была меньше и составляла 60-70 мкм (рис. 3).
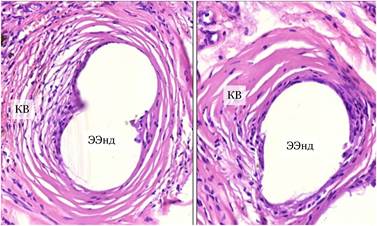
Рис. 3. Структура соединительнотканной капсулы вокруг эндопротеза с наноразмерным углеродным покрытием (ЭЭнд): концентрические малоклеточные слои коллагеновых волокон (КВ) с плавным переходом в окружающую соединительную ткань, отсутствие воспалительных изменений и гигантоклеточной реакции на имплантат. Окраска гематоксилином и эозином. Микрофото. Х400
Таким образом, определялись значительные отличия в тканевой реакции при имплантации сетчатых имплантов с наноразмерным алмазоподобным углеродным покрытием. Заметные отличия определялись уже на 7-е сутки после имплантации и проявлялись они более ранним формированием фибробластического компонента в грануляционной ткани. На 21-е сутки в клеточном составе преобладают фибробласты с морфологическими признаками функционально активных форм. Одним из самых существенных отличий являлось отсутствие на всех сроках гигантоклеточной трансформации макрофагов и формирования клеток инородных тел. Через 6 месяцев после имплантации протезов с наноразмерным алмазоподобным углеродным покрытием выявлена полная биоинтеграция импланта в подкожную соединительную ткань в виде ареактивной инкапсуляции соединительной тканью, непосредственно связанной с окружающими структурами. Воспалительных и других реактивных изменений нет. При этом вокруг поверхности импланта располагалась уже сформированная практически бессосудистая плотная фиброзная ткань.
Заключение
Нами впервые созданы синтетические эндопротезы для пластики грыж передней брюшной стенки с наноразмерным алмазоподобным углеродным покрытием (Патент РФ № 98906, «Протез для пластики грыж передней брюшной стенки») и проведены экспериментальные исследования тканевой реакции при их имплантации. Результаты исследований свидетельствуют, что синтетические эндопротезы с наноразмерным алмазоподобным углеродным покрытием в сопоставлении с исходным составом сетчатых полимерных имплантатов из полипропилена обладают большей биосовместимостью и лучшей биоинтеграцией в окружающую соединительную ткань.
Рецензенты:
Афанасьев Ю.И., д.м.н., профессор, заведующий кафедрой внутренних болезней № 1 медицинского института ФГАОУ ВПО «Белгородский государственный национальный исследовательский университет», г. Белгород.
Николаев С.Б., д.м.н., кафедра хирургических болезней ФПМО медицинского института ФГАОУ ВПО «Белгородский государственный национальный исследовательский университет», г. Белгород.



