Введение
До настоящего времени распространенный перитонит остается одним из самых частых и грозных осложнений в абдоминальной хирургии. Несмотря на постоянное совершенствование методов лечения перитонита, результаты его нельзя признать утешительными. Средние показатели летальности при распространенном перитоните удерживаются на уровне 20-30%, достигая при наиболее тяжелых его формах 80-90% [6]. Основной причиной летальности является абдоминальный сепсис с тяжелой полиорганной недостаточностью и синдромом интраабдоминальной гипертензии [1]. Развитие системной воспалительной реакции при перитоните сопровождается активацией целого ряда факторов, влияющих на характер течения и исход заболевания, важное значение среди которых имеют активация процессов свободнорадикального окисления, нарушение синтеза оксида азота, выброс значительного количества медиаторов воспаления, повреждение сосудистого эндотелия, нарушения микроциркуляции [5, 1].
Наиболее актуальным в настоящее время является внедрение эффективных и патогенетически обоснованных методов антиоксидантной терапии и иммунокоррекции при распространенном перитоните. В этой связи определенный интерес может представлять изучение возможности коррекции системной воспалительной реакции при перитоните путем применения антиоксиданта из лиственницы – дигидрокверцетина (3,5,7,3',4'-пента-гидроксифлаванон), а также его комбинации с иммуномодулятором Галавит® в качестве дополнения к стандартной терапии при распространенном перитоните.
В связи с вышеизложенным, целью исследования явилось изучение фармакологической эффективности применения дигидрокверцетина в сравнении с препаратом Мексикор®, а также их комбинаций с иммуномодулятором при экспериментальном распространенном перитоните.
Материалы и методы исследования
Исследование выполнено на половозрелых крысах-самцах линии «Wistar», массой тела 200-250 г. Эксперимент проведен в соответствии с Национальным стандартом Российской Федерации ГОСТ Р 53434-2009 «Принципы надлежащей лабораторной практики», Приказом Министерства здравоохранения и социального развития Российской Федерации от 23 августа 2010 г. № 708н «Об утверждении Правил лабораторной практики», «Руководством по экспериментальному (доклиническому) изучению новых фармакологических веществ» под общей ред. чл.-корр. РАМН, профессора Р.У. Хабриева (2005).
Нами была использована модель распространенного гнойного перитонита (РГП) [4] с синдромом интраабдоминальной гипертензии (ИАГ) на крысах [7], с помощью которой изучалась эффективность применения природного антиоксиданта флавоноида дигидрокверцетина (ДГК), антиоксидантного препарата Мексикор®, иммуномодулятора Галавит®, а также комбинаций: ДГК+Галавит® и Мексикор®+Галавит®, в коррекции нарушений оксидантно-антиоксидантного и цитокинового статуса, NО-продуцирующей функции эндотелия, а также уровня микроциркуляции в стенке тонкой кишки и морфологических изменений внутренних органов у лабораторных животных.
В качестве средства для наркоза использовали хлоралгидрат, который вводили внутрибрюшинно в дозе 300 мг/кг массы животного. Под наркозом с соблюдением правил асептики и антисептики крысам выполнялась срединная лапаротомия, распространенный перитонит вызывался путем внутрибрюшного введения 10 % каловой взвеси крысы, которая вводилась в разных направлениях в объеме 0,5 мл на 100 г массы животного [4]. Далее создавалась дубликатура в 1 см апоневроза передней брюшной стенки, которая фиксировалась П-образными швами с последующей фиксацией узловыми швами. Через 48 часов от начала эксперимента в контрольной и исследуемых группах выполнялась повторная операция – релапаротомия, санация брюшной полости антисептическим раствором (0,02% раствор фурациллина), устранение дубликатуры передней брюшной стенки путем закрытия лапаротомной раны «край в край» [7].
Дозы исследуемых препаратов в опытных группах рассчитывались, исходя из средней терапевтической дозы для человека, с учетом коэффициента пересчета доз с человека на животных, согласно «Руководству по экспериментальному (доклиническому) изучению новых фармакологических веществ» (2005).
В настоящем экспериментальном исследовании фармакологические эффекты дигидрокверцетина (3,5,7,3',4'-пента-гидроксифлаванон) (антиоксиданты из лиственницы «Дигидрокверцетин (Таксифолин)» СГР № RU.77.99.11.003.Е.018404.05.11) производства ООО «Таксифолия», Россия, изучались, исходя из суточной дозы потребления 90 мг для человека массой 70 кг, которая в результате переноса доз на крысу составила 7,7 мг/кг/сут. Так как растворимость дигидрокверцетина в воде и водосодержащих продуктах недостаточна для осуществления точного дозирования препарата с целью достижения необходимой биодоступности, то введение дигидрокверцетина лабораторным животным осуществлялось внутрижелудочно в виде 20% раствора на основе разрешенного к применению в пищевой промышленности растворителе – глицерине (ТУ 9197-012-66975341-2010 «Сырье для производства БАД к пище и пищевой промышленности «Флавомикс-G»).
Эффективность антиоксидантного препарата Мексикор® (2-этил-6-метил-3-оксипиридина сукцинат) ООО «ЭкоФармИнвест» производства Государственный завод медицинских препаратов ФГУП, Россия, исследовалась при внутримышечном введении лабораторным животным в дозе 60 мг/кг/сут, исходя из максимальной суточной дозы 800 мг для человека массой 70 кг.
При изучении эффективности иммуномодулятора Галавит® (5-амино-1,2,3,4-тетрагидрофталазин-1,4-диона натриевая соль) производства ЗАО «Центр современной медицины «МЕДИКОР», Россия, препарат вводился животным внутримышечно в дозе 8,6 мг/кг/сут, исходя из средней терапевтической суточной дозы 100 мг для человека массой 70 кг.
В случае комбинированного лечения препараты вводились в тех же дозах, что и при монотерапии.
В хронических экспериментах при моделировании распространенного перитонита исследуемые препараты вводились в соответствующих дозах один раз в сутки в течение 10 дней.
Измерение микроциркуляции в стенке тонкой кишки производилось с помощью лазерного доплеровского флуометра (ЛДФ) фирмы «Biopac Systems, Inc.» МР-100 с датчиком TSD–144 и программы Acqknowledge 3.8.1. Измерения производились в 6 точках на расстоянии 1 см, 2 см, 3 см, 4 см, 5 см и 7 см от илеоцекального угла в стенке тонкой кишки. Показатели микроциркуляции имели вид ЛДФ-грамм и выражались в перфузионных единицах. Запись кривой уровня микроциркуляции проводили в течение 30 сек. в каждой точке, затем из полученных значений выводили средние, которые вносили в Протокол исследования.
Выраженность перекисного окисления липидов в крови животных оценивали по содержанию малонового диальдегида, активности каталазы, супероксиддисмутазы и общей антиокислительной активности сыворотки крови крыс. Уровень метаболитов оксида азота (суммарную концентрацию нитратов и нитритов, NOx) определяли колориметрическим методом по развитию окраски в реакции диазотирования нитритом сульфаниламида, входящим в состав реактива Грисса. Количественное содержание ИЛ-6, ФНО-α определяли с помощью ИФА наборов для крыс («Rat TNF-α Platinum ELISA» и «Rat IL-6 Platinum ELISA» фирмы «eBioscience», Австрия).
Для морфологического подтверждения развития моделируемой патологии и в комплексной оценке эффективности препаратов проводили гистологическое исследование тонкого и толстого кишечника, печени, почек, легкого и селезенки интактных, контрольных крыс и крыс, получавших исследуемые препараты. С этой целью кусочки данных органов фиксировали в растворе 10% нейтрального формалина и заливали в парафин по общепринятым методикам. Парафиновые срезы толщиной 8-10 мкм окрашивали гематоксилином и эозином.
Достоверность наблюдавшихся при действии исследованных препаратов изменений параметров, как абсолютных, так и в процентах от исходного уровня, определяли путем расчета средней арифметической (М), ошибки средней арифметической (±m) и оценки достоверности различий сравниваемых параметров между группами с использованием t-test для групп с разными дисперсиями, достоверными считались различия сравниваемых параметров при р<0,05.
Результаты исследования и их обсуждение
Подтверждением литературных данных явились результаты наших собственных биохимических исследований по изучению показателей оксидантно-антиоксидантного и цитокинового статуса, а также выявлению NO-продуцирующей функции организма у лабораторных животных.
Получено, что моделирование экспериментального распространенного перитонита вызывает активацию процессов свободнорадикального окисления, угнетение системы антиоксидантной защиты, повышение уровней провоспалительных цитокинов, нарушение синтеза оксида азота. Так, в сыворотке крови нелеченных животных отмечается достоверное повышение концентрации малонового диальдегида. Сравнительное изучение влияния исследуемых препаратов и их комбинаций выявило значительное снижение концентрации МДА на фоне введения дигидрокверцетина, препарата Мексикор® на протяжении всего эксперимента в сравнении с контрольной группой без достижения уровня интактных животных к 10-м суткам исследования. В то время как наиболее выраженный сопоставимый эффект снижения продуктов перекисного окисления липидов до уровня интактных животных, на примере МДА, получен на фоне лечения комбинацией дигидрокверцетина с препаратом Галавит® и комбинацией препарата Мексикор® с препаратом Галавит®.
Определение антиокислительного потенциала включало исследование активности ферментов антиоксидантной защиты – супероксиддисмутазы, каталазы и общей антиокислительной активности. Об угнетении антиоксидантной системы защиты при моделировании распространенного перитонита свидетельствовало снижение активности СОД, каталазы и ОАА относительно интактной группы животных. При введении ДГК и препарата Мексикор® отмечалось с третьих суток эксперимента достоверное повышение СОД относительно контрольной группы, а на 7-е и 10-е сутки имело место превышение значений интактной группы (р<0,05). Использование комбинаций ДГК+Галавит® и Мексикор®+Галавит® приводило к более раннему повышению уровня СОД, начиная со вторых суток и на всем протяжении эксперимента, относительно контрольной группы и достоверному повышению показателя на 5-е, 7-е и 10-е сутки – от интактных крыс.
На фоне введения ДГК, препарата Мексикор®, а также комбинаций ДГК+Галавит® и Мексикор®+Галавит® активировалась антиоксидантная система защиты, что подтверждалось статистически достоверным повышением активности каталазы в сыворотке крови крыс от уровня, определяемого не только в контрольной группе животных, но и повышением относительно интактных крыс (р<0,05).
Изучение состояния ОАА выявило, что в условиях патологии чрезмерная активация процессов свободнорадикального окисления приводит к стойкому снижению показателя в 2 раза на протяжении всего эксперимента. На фоне введения дигидрокверцетина и препарата Мексикор®, а также комбинаций ДГК+Галавит® и Мексикор®+Галавит® получено статистически достоверное повышение показателя ОАА относительно контрольной группы на всем протяжении эксперимента, а, начиная с 5-х суток, ОАА практически не отличался от значений интактной группы. Следует отметить, что использование комбинации ДГК+Галавит® приводит к более раннему повышению значений ОАА к уровню интактных животных, начиная уже с 3-х суток исследования.
При изучении влияния монотерапии препаратом Галавит® и препаратом Мексикор® на уровень провоспалительных цитокинов нами было получено снижение ИЛ-6 (начиная с 4-х и 5-х суток, соответственно) и ФНО-α (начиная с 3-х и 4-х суток, соответственно) относительно контрольной группы животных, сопоставимое для исследуемых групп. При комбинированном применении дигидрокверцетина и препарата Мексикор® с препаратом Галавит® отмечалось более эффективное снижение цитокинов относительно контрольных животных, начиная со 2-х суток исследования, и, что особо важно, достижение значений интактных животных в отношении ИЛ-6 и ФНО-α в исследуемых комбинациях достигалось одновременно на 7-е и 10-е сутки. При этом считаем примечательным наблюдаемый на фоне монотерапии дигидрокверцетином эффект аналогичный комбинациям, выражающийся в снижении ИЛ-6 в 6 раз, а ФНО-α – в 3,7 раза от уровня контрольной группы на 10-е сутки.
Изучив динамику концентрации конечных стабильных метаболитов оксида азота, в контрольной группе мы подтвердили нарушение NO-продуцирующей функции эндотелия, выражающееся в повышении концентрации конечных стабильных метаболитов оксида азота NOx с 1-х по 10-е сутки эксперимента по сравнению с интактной группой животных. Заслуживает внимания тот факт, что все исследуемые препараты: ДГК, Мексикор®, Галавит® и их комбинации в разной степени достоверно снижали концентрацию NOx относительно контрольной группы, что свидетельствует об их эндотелиопротективных свойствах. При этом наиболее выраженный эффект демонстрировали ДГК, комбинации препаратов ДГК+ Галавит® и Мексикор®+Галавит®, восстанавливая концентрацию NOx до уровня интактной группы, начиная с 5-х по 10-е сутки исследования. В то время как под действием монотерапии препаратом Мексикор® уровень интактных крыс достигался лишь на 10-е сутки, а на фоне введения препарата Галавит® целевые значения интактной группы в ходе эксперимента достигнуты не были.
Таким образом, при распространенном перитоните и синдроме кишечной недостаточности, в отличие от медленно текущей инфекции или хронической эндотоксиновой агрессии, характеризуется избыточной продукцией оксида азота (NO), вследствие чего эндотелий не реагирует на вазопрессорные агенты: эндотоксин и опосредованный им цитокинокинез инициируют неконтролируемое высвобождение NO, а фактор некроза опухоли (ФНО-α), усугубляя эти процессы, способствует вазоплегии [3].
При распространенном перитоните, синдроме кишечной недостаточности и острой эндотоксиновой агрессии макрофаги вследствие мощной эндотоксин-стимулированной активации индуцибельной NO-синтетазы (iNOS) вырабатывают избыточное количество оксида азота, который, воздействуя на метаболизм эндотелия, ингибирует в нем три жизненно важных группы ферментов: митохондриальной дыхательной цепи, цикла Кребса и синтеза ДНК, в результате чего эндотелиоцит может погибнуть вследствие дефицита энергии [10].
Основная барьерная роль эндотелия состоит в поддержании гомеостаза путем сложной активной регуляции равновесного состояния противоположных процессов, осуществляющие наиболее важные функции: тонуса сосудов, анатомической архитектоники сосудов, гомеостаза, местного иммунитета. Различные субстанции, вырабатываемые эндотелиоцитами независимо от органной принадлежности, помимо контролирующей сердечно-сосудистую систему функции, одновременно являются существенной частью иммунной системы, выполняют пилотную роль в инициации и развитии защитных и повреждающих воспалительных ответов [9].
В этой связи эндотелиальная дисфункция как проявление дисбаланса основных вышеперечисленных функций эндотелия начинается практически с первых часов острого хирургического заболевания органов брюшной полости, развития острой эндотоксиновой агрессии и синдрома кишечной недостаточности и проявляется в виде нарушений микроциркуляции в стенке кишки с последующим парезом кишечника, растяжением кишечных петель, повышением внутрикишечного давления, нарушением всасывания жидкости и газов, образованием продуктов незавершенного метаболизма, прогрессирующей гипоксией кишечной стенки [2].
При исследовании микроциркуляции в стенке тонкой кишки в наших экспериментах были выявлены значительные нарушения кровотока, сопровождающиеся достоверным снижением показателей микроциркуляции на 2, 3, 4, 5, 7 и 10 сутки исследования по сравнению с интактной группой животных. К 10-м суткам не происходило полного восстановления микроциркуляции, значения которой оставались достоверно ниже на 42,3 % относительно группы интактных животных (рисунок 1).
Дигидрокверцетин в качестве монотерапии, комбинация препаратов ДГК+Галавит® при моделировании распространенного перитонита у крыс способствовали эффективному повышению уровня регионарного кровотока в стенке тонкой кишки относительно контрольной группы животных. Введение экспериментальным животным комбинации способствовало более раннему (начиная с 5-х суток) восстановлению микроциркуляции в стенке тонкой кишки до уровня интактных животных (р>0,05) по сравнению с монотерапией ДГК, в которой уровень интактных животных достигался на 10-е сутки (рисунок 1).
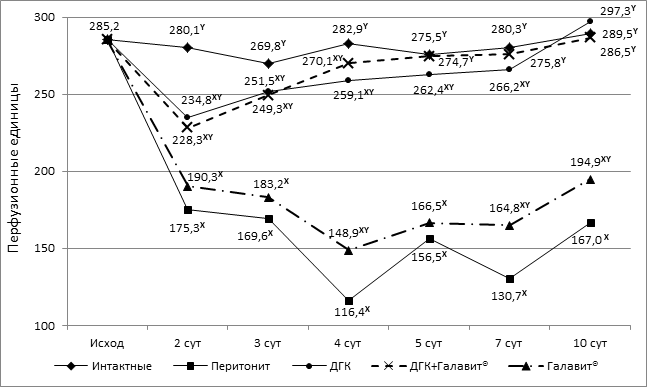
Рисунок 1. Динамика микроциркуляции в стенке тонкой кишки крыс, получавших дигидрокверцетин (7,7 мг/кг), Галавит® (8,6 мг/кг) и комбинацию дигидрокверцетин (7,7 мг/кг)+Галавит® (8,6 мг/кг) при экспериментальном перитоните, в абсолютных значениях.
Примечание: X – при р<0,05 в сравнении с интактной группой; Y – при р<0,05 в сравнении с контрольной группой.
Комбинация препаратов Мексикор®+Галавит®, а также монотерапия препаратом Мексикор® и в меньшей степени монотерапия препаратом Галавит® при моделировании распространенного перитонита у крыс приводит к эффективному повышению уровня регионарного кровотока в стенке тонкой кишки по сравнению с контрольной группой. Введение экспериментальным животным комбинации способствовало (начиная с 7-х суток) восстановлению микроциркуляции до уровня интактных животных (р>0,05) в отличие от монотерапии препаратом Мексикор® и препаратом Галавит®, на фоне введения которых уровень интактных животных достигнут не был (рисунок 2).
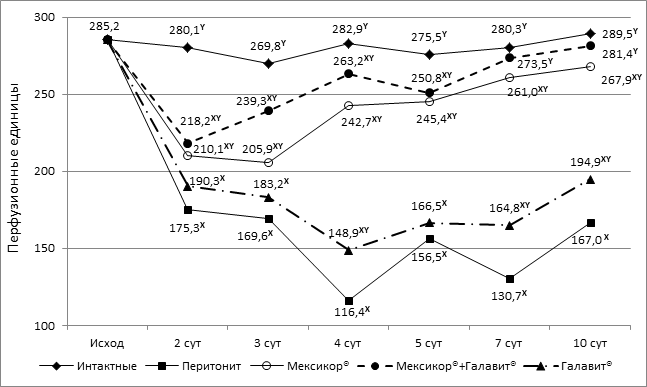
Рисунок 2. Динамика микроциркуляции в стенке тонкой кишки крыс, получавших Мексикор® (60 мг/кг), Галавит® (8,6 мг/кг) и комбинацию Мексикор® (60 мг/кг)+Галавит® (8,6 мг/кг) при экспериментальном перитоните, в абсолютных значениях.
Примечание: X – при р<0,05 в сравнении с интактной группой; Y – при р<0,05 в сравнении с контрольной группой.
В наших экспериментах показано, что нарушения микроциркуляции возникали уже на реактивной стадии перитонита и сопровождались дистрофическими изменениями тонкой кишки и других органов-мишеней, достигшими в токсической фазе максимальной выраженности.
Морфологические исследования подтвердили высокую органопротективную активность не только комбинаций ДГК+Галавит®, Мексикор®+Галавит®, но и монотерапии дигидрокверцетином и препаратом Мексикор® в сторону регресса гистоморфологических изменений в париетальной брюшине, в тонком и толстом кишечнике, печени, почках и легких, вызванных моделированием распространенного перитонита. Отмечается, что нарушения кровообращения, дистрофические и воспалительные изменения являются менее выраженными и кратковременными, обнаруживаемыми лишь в течение первых 2-х суток эксперимента.
Важно отметить, что на фоне введения дигидрокверцетина и комбинации ДГК+Галавит® наблюдается выраженная гиперплазия лимфоидной ткани в кишечнике и селезенке, характерная для морфологической картины при монотерапии иммуномодулятором Галавит®, что, по мнению ряда авторов, может быть обусловлено дополнительным иммуномодулирующим действием дигидрокверцетина [8].
Одним из основных и наиболее информативных критериев, характеризующих эффективность лечения, является оценка уровня летальности в ходе эксперимента. Нами был проведен анализ данного показателя в контрольной группе и во всех группах, получавших лечение в соответствии с дизайном исследования. Из полученного материала видно, что фармакологическая коррекция распространенного перитонита препаратом Галавит® привела к снижению показателя общей летальности на 16% относительно контрольной группы животных, в то время как эффективность монотерапии препаратом Мексикор® была несколько выше, что подтверждалось снижением данного показателя на 22%. Комбинированное использование препаратов Мексикор®+Галавит® значительно сократило количество павших животных и, тем самым, снизило летальность на 28%, в то время как монотерапия ДГК привела к аналогичному результату, снизив общую летальность на 30%. Преимущество комбинации ДГК+Галавит® подтвердилось максимальным снижением общей летальности на 36% относительно контрольной группы животных. Таким образом, представляется возможным расположить исследуемые препараты и их комбинации по степени снижения общей летальности в следующем порядке: ДГК+Галавит® < ДГК < Мексикор®+Галавит® < Мексикор® < Галавит®.
Согласно современным фундаментальным исследованиям, у больных с тяжелым распространенным перитонитом ведущим механизмом патофизиологических нарушений является сочетание воспаления, гипоксии и дисбаланса свободнорадикальных механизмов. Возникающий дисбаланс усиливает деструктивные процессы в паренхиматозных органах и, как следствие, приводит к прогрессированию полиорганной недостаточности. Поэтому как основную цель интенсивной терапии тяжелой инфекции целесообразно рассматривать оптимизацию транспорта кислорода и состояния антиоксидантной системы. Также известно, что во всех стадиях перитонит протекает на фоне иммунодефицита, а в терминальной стадии (полиорганной недостаточности) этот дефицит наиболее выражен, возможность выведения из которого в значительной степени определяет успех их лечения.
Из широкого арсенала препаратов, регулирующих свободнорадикальный гомеостаз и применяющихся в послеоперационной терапии распространенного перитонита, лишь немногие, помимо антиоксидантных свойств, обладают также иммунокорригирующим действием. В связи с вышеизложенным, особый интерес представляют литературные данные, описывающие антиоксидантные и иммунокорригирующие свойства дигидрокверцетина. Сравнительное исследование иммунного статуса лабораторных животных при применении антиоксидантов на фоне хронического лучевого воздействия позволило установить, что использование антиоксидантных препаратов положительно влияет на иммунный статус крыс. Некоторые преимущества в иммуномодулирующем действии имел дигидрокверцетин, поскольку его применение позволяет несколько более эффективно повысить противорадиационную защиту у экспериментальных животных за счет стимуляции Т-клеточного звена иммунитета и повышения фагоцитарной активности. Кроме того, антиоксиданты позволили снизить дефицит CD-4 лимфоцитов, возникающий на фоне хронического лучевого воздействия, при этом дигидрокверцетин обладал более выраженным протекторным действием. Также применение антиоксидантных препаратов, в том числе и дигидрокверцетина, достоверно стимулировало рост количества CD19+ лимфоцитов и повышало их функциональную активность в обеспечении макроорганизма иммуноглобулинами основных классов [8].
Заключение
Таким образом, очевидно, что перспективным направлением в послеоперационной интенсивной терапии распространенного перитонита, наряду с общепринятыми хирургическими и фармакологическими методами, является дополнительное применение природного флавоноида дигидрокверцетина, который приводит к нормализации показателей свободнорадикального окисления, активирует антиоксидантную систему защиты, снижает уровень провоспалительных цитокинов, способствует снижению избыточного синтеза оксида азота, восстанавливает уровень регионарного кровотока в стенке тонкой кишки. Приведенные в данной работе результаты патоморфологических исследований и оценки общей летальности также свидетельствуют об эффективности дигидрокверцетина и целесообразности проведения дальнейших целенаправленных доклинических и клинических испытаний при лечении распространенного перитонита.
Рецензенты:
Смахтин М.Ю., д.м.н., профессор кафедры биохимии ГБОУ ВПО «Курский государственный медицинский университет» Минздрава России, г. Курск.
Маль Г.С., д.м.н., профессор, зав. кафедрой фармакологии ГБОУ ВПО «Курский государственный медицинский университет» Минздрава России, г. Курск.



