Введение
Разнообразную биологическую активность и значение для медицинского применения плодов софоры японской определяет наличие в химическом составе данного лекарственного растительного сырья (ЛРС) различных биологически активных веществ (БАВ), в том числе комплекса фенольных соединений [2,5,9]. Как известно, фенольные соединения, в частности, флавоноиды и фенолкарбоновые кислоты, характеризуются широким спектром фармакологического действия: они обладают антиоксидантными, противовоспалительными, капилляропротекторными и др. ценными свойствами. В силу этих положительных качеств фенольные соединения и ЛРС, их содержащее, вызывают обоснованный исследовательский интерес со стороны разработчиков лекарственных средств [1,4,11].
Наиболее распространенными методами анализа фенольных соединений, в том числе флавоноидов и фенолкарбоновых кислот, в растительных объектах являются метод дифференциальной спектрофотометрии и ВЭЖХ [3,8,10,11]. Однако в последние годы для этих целей все чаще применяется метод капиллярного электрофореза, основанный на разделении заряженных компонентов сложной смеси в кварцевом капилляре под действием приложенного электрического поля за счёт подачи высокого напряжения к концам капилляра. На сегодняшний день капиллярный электрофорез зарекомендовал себя как один из наиболее перспективных и высокоэффективных методов разделения и анализа сложных смесей на составляющие компоненты. Преимущества его заключаются в высокой эффективности разделения, возможности определения малых количеств вещества в течение короткого промежутка времени, малом расходе реактивов (микролитры), простой пробоподготовке, надежной работе капилляра с экономичными водными буферами. Кроме того, капиллярный электрофорез не требует насосов высокого давления, необходимых для жидкостной хроматографии, несравнимо меньше в этом случае и расход высокочистых растворителей. Отсутствие твердого сорбента в капилляре исключает возможность его «старения», химической и физической деструкции и любого неспецифического связывания с ним компонентов пробы [12,13]. Исходя из вышесказанного, представлялось целесообразным изучить фенольные соединения плодов софоры японской методом капиллярного электрофореза.
Целью исследования являлись исследования по идентификации и количественному определению фенольных соединений в плодах софоры японской методом капиллярного электрофореза.
Материал и методы исследования
Объектом исследования служили образцы плодов софоры японской собственной и промышленной заготовки. На первом этапе исследований фенольные соединения в плодах софоры японской идентифицировали путем проведения характерных для данной группы БАВ качественных реакций и по данным хроматографического анализа. Флавоноиды обнаруживали на основании положительной цианидиновой пробы, а также по результатам реакций с 10 % раствором гидроксида натрия, 2 % раствором алюминия хлорида, 1 % раствором железа хлорида (III). Присутствие фенолкарбоновых кислот устанавливали методами бумажной и тонкослойной хроматографии. Высушенные хроматограммы просматривали в фильтрованном УФ-свете до и после обработки специфическими реактивами: парами аммиака, 2 % раствора калия гидроксида в метаноле, 1 % спиртовым раствором хлорида железа (III) [4,11].
Пробоподготовку для целей электрофоретического анализа осуществляли путем СВЧ-экстракции плодов софоры японской 10 % спиртом этиловым на СВЧ-минерализаторе «Минотавр-1». Пробу сырья в количестве 1,0 г помещали во фторопластовый контейнер СВЧ-минерализатора, добавляли 25 мл 10 % спирта этилового, устанавливали контейнер в магнетрон минерализатора. Минерализацию проводили, используя режим «разложение без давления», в течение 10 мин. По истечении указанного времени контейнер извлекали из СВЧ-минерализатора, охлаждали в естественных условиях в течение 3–5 мин. Полученное извлечение количественно переносили в мерную колбу объемом 25 мл.
Фенольные соединения в извлечении анализировали методом капиллярного электрофореза на приборе «Капель-103Р» (ОАО «НПФ Люмэкс», Россия) с кварцевым капилляром Lэфф/Lобщ=50/60 см, ID=75 мкм.
Электрофорез проводили при напряжении на капилляре 16 кВольт, температуре капилляра 20–30 °С. Анализируемую пробу дозировали в прибор не менее двух раз, ввод пробы осуществляли пневматически, время анализа составляло 15 мин. Перед каждым измерением капилляр промывали сначала раствором кислоты хлороводородной, а затем последовательно водой очищенной, раствором гидроксида натрия, водой очищенной и рабочим буферным раствором. Детектирование проводили спектрофотометрически при длине волны 254 нм. Для градуировки прибора использовали калибровочные растворы стандартных образцов флавоноидов и фенолкарбоновых кислот [6,7].
Результаты исследования и их обсуждение
Все изученные образцы плодов софоры японской давали положительные специфические реакции с хромогенными и осадительными реактивами, что свидетельствовало о присутствии в них соединений флавоноидной природы. Результаты хроматографического анализа показали наличие в объектах исследования рутина и кверцетина, кроме того, были идентифицированы фенолкарбоновые кислоты – хлорогеновая, кофейная и галловая.
Более детальное исследование фенольных соединений далее осуществляли методом капиллярного электрофореза. Электрофореграмма плодов софоры японской представлена на рисунке.
Идентификацию разделенных соединений проводили путем сопоставления времени удерживания пиков, полученных на электрофореграмме, со временем удерживания стандартных образцов.
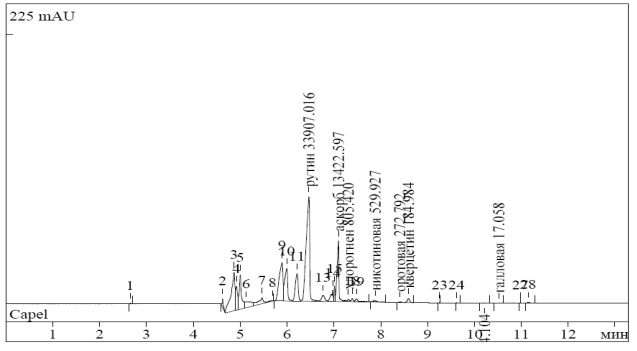
Рисунок. Электрофореграмма фенольных соединений плодов софоры японской
Количественное определение идентифицированных веществ в исследуемых образцах проводили по площади пиков, используя программное обеспечение к прибору по установленным ранее градуировочным характеристикам.
Результаты изучения качественного состава и количественного содержания фенольных соединений в пяти образцах плодов софоры японской представлены в таблице.
Таблица
Содержание фенольных соединений в плодах софоры японской
|
Наименование соединения |
Содержание, мг% |
||||
|
Образец №1 |
Образец №2 |
Образец №3 |
Образец №4 |
Образец №5 |
|
|
рутин |
3390,7±406,9 |
4081,3±489,8 |
3952,4±474,3 |
4273,2±512,8 |
3685,7±442,3 |
|
кверцетин |
18,5±2,4 |
24,1±2,9 |
19,2±2,3 |
27,5±3,3 |
20,7±2,5 |
|
кислота хлорогеновая |
80,5±9,7 |
87,3±10,5 |
84,1±10,1 |
89,2±10,7 |
83,6±10,0 |
|
кислота кофейная |
0,4±0,05 |
0,7±0,08 |
0,5±0,06 |
0,8±0,09 |
0,4±0,05 |
|
кислота галловая |
1,7±0,2 |
2,2±0,3 |
1,8±0,2 |
2,5±0,3 |
1,9±0,12 |
Примечания:
Образец 1 – ООО «СОИК», г. Москва;
Образец 2 – ООО «Сила природы», Краснодарский край, Отрадненский район;
Образец 3 – Краснодарский край, ст. Динская;
Образец 4 – Краснодарский край, г. Краснодар;
Образец 5 – Краснодарский край, ст. Васюринская.
Заключение
Таким образом, методом капиллярного электрофореза установлено, что в изученных образцах плодов софоры японской существенно преобладает рутин, содержание которого колебалось от 3390,7 до 4273,2 мг%. Кроме того, из группы флавоноидов обнаружен кверцетин в количестве 18,5–27,5 мг%. Что касается фенолкарбоновых кислот, то они представлены кислотами хлорогеновой, кофейной и галловой. Концентрация хлорогеновой кислоты в исследованных образцах составила 80,5–89,2 мг%, кофейной кислоты – 0,4-0,8 мг%, содержание галловой кислоты менялось от 1,7 до 2,5 мг%.
Рецензенты:
Степанова Э.Ф., д.фарм.н., профессор кафедры технологии лекарств Пятигорского филиала ГБОУ ВПО Волгоградский государственный медицинский университет Министерства здравоохранения Российской Федерации, профессор, г. Пятигорск.
Дроздова И.Л., д.фарм.н., профессор кафедры фармакогнозии и ботаники ГБОУ ВПО Курский государственный медицинский университет Министерства здравоохранения Российской Федерации, г. Курск.



