Введение
Ревматоидный артрит (РА) характеризуется высокой клинической и иммунологической гетерогенностью, что отражается в различных фенотипах заболевания. Наиболее значимыми прогностическими признаками тяжёлого течения РА считаются серопозитивность (наличие ревматоидного фактора и/или антител к циклическим цитруллинированным пептидам), высокая активность воспаления по шкале DAS28, раннее формирование эрозивных изменений и системные проявления. Клинико-лабораторные характеристики пациентов, включая выраженность воспалительного синдрома, наличие иммунологических маркеров и степень суставного поражения, позволяют не только уточнить диагноз, но и спрогнозировать скорость прогрессирования заболевания, а также ответ на проводимую терапию [1-3]. Современные подходы к лабораторной диагностике РА предусматривают оценку целого ряда биомаркеров, включая аутоантитела, белки острой фазы воспаления (БОФ), цитокины, маркеры активации эндотелия, субпопуляции лимфоцитов, а также метаболиты костной и хрящевой ткани и генетические предикторы [1; 4]. БОФ представляют собой гликопротеины плазмы, синтезируемые в печени в ответ на тканевое повреждение и цитокиновую стимуляцию. Повышение их концентрации в сыворотке крови наблюдается при различных патологических процессах, включая инфекционные, травматические, опухолевые и аутоиммунные заболевания. Ключевыми провоспалительными цитокинами, индуцирующими продукцию БОФ, являются интерлейкины (ИЛ-1, ИЛ-6), а также фактор некроза опухоли-α. Наиболее значимыми положительными БОФ являются С-реактивный белок (СРБ), фибриноген, белки семейства S100, ферритин, сывороточный амилоид А и компоненты системы комплемента, в первую очередь C3. Эти молекулы активируют комплемент по классическому пути, способствуют опсонизации и удалению иммунных комплексов и взаимодействуют с антигенами погибающих клеток, в частности - с ядерным материалом апоптотических и некротических клеток. СРБ является одним из основных острофазовых белков у человека, уровень которого может возрастать от 5 до 3000 мкг/мл в ответ на воспаление [5; 6]. Следует учитывать, что у пациентов, находящихся на иммуносупрессивной терапии (в особенности на фоне биологических препаратов, таких как тоцилизумаб - антагонист ИЛ-6), СРБ может не повышаться даже при наличии инфекции. В таких случаях важную роль приобретает клиническое обследование и методы визуализации [7; 8]. Повышение СОЭ и концентрации СРБ отражает как локальный, так и системный воспалительный ответ при РА. При этом исходные значения СРБ могут быть выше у пациентов с ожирением, что необходимо учитывать при интерпретации результатов [9; 10]. Определение СОЭ и вчСРБ рекомендовано как на этапе постановки диагноза, так и для оценки активности заболевания. Эти показатели включены в классификационные критерии ACR/EULAR (2010) и используются при расчёте индексов активности РА [10; 11].
В последние годы растёт интерес к роли жировой ткани в иммунной регуляции. Адипокины – это биологически активные молекулы, продуцируемые как адипоцитами, так и иммунокомпетентными клетками жировой ткани. Они обладают множественными биологическими функциями, включая участие в метаболических процессах, воспалении, ангиогенезе, костеобразовании и иммунных реакциях. В литературе описано более 50 различных адипокинов, отличающихся по структуре, механизму действия и спектру эффектов [10; 11]. Среди них наиболее подробно изучены лептин, адипонектин, висфатин и резистин. Эти молекулы активно исследуются в качестве потенциальных биомаркеров при остеоартрите, метаболическом синдроме и воспалительных заболеваниях суставов, включая ревматоидный артрит. Перспективным объектом внимания является несфатин-1 (НФ-1) - пептид из семейства NUCB2, который участвует в регуляции пищевого поведения, стресс-ответа, углеводного обмена и воспаления. Согласно данным экспериментальных и клинических исследований, несфатин-1 способен стимулировать миграцию моноцитов и активировать макрофаги, что подтверждает его провоспалительные свойства [6]. С учетом системного характера воспаления при ревматоидном артрите исследование уровня несфатина-1 как потенциального маркера активности и тяжести заболевания представляется актуальным. Однако ранее полученные данные о его клиническом значении при хронических воспалительных заболеваниях остаются противоречивыми. В связи с этим представлялось важным уточнить взаимосвязь между концентрацией НФ-1 в сыворотке и клинико-лабораторными характеристиками РА.
Цель исследования – изучить взаимосвязь между уровнем НФ-1 в сыворотке крови и клинико-лабораторными показателями активности РА, включая маркеры системного воспаления (СОЭ и вчСРБ), для оценки диагностической значимости НФ-1 как потенциального биомаркера активности заболевания.
Материал и методы исследования
В исследование включено 120 пациентов РА с верифицированным диагнозом на основе критериев ACR/EULAR (2010) и 60 человек контрольной группы без жалоб на боли в суставах. Среди пациентов с РА было 113 (94,2%) женщин и 7 (5,8%) мужчин, средний возраст составил 54,07±11,32 (M ± SD) года. ИМТ – 28,7±6,07 (27,6-29,8) кг/м2. Активность заболевания оценивалась согласно индексу DAS28 (2021). В состоянии ремиссии находились 22% больных РА, 23% имели низкую, 42% – умеренную и 13% – высокую степень активности. Уровни НФ-1 в сыворотке крови измерялись непрямым твердофазным иммуноферментным анализом с использованием коммерческой тест-системы Nesfatin-1 ELISA (RaiBiotech, кат. EIA-NESF). Определение уровня вчСРБ в сыворотке крови проводилось методом ИФА с помощью набора BIOMERICA (США, Cat. No.: 7033). Общеклинические лабораторные исследования выполнялись по общепринятым методикам. У больных проводился общий анализ крови с подсчетом лейкоцитарной формулы, тромбоцитов (по показаниям - ретикулоцитов), СОЭ. Статистическая обработка проводилась с использованием пакета Statistica 13.0. Различия между группами оценивали при помощи общепринятых параметрических и непараметрических критериев в зависимости от характера переменной и количества групп. Параметрические данные представлены как M ± SD и 95% ДИ доверительный интервал. Корреляционный анализ количественных показателей, подверженных нормальному распределению, производился по критерию Пирсона (r), ненормальному – Спирмена (ρ). Анализ качественных показателей производился с использованием χ2 Пирсона для 2*2 таблиц, поправка Йетса – при анализе таблиц с более чем 4 переменными, а при наличии менее 10 наблюдений в ячейках – использовался точный критерий Фишера (F-exact). Для оценки диагностической значимости НФ-1 и определения диагностических порогов применяли метод анализа ROC-кривых. Статистическая значимость оценивалась при уровне p < 0,05.
Результаты исследования и их обсуждение
Референсные значения уровня НФ-1, рассчитанные по формуле М±2σ, составили 25,27–37,95 нг/мл. Статистически значимых различий между уровнем НФ-1 у условно здоровых лиц в зависимости от пола, возраста и ИМТ выявлено не было. Средний уровень НФ-1 в сыворотке крови у больных РА составил 50,49±34,05 (44,05-56,92) нг/мл и был статистически значимо выше показателя здоровых лиц (p<0,001). При этом повышенный уровень НФ-1 (более 37,95 нг/мл) выявлен у 76 (60,0%) пациентов. На основании порогового значения НФ-1 (37,95 нг/мл) пациенты были распределены на две группы с последующим сравнительным анализом корреляции между уровнем НФ-1 и клиническими параметрами РА (табл.). Полученные данные демонстрируют, что повышенный уровень НФ-1 ассоциирован с агрессивным фенотипом РА, характеризующимся высокой иммунологической активностью (серопозитивность, РФ-позитивность) и выраженной активностью воспаления.
Взаимосвязь сывороточного уровня НФ-1 с классификационными характеристиками РА
|
Показатель |
Повышенный уровень НФ-1, n=76 |
Нормальный уровень НФ-1, n=44 |
Статистическая значимость различий, χ2 |
|
Активность по DAS28, n (%): · Ремисcия – · Низкая – · Умеренная – · Высокая – |
15,8% (12) 21,0%(16) 46,0%(35) 17,1%(13) |
34,1%(15) 27,3%(12) 34,1%(15) 4,5%(2) |
χ2=9,08; p=0,028 |
|
Наличие внесуставных проявлений, n (%): · Да – · Нет – |
82,9%(63) 17,1%(13) |
30 (68,2%) 14 (31,8%) |
χ2 Йейтса=2,67; p=0,102 |
|
Наличие эрозий, n (%): · Да – · Нет – |
71,0%(54) 28,9%(22) |
79,5%(35) 20,45%(9) |
χ2 Йейтса=0,02; p=0,889 |
|
Клиническая стадия, n (%): · Очень ранняя – · Ранняя – · Развернутая – · Поздняя – |
- 14,5%(11) 36,8%(28) 48,7%(37) |
-15,9%(7) 31,8%(14) 52,3%(23) |
χ2=0,31; p=0,856 |
|
Серопозитивность, n (%): · Да – · Нет – |
92,11%(70) 7,89%(6) |
79,5%(35) 20,4%(9) |
F-exact; p=0,045 |
|
Повышенный РФ, n (%): · Да – · Нет – |
81,6%(62) 18,4%(14) |
63,6%(28) 36,4%(16) |
χ2 Йейтса=3,86; p=0,049 |
|
Повышенные АЦЦП, n (%): · Да – · Нет – |
68,4% (52) 31,6% (24) |
28 (63,6%) 16 (36,4%) |
χ2 Йейтса=0,11; p=0,737 |
|
Функциональный класс, n (%): · I – · II – · III – |
26,3%(20) 68,4%(52) 5,3%(4) |
38,6%(17) 52,3%(23) 9,1%(4) |
χ2=3,14; p=0,207 |
|
Рентгеновская стадия, n (%) · I – · II – · III – · IV – |
6,6%(5) 31,6%(24) 59,2%(45) 2,6%(2) |
2 (4,5%)(2) 23 (52,3%)(23) 17 (38,6%)(17) 2 (4,5%)(2) |
χ2=5,83; p=0,120
|
|
Наличие осложнений РА, n (%): · Да – · Нет – |
59,2%(45) 40,8%(31) |
50,0% (22) 50,0%(22) |
χ2 Йейтса=0,62; p=0,431 |
Примечание: РА – ревматоидный артрит; НФ-1 – несфатин-1; РФ – ревматоидный фактор; АЦЦП – антитела к циклическим цитруллинированным пептидам; F-exact – точный критерий Фишера; χ2 - критерий Пирсона; χ2Йейтса - модификация критерия Пирсона.
Источник: составлено авторами на основе полученных данных в ходе исследования.
Анализ взаимозависимостей между уровнем НФ-1 и традиционными лабораторными индикаторами активности воспаления у больных РА: СОЭ и уровнем вчСРБ, выявил наличие значимых положительных корреляций (рис. 1). Полученные данные позволяют рассматривать НФ-1 в качестве перспективного биомаркера воспаления (БОФ), потенциально вовлеченного в патогенетические механизмы системного воспалительного ответа при РА.
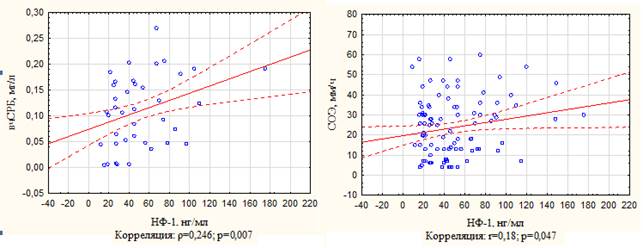
Рис. 1. Взаимосвязь между уровнем НФ-1 в сыворотке крови, вчСРБ и СОЭ у пациентов РА
Источник: составлено авторами по результатам данного исследования.
Методом ROC-анализ была создана модель для оценки диагностической ценности НФ-1 при умеренной и высокой активности РА (рис. 2). Площадь под кривой составила 0,611±0,052 (95% ДИ 0,509-0,713; p=0,036). Оптимальный порог - 43,81 нг/мл - обеспечивал 65,6% чувствительности и 57,6% специфичности. Пациентам с умеренной и высокой степенью активности РА при уровне НФ-1 ≥ 43,81 нг/мл рекомендуется рассмотреть возможность коррекции терапии в соответствии с принципом treat-to-target.
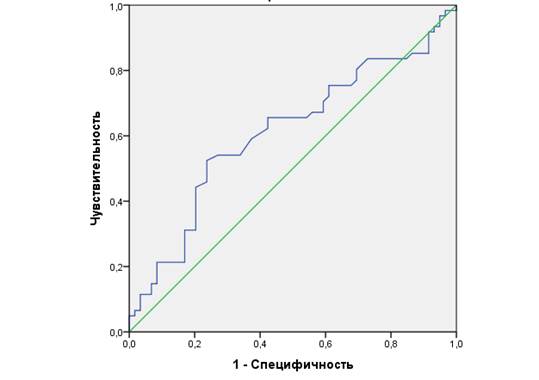
Рис. 2. ROC-кривая уровня НФ-1 при определении умеренной и высокой степени активности РА
Источник: составлено авторами по результатам данного исследования.
Полученные результаты демонстрируют значительное повышение уровня НФ-1 у пациентов с РА, ассоциированное с агрессивным фенотипом заболевания. Установленные корреляции между уровнем НФ-1 и ключевыми маркерами активности РА (серопозитивность, РФ-позитивность, СОЭ, вчСРБ) подтверждают патогенетическую роль данного адипокина в развитии системного воспаления и позволяют рассматривать НФ-1 как перспективный прогностический индикатор тяжелого течения заболевания. Выявленная диагностическая ценность НФ-1 (AUC=0,611) хотя и демонстрирует умеренную прогностическую способность, но в сочетании с другими маркерами может повысить точность оценки активности заболевания. Особенно перспективным представляется использование порогового значения 43,81 нг/мл в клинической практике, что соответствует принципам персонализированной медицины. Важным аспектом исследования является отсутствие значимой корреляции уровня НФ-1 с параметрами проводимой терапии, включая дозы глюкокортикоидов и виды базисных противоревматических препаратов. Это свидетельствует о том, что концентрация НФ-1 отражает независимые от терапии патогенетические механизмы, что повышает его ценность как потенциального биомаркера, не подверженного влиянию терапевтических вмешательств. Сравнивая полученные нами результаты с данными других исследований, следует отметить, что полученные корреляции согласуются с современными представлениями о роли адипокинов в патогенезе РА и в модуляции иммунного ответа [12].
Заключение
Таким образом, результаты проведенного исследования демонстрируют значимую роль НФ-1 в патогенезе РА. У пациентов с РА выявлено статистически значимое повышение сывороточного уровня НФ-1 по сравнению со здоровыми лицами. Концентрация НФ-1 >37,95 нг/мл ассоциирована с агрессивным фенотипом заболевания, характеризующимся серопозитивностью, РФ-позитивностью и высокой активностью воспаления. Важным аспектом исследования стало обнаружение положительных корреляций между уровнем НФ-1 и традиционными маркерами системного воспаления (СОЭ и вчСРБ), что позволяет рассматривать его как новый перспективный индикатор острой фазы воспаления при РА. Диагностическая значимость НФ-1 и пороговое значение 43,81 нг/мл обладают диагностической значимостью для оценки активности заболевания, а независимость уровня НФ-1 от параметров проводимой терапии подчеркивает его ценность как объективного биомаркера, отражающего фундаментальные патогенетические механизмы заболевания. Полученные данные не только расширяют современные представления о патогенетической роли адипокинов в развитии РА, но и открывают новые перспективы для разработки усовершенствованных алгоритмов диагностики и оценки активности заболевания, а также для поиска новых терапевтических мишеней в лечении данной патологии.
Конфликт интересов
Библиографическая ссылка
Квливидзе Т.З., Заводовский Б.В., Бедина С.А., Загороднева Е.А., Краюшкина Н.Г. ВЗАИМОСВЯЗЬ НЕСФАТИНА-1 С ЛАБОРАТОРНЫМИ И КЛИНИЧЕСКИМИ ПАРАМЕТРАМИ РЕВМАТОИДНОГО АРТРИТА // Современные проблемы науки и образования. 2025. № 4. ;URL: https://science-education.ru/ru/article/view?id=34245 (дата обращения: 05.03.2026).
DOI: https://doi.org/10.17513/spno.34245



