Введение. Широкая распространенность и неудовлетворительные результаты лечения онкологических заболеваний определяют актуальность изучения факторов, влияющих на течение злокачественного процесса. В этой связи интерес представляют коморбидные эндокринопатии, связанные с нарушением функции щитовидной железы, как состояния, характеризующиеся значительными дисрегуляторными и метаболическими изменениями [1; 2]. Выраженность таких нарушений может быть оценена путем изучения динамики адаптационного статуса – изменений в характере и напряженности общих неспецифических адаптационных реакций организма (АР). Ранее была установлена связь между характеристиками этих интегральных реакций и устойчивостью организма к действию повреждающих факторов различной природы (неспецифической резистентностью организма) [3; 4]. АР стресс развивается в ответ на действие высокоинтенсивных факторов, выводящих организм за пределы физиологической нормы, характеризуется напряжением гипоталамо-гипофизарно-надпочечниковой оси и других стресс-реализующих механизмов [3; 5]. Данная АР имеет две основные формы, зависящие от длительности повреждающего воздействия: острый и хронический стресс. АР хронический стресс является неспецифическим фоном развития многих патологических процессов [5-7].
Антистрессорные АР тренировки (Тр), спокойной активации (СА) и повышенной активации (ПА) четко отличаются от АР стресс и друг от друга относительным числом лимфоцитов в периферической крови и целым рядом показателей состояния иммунной и нейроэндокринной систем, особенностями клеточной энергетики [5; 8; 9]. При этом было показано существование как относительной, так и абсолютной шкалы интенсивности воздействия. Первая из них определяет характер АР, а вторая – уровень реактивности организма, на котором развивается эта АР. Наиболее благоприятными являются АР СА и ПА высоких уровней реактивности, развивающиеся в ответ на слабые воздействия и, в случае их устойчивости, способствующие значительной активизации системных механизмов неспецифической противоопухолевой резистентности организма [8; 9]. При усилении интенсивности воздействий уровень реактивности снижается и антистрессорные АР приобретают признаки напряженности, которые отражают субстрессорные нарушения при сохранении характерной для АР направленности основных системных процессов. Признаки напряженности проявляются в отклонении от нормальных значений показателей лейкоцитарной формулы, кроме относительного числа лимфоцитов, которое является маркером характера АР. В случае АР стресс при снижении уровня реактивности происходит усиление структурно-функциональных нарушений и усугубление относительной лимфоцитопении.
Цель исследования – выявить особенности влияния экспериментального гипертиреоза на устойчивость организма к росту перевивных злокачественных опухолей и адаптационный статус животных-опухоленосителей.
Материал и методы исследования
Эксперименты проводили на 20 белых беспородных крысах-самцах весом 213-290 г с перевивной саркомой-45 (С-45). Животным основной группы (n=10) за 5 суток до подкожной трансплантации С-45 и далее в течение всего эксперимента ежедневно внутрибрюшинно вводили препарат эутирокс (левотироксин натрия) в дозе 20 мкг на 100 г веса. Наличие гипертиреоза подтверждали путем изучения содержания в сыворотке крови общего тироксина (Т4), трийодтиронина (Т3) и тиреотропного гормона (ТТГ) радиоиммунным методом с помощью стандартных наборов (Immunotech, Чехия) после трех дней ежедневного введения эутирокса, а также путем определения веса щитовидной железы в конце эксперимента. Крысам контрольной группы, кроме трансплантации С-45, специальных воздействий не проводили. Подкожную трансплантацию опухоли осуществляли стандартным способом – путем введения 0,3 мл взвеси клеток С-45 в 0,5 мл физиологического раствора (не менее 106 клеток). В дальнейшем еженедельно определяли объем опухоли (по формуле Шрека для эллипсоидов) и проводили оценку адаптационного статуса, а также фиксировали продолжительность жизни лабораторных животных.
Адаптационный статус оценивали еженедельно по показателям лейкоцитарных формул периферической крови, подсчитанных на 200 клеток, с помощью которых определяли характер и напряженность общих неспецифических адаптационных реакций организма (АР) [3; 5; 8]. Основным гематологическим показателем характера АР является процентное число лимфоцитов крови. У белых беспородных крыс АР стресс соответствуют значения показателя ниже 50%, АР Тр – значения в диапазоне 50-60%, АР СА – 61-70%, АР ПА – 71-75, реже – до 80%. Далее начинается зона умеренного относительного лимфоцитоза. Напряженным антистрессорным АР соответствовали отклонения от референсных значений показателей лейкоцитарной формулы крови, включающих процентное число моноцитов, эозинофилов, палочкоядерных нейтрофилов и базофилов. Для уточнения характера и напряженности АР в конце эксперимента были изучены весовые коэффициенты внутренних органов, косвенно отражавшие выраженность гипоплазии и лимфопролиферативную активность в органах иммунной системы. Весовые коэффициенты рассчитывали стандартным образом – путем деления веса органа на вес животного и последующего умножения результата на 103 (для нивелирования громоздкости непосредственного результата деления, обусловленной большой разницей между весом животного и весом органа).
При статистической обработке результатов использовали критерии Стьюдента, Манна-Уитни и Пирсона (χ2), а также оценивали вариабельность анализируемых показателей, вычисляя коэффициент вариации (Cv%). С целью оперативной оценки наличия или отсутствия «перекрытия» диапазонов значения изученных показателей в сравниваемых группах (подгруппах) животных при статистическом анализе использовали размах вариаций (xmin–xmax).
Исследования были выполнены в соответствии с международными принципами «Европейской Конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целя» (Страсбург, 1986). Перед началом экспериментов было получено разрешение комиссии по биоэтике ФГБУ «НМИЦ онкологии» Минздрава России (протокол заседания № 24 от 17.09 2023 г.).
Результаты исследования и их обсуждение. Развитие гипертиреоза у исследованных животных было подтверждено результатами анализа уровня тиреотропного (ТТГ) и тиреоидных гормонов (Т3 и Т4) в крови. Так, уже через 3 дня после начала ежедневного введения эутирокса было отмечено повышение содержания тиреоидных гормонов в 1,8-1,9 раза при снижении уровня ТТГ в 2,5 раза (табл. 1, p ≤0,0001).
Таблица 1
Изменение уровня гормонов щитовидной железы и тиреотропного гормона гипофиза в сыворотке крови крыс после приема эутирокса до трансплантации С-45
|
Группы животных |
ТТГ, мМЕ/л |
Т4, нмоль/л |
Т3, нмоль/л |
|
Контрольная группа (С-45) |
0,095±0,009 |
35,30±2,35 |
2,016±0,136 |
|
Основная группа (эутирокс+С-45) |
0,038±0,003* р=0,0001 |
64,78±3,43* р=0,0000 |
3,845±0,180* р=0,0000 |
Примечание: * - отличается от показателя в контрольной группе, p ≤0,0001. Критерий Стьюдента.
Обозначения: ТТГ – тиреотропный гормон, Т4 – тироксин, Т3 – трийодтиронин.
У животных, получавших эутирокс, наблюдалось изменение темпов роста С-45 и сокращение продолжительности жизни на 7 дней по сравнению с показателями в контрольной группе, соответственно, 47,2±1,0 и 40,5±2,6 суток (табл. 2, p <0,05). Это свидетельствовало о снижении общей неспецифической противоопухолевой резистентности организма под влиянием гипертиреоза.
Таблица 2
Объем саркомы-45 на этапах эксперимента (см3)
|
Сутки со дня трансплантации опухоли |
7 |
21 |
35 |
40 |
47 |
|
Контрольная группа |
0,69±0,14 |
14,01±3,13 |
32,6±0,61 |
52,3±6,44 |
83,6±8,02 |
|
Основная группа |
1,54±0,112* р=0,0019 |
15,81±3,25*
|
43,64±1,63* р=0,0027 |
72,2±4,21* р=0,0418 |
- |
Примечание: * - отличается от показателя в контроле, p <0,05 – 0,002. Критерий Стьюдента.
В таблице 3 представлены сведения о спектре различных АР в основной и контрольной группах животных на этапах эксперимента. Как видно из таблицы, через неделю после перевивки С-45 у крыс обеих групп преобладали антистрессорные АР с признаками напряженности, что проявлялось в относительном моноцитозе, увеличении процентного содержания палочкоядерных нейтрофилов, анэозинофилии. Через 3 недели значительно возрастало число случаев развития АР стресс (до 80% в основной группе) (табл. 3). При этом у крыс, получавших эутирокс, из антистрессорных АР наблюдалась только напряженная АР Тр, тогда как у животных контрольной группы были отмечены также и случаи развития более благоприятной АР СА. Через 5 недель после перевивки С-45 у крыс обеих групп преобладала АР стресс. При этом в основной группе наблюдалась только указанная АР, тогда как в контрольной группе у 30% животных были отмечены напряженные антистрессорные АР (табл. 3). Обращало на себя внимание, что у крыс основной группы при АР стресс относительное число лимфоцитов сдвигалось в сторону нижней границы стрессорного диапазона значений этого показателя и было статистически значимо ниже, чем при АР стресс у животных контрольной группы (табл. 3). Такая разница могла указывать на снижение уровня реактивности АР стресс у крыс-опухоленосителей под влиянием гипертиреоза, т.е. развития более тяжелого варианта этой АР.
Таблица 3
Влияние гипертиреоза на спектр адаптационных реакций (АР) крыс на этапах роста саркомы-45 (случаи, %)
|
АР/группы |
Контрольная, % |
Основная, % |
Этапы роста опухоли |
|
АР Тр и СА с напряжением |
90 |
80 |
1 неделя |
|
АР стресс |
10 |
20 |
|
|
АР Тр и СА с напряжением |
50 |
20 |
3 недели |
|
АР стресс |
50 |
80 |
|
|
АР Тр с напряжением |
30% |
0%Т, р=0,061 |
5 недель |
|
АР стресс |
70% |
100% |
|
|
% лимфоцитов при АР стресс Me [xmin–xmax ] |
38,5[29 - 42] |
23,5[21,5 – 35,5]* р <0,05 |
Обозначения: АР ТР – АР тренировки, АР СА – АР спокойной активации.
Примечание: Т – отличается от показателя в контрольной группе на уровне тенденции, р <0,1; * - отличается от показателя в контрольной группе, p <0,05. Критерии Пирсона χ2 и Манна-Уитни.
Об ухудшении адаптационного статуса крыс-опухоленосителей под влиянием гипертиреоза свидетельствовала также и динамика характера и напряженности АР статуса исследованных животных. На рисунке представлены сведения о случаях ухудшения характеристик АР на этапах роста С-45, начиная со второй недели после ее трансплантации. Под ухудшением характеристик АР имели в виду переход антистрессорных АР в АР стресс, а также нарастание признаков напряженности антистрессорных АР по параметрам лейкоцитарной формулы. Относительное число таких случаев при наличии гипертиреоза на большинстве этапов было выше, чем в контрольной группе. Такая разница была наиболее выражена через 5 недель опухолевого роста (рис.).
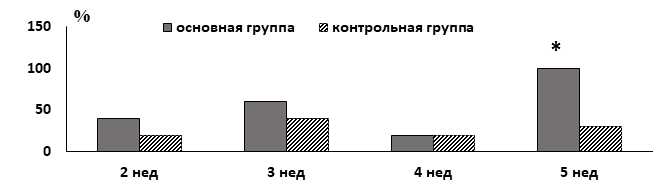
Относительное число случаев ухудшения характеристик адаптационных реакций белых беспородных крыс исследованных групп на этапах роста саркомы-45 по сравнению с предыдущими этапами
Примечание: * - отличается от значения в контрольной группе, p =0,02, критерий Пирсона χ2.
По достижении терминальных стадий роста С-45 проводили декапитацию экспериментальных животных и последующую некропсию. Определяли весовые коэффициенты органов иммунной и эндокринной систем: тимуса, селезенки и надпочечников, а также отношение массы тимуса к массе надпочечников (табл. 4). Эти показатели позволяли уточнить оценку адаптационного статуса исследованных животных в конце эксперимента, проводимую по лейкоцитарной формуле крови.
Таблица 4
Влияние гипертиреоза на весовые характеристики внутренних органов крыс-опухоленосителей (Me [xmin–xmax], Cv%)
|
Группы/ показатели |
Контрольная |
Основная |
||
|
Надпочечники |
0,38[0,36-0,39] Cv 3,5% |
0,43[0,42-0,64]1 Cv 20,2% |
||
|
Тимус |
0,50[0,38-1,30] Cv 59,6% |
0,51[0,42-0,64] 2 Cv 16,2% |
||
|
1.1.n=4 |
2.1 n=6 |
|||
|
1,1[0,9-1,3] Cv 13,7% |
0,41[0,38-0,502 Cv 14,8% |
|||
|
Тим./надп. |
2,50[0,98-3,58] Cv 48,1% |
1,08[0,82-1,50] 3 Cv 23,6% |
||
|
1.2. n=7 |
2.2. n=3 |
|||
|
3,00[2,50-3,58] Cv 17,8% |
1,03[0,98-1,07] 3 Cv 4,4% |
|||
|
Селезенка |
4,5[4,2-5,8]4 Cv 15,2% |
6,45 [3,90-8,80] Cv 40,1% |
||
|
1.3. n=5 |
2.3. n=5 |
|||
|
8,7[7,7 – 8,8]1 Cv 4,4% |
4,1[3,9-4,3]4 Cv 4,1% |
|||
Примечание: Cv – коэффициент вариации; 1 --отличается от показателя в контрольной группе в целом, 2 – отличается показателя в подгруппе 1.1, 3 - – отличается показателя в подгруппе 1.2, 4 – отличается от показателя в подгруппе 1.3, p <0,01-0,05. Критерий Манна - Уитни.
Было отмечено некоторое увеличение весовых коэффициентов надпочечников у животных основной группы (p <0,05). При этом имели место четкое разделение диапазонов значений этого показателя у крыс контрольной и основной групп и его чрезвычайно низкая вариабельность у крыс контрольной группы (всего 3,5%, табл. 4). Известно, что избыток тироксина при гипертиреозе оказывает стимулирующее действие на скорость пролиферации адренокортикоцитов, способствует увеличению плотности сосудистого русла и усилению секреции катехоламинов хромаффинными клетками мозгового слоя надпочечников [10; 11]. Таким образом, изменения в надпочечниках под влиянием гипертиреоза соответствовали изменениям при активации стресс-реализующих систем [3; 6; 12].
В отличие от весовых коэффициентов надпочечников, другие показатели могли демонстрировать весьма значительную вариабельность. Так, в контрольной группе к числу высоковариабельных показателей с коэффициентом вариации более 40% относились весовой коэффициент тимуса и соотношение масс тимуса и надпочечников, а в основной группе – весовой коэффициент селезенки. Для указанных показателей при анализе соответствующих вариационных рядов было обнаружено четкое разделение животных на две подгруппы, в каждой из которых рассматриваемые показатели имели близкие значения с коэффициентом вариации от 4,1 до 17,8%, статистически значимо отличавшиеся от значений показателей в другой подгруппе. Это указывало на существование в группах не менее двух «кластеров» животных, отличавшихся характеристиками адаптационного статуса. Разделение животных на подгруппы для разных показателей могло отличаться, поэтому для обозначения подгрупп использовали двойную нумерацию, в которой вторая цифра соответствовала рассматриваемому показателю. Так, при анализе весового коэффициента тимуса в контрольной группе рассматривались подгруппы 1.1 и 2.1, при анализе соотношения масс тимуса и надпочечников – подгруппы 1.2 и 2.2, в основной группе по значениям весового коэффициента селезенки были выделены подгруппы 1.3 и 2.3.
В подгруппах животных 1.1 и 2.1 медианы весового коэффициента тимуса различались в 2,7 раза, а коэффициенты вариации были менее 15%, тогда как в целом по группе вариабельность показателя приближалось к 60%. При этом медиана весового коэффициента тимуса в подгруппе 1.1 превышала этот показатель в основной группе в целом более чем в 2,7 раза (p <0,05, табл. 4). Медиана отношения массы тимуса к массе надпочечников у животных подгруппы 1.2 была почти в 3 раза больше, чем у крыс подгруппы 2.2 и животных основной группы в целом (p <0,01, табл. 4). При этом вариабельность показателя, превышавшая 48% в контрольной группе в целом, резко снижалась в выделенных подгруппах, особенно значительно в подгруппе 2.2, где она была менее 5%. Аналогичным образом высокая вариабельность весового коэффициента селезенки в основной группе крыс-опухоленосителей (Cv 40,1%) резко снижалась в обеих выделенных подгруппах, 1.3 и 2.3, демонстрировавших чрезвычайно низкие значения коэффициента вариации, не превышавшие 4,5% (табл. 4). При этом для крыс подгруппы 1.3 была характерна спленомегалия, не наблюдавшаяся в контрольной группе (p <0,01). Она могла быть обусловлена застоем спленопортальной циркуляции за счет повышения свертываемости крови и развития тромбозов [12; 13], характерных для организма при опухолевом процессе [14].
Таким образом, в контрольной группе имелись животные с признаками заметно менее выраженных системных нарушений, чем у крыс основной группы. Влияние гипертиреоза проявилось в ухудшении гематологических показателей характера и напряженности АР, усилении гипертрофии надпочечников и признаков гипоплазии тимуса, а также в развитии выраженной спленомегалии у половины животных.
Заключение. Полученные результаты свидетельствуют об ухудшении адаптационного статуса крыс-опухоленосителей под влиянием гипертиреоза, связанном с усугублением негативных изменений в органах иммунной и эндокринной систем, характерных для злокачественного процесса. Это приводило к снижению противоопухолевой резистентности и уменьшению продолжительности жизни животных.
Библиографическая ссылка
Жукова Г.В., Каплиева И.В., Франциянц Е.М., Нескубина И.В., Трепитаки Л.К., Васильева Е.О., Шихлярова А.И., Бандовкина В.А., Черярина Н.Д., Гусарева М.А., Меньшенина А.П., Черкасова А.А., Давыдова М.Д. ИЗМЕНЕНИЕ АДАПТАЦИОННОГО СТАТУСА ПРИ СОЧЕТАНИИ ГИПЕРТИРЕОЗА И ЗЛОКАЧЕСТВЕННОГО ПРОЦЕССА В ЭКСПЕРИМЕНТЕ // Современные проблемы науки и образования. 2025. № 1. ;URL: https://science-education.ru/ru/article/view?id=33796 (дата обращения: 27.01.2026).
DOI: https://doi.org/10.17513/spno.33796



