Современная онкология достигла значительных успехов в лечении колоректального рака [1–3], а лучевая терапия давно входит в состав комбинированного лечения рака прямой кишки [4, 5]. Многие исследования доказывают важную роль предоперационной лучевой терапии в комплексном лечении рака прямой кишки. Так, в США с 2004 по 2011 гг. доля больных, получивших неоадъювантную лучевую терапию, повысилась с 57% до 75%, а доля больных, получивших послеоперационную лучевую терапию, наоборот, снизилась с 39% до 18% [6, 7]. Такие же тенденции отмечены в странах Европы и в России.
По данным авторов, применение предоперационной лучевой терапии приводит к снижению в 2 раза 5-летней частоты безрецидивной выживаемости при раке прямой кишки – с 10,9% до 5,6% [8–10]. В последнее время установлено, что основным прогностическим признаком эффективности лучевой терапии при злокачественных опухолях является степень регресса опухоли. Так, 3-летняя безрецидивная выживаемость при Dworak 4 составляет 95%, при Dworak 3 – 82%, при Dworak 2 – 64%, а при Dworak 1 – лишь 53% [11]. Достижения фундаментальной онкологии последних лет позволяют оценить степень регресса опухоли как на тканевом и клеточном уровнях, так и на молекулярном.
Цель исследования: выявление молекулярно-морфологических эффектов периоперационной лучевой терапии при раке прямой кишки.
Материал и методы исследования. Нами были проанализированы данные о 45 пациентах с раком прямой кишки T3-4N0-1M0, которым было проведено лечение в условиях клиники ФГБУ «Национальный медицинский исследовательский центр онкологии» МЗ РФ. У всех больных опухоль характеризовалась как аденокарцинома (чаще встречалась умеренно дифференцированная (75%)). В основную группу вошли 20 пациентов, которым был проведен курс неоадъювантной лучевой терапии на опухоль, а также на пути метастазирования (19 сеансов 5 раз в неделю с разовой очаговой дозой 2,4 Гр до суммарной очаговой дозы 50 изоГр). В дни проведения терапии осуществлялась радиомодификация капецитабином 1600 мг2/сутки. Спустя 7–8 недель после лучевой терапии проводилось хирургическое лечение. Контрольная группа – 25 больных, которые имели противопоказания к лучевой терапии на первом этапе, а также отказались от лечения. Послеоперационный материал опухоли отправлялся на патоморфологическое исследование. Степень лечебного патоморфоза опухоли определялась по Г.А. Лавниковой. Для анализа ДНК в ткани использовали CycleTESTTMPLUS DNA ReagentKit (кат. № 340242, BectonDickinson). Полученные данные были статистически обработаны с помощью программы ModFit LT. Данная программа позволяет анализировать плоидность и распределение клеток опухоли по фазам клеточного цикла. Также вычислялся процент клеток с различным содержанием ДНК. Индекс пролиферации (ИП) мы определяли как суммарное число клеток опухоли, находящихся в S- и (G2+М)-фазах клеточного цикла. При обработке данных использовался t-критерий Стьюдента.
Результаты исследования и их обсуждение. Результаты морфологического исследования показали, что изменения в опухолях после лучевой терапии характеризовались развитием деструктивных очагов. В основной группе площадь некроза составила 36,4±4,2%, а признаки необратимых форм дистрофии варьировались от 24% до 68%. В нашем исследовании не был выявлен лечебный патоморфоз I и IV степени, II степени определялся у 25% больных, III степени – у 70% пациентов. Он проявлялся отсутствием опухолевых клеток, выраженным фиброзом и гиалинозом соединительной ткани, наличием очаговых кальцинатов и гигантских многоядерных клеток типа инородных тел. Посредством использования проточной цитометрии были изучены количество ДНК в опухолевых клетках, а также их распределение по фазам клеточного цикла и пролиферативная активность опухолевой ткани под влиянием курса неоадъювантной лучевой терапии. На сегодняшний день доказано, что содержание ДНК в нормальной клетке непостоянно. Известным является и то, что опухоль гетерогенна. Рост опухоли обеспечивается активно пролиферирующей фракцией клеток. Менее чувствительны к радиационному действию клетки в фазе синтеза (S) и пресинтетической фазе (G1), а наиболее чувствительны – в фазе митоза (М) и премитоза (G2).
Действие препаратов различно: так, многие алкилирующие препараты действуют на клетки в синтетической фазе, фазе премитоза, цитостатики растительного происхождения – в фазе митоза, ингибиторы синтеза белка – в пресинтетической фазе и фазе премитоза, а действие препаратов группы антиметаболитов отмечается в синтетической и пресинтетической фазах. Изучение ДНК-цитометрических параметров ректальных опухолей под влиянием лучевой терапии выявило преобладание анеуплоидных опухолей, доля которых составила 60%, а диплоидных – 40%. Доля опухолей с индексом ДНК свыше 1,5 составила 16,7%. В контрольной группе доля анеуплоидных опухолей составила 64%. Большинство опухолей гетерогенны, т.е. они содержат как анеуплоидные, так и диплоидные клетки. Основным фактором, определяющим биологическое поведение опухоли, является характеристика среднего содержания анеуплоидных клеток в опухоли. Проведя анализ, мы не выявили достоверных различий в содержании анеуплоидных клеток в опухоли (51,9±4,7% и 51,4±5,3% соответственно). Анеуплоидия не только связана с изменением содержания ДНК в клетках, но и сопряжена с изменением в геноме. Для ее характеристики используется индекс ДНК, который характеризуется отношением интенсивности флуоресценции пика анеуплоидных клеток к диплоидному. Результаты анализа индекса в группах показали, что опухолей с индексом ДНК менее 1,0 не встречались, он находился в диапазоне от 1,1 до 1,9.
Средний показатель в контрольной группе составил 1,5±0,08, а в основной – 1,2±0,07. Также в основной группе опухоли с индексом больше 1,5 определялись лишь в 16,7% случаев (р<0,05).
В таблице 1 отражено распределение опухолевых клеток в зависимости от фаз клеточного цикла. Мы установили, что в основной группе значительная масса опухолевых клеток находилась в G0/1-фазе клеточного цикла – 86,2±3,7%, в G2+M-фазе – 2,7±0,6%. Скорость пролиферации клеток составила 11,2±3,2%, в то время как пролиферативная активность – 13,5±3,2%. В контрольной группе наблюдалось примерно такое же распределение: наибольшая доля клеток находилась в G0/1-фазе – 87,96±2,18%, в S-фазе – 9,98±1,6%, а доля клеток в G2+M-фазе – 2,12±0,4%.
Таблица 1
Распределение клеток по фазам клеточного цикла (%)
|
Группы |
G0/G1-фаза |
G2+M |
S-фаза |
|
Основная группа |
86,2±3,7 |
2,7±0,6 |
11,2±3,2 |
|
Контрольная группа |
87,96±2,18 |
2,12±0,4 |
9,98±1,6 |
Анализ пролиферативной активности показал практически одинаковое значение индекса в обеих группах больных: 13,5±3,2% и 12,1±1,4% соответственно. Нами также был проведен анализ соотношения клеток диплоидных и анеуплоидных опухолей, результат которого представлен в таблице 2.
Таблица 2
Соотношение клеток по фазам клеточного цикла диплоидных и анеуплоидных опухолей толстой кишки (%)
|
Тип опухоли |
G0/G1-фаза |
G2+M-фаза |
S-фаза |
Индекс пролиферации |
|
Диплоидные |
86,3±4,3 |
0,11±0,008 ↓* |
13,7±4,3 |
14,4±3,4 |
|
Анеуплоидные |
86,2±5 |
3,5±0,9 |
10,4±2,1 |
13,9±3,4 |
Примечания: * – отличия показателей достоверны по отношению к анеуплоидным опухолям (p≤0,05).
При диплоидных и анеуплоидных опухолях прямой кишки определяется преобладание клеток, которые находятся в G0/1-фазе клеточного цикла. В ходе работы нами выявлены достоверно значимые отличия диплоидных опухолей от анеуплоидных (p≤0,05): в 32 раза ниже доля клеток в М-фазе и в G2-фазе при диплоидных опухолях.
Скорость пролиферации диплоидных опухолей превышала подобный показатель анеуплоидных.
Индекс пролиферации (как диплоидных, так и анеуплоидных опухолей) был на равном уровне.
На рисунках 1–4 представлены гистограммы соотношения опухолевых клеток в исследуемых группах.
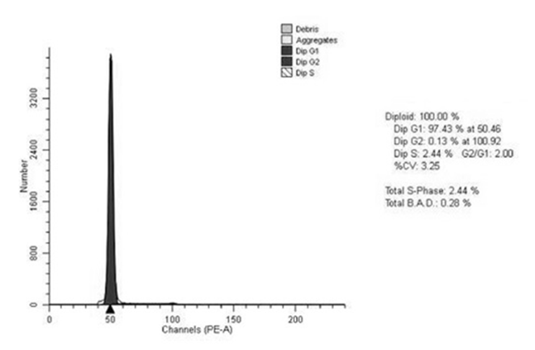
Рис. 1. Гистограмма распределения клеток по фазам клеточного цикла диплоидной опухоли прямой кишки основной группы. Больная М., 62 года, гистологически – G2 аденокарцинома
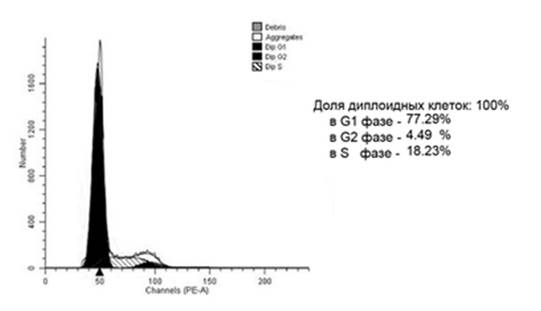
Рис. 2. Гистограмма распределения клеток по фазам клеточного цикла диплоидной опухоли прямой кишки контрольной группы. Больной М., 61 года, гистологически – G2 аденокарцинома
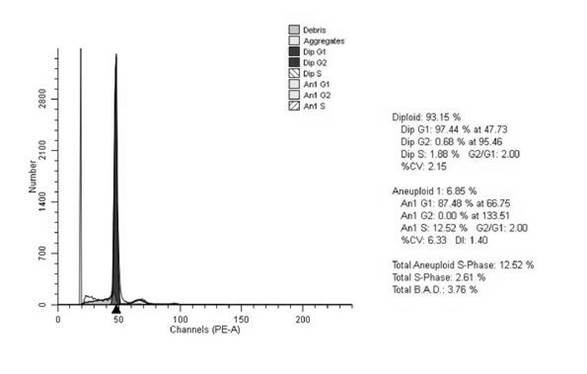
Рис. 3. Гистограмма распределения клеток анеуплоидной опухоли прямой кишки основной группы по фазам клеточного цикла. Больной К., 55 лет, гистологически – G2 аденокарцинома
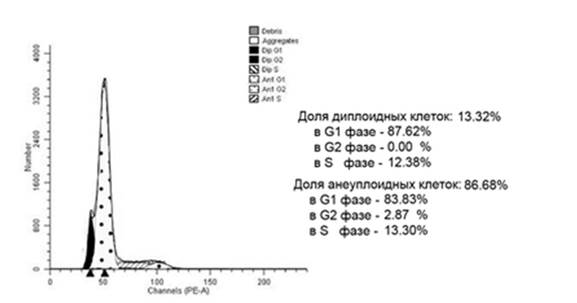
Рис. 4. Гистограмма распределения клеток анеуплоидной опухоли прямой кишки контрольной группы по фазам клеточного цикла. Больная Ш., 47 лет, гистологически – G2 аденокарцинома
Исходя из того фактора, что основной целью проведения предоперационной лучевой терапии при колоректальном раке является в первую очередь уменьшение размеров первичной опухоли, нами также была осуществлена и оценка клинической эффективности проводимой лучевой терапии (табл. 3).
Было выявлено, что в группе больных, которым проводилась пролонгированная лучевая терапия, опухоль уменьшилась с 6,8±0,6 см до 4,5±0,5 см (р<0,05), а расстояние от ануса до нижнего края опухоли увеличилось с 6,3±0,6 см до 7,6±0,6 см (р<0,05).
Таблица 3
Характеристика опухоли прямой кишки после курса лучевой терапии
|
Характеристики опухоли |
Основная группа |
Контрольная группа |
|
Протяженность опухоли: до после |
6,8±0,6 см 4,5±0,5 см* |
6,0±0,9 см |
|
Расстояние от ануса до опухоли: до после |
6,3±0,6 см 7,6±0,6 см* |
7,8±0,8 см |
Примечание: * – различия в группе достоверны (р<0,05).
Итак, нами выявлен клинико-морфологический эффект проведения предоперационной пролонгированной лучевой терапии при раке прямой кишки. Так, клиническая эффективность терапии проявлялась уменьшением протяженности опухоли прямой кишки в 1,5 раза и увеличением расстояния от ануса до нижнего края опухоли в 1,2 раза (р<0,05). Морфологически эти данные были подтверждены развитием лечебного патоморфоза III степени у 70% больных. Исследование на более тонком, молекулярном уровне выявило значительные изменения содержания ДНК в клетках опухоли прямой кишки под влиянием лучевой терапии: преобладание в 1,5 раза опухолей с индексом ДНК до 1,5 и снижение в 2,6 раза опухолей с индексом ДНК свыше 1,5 в основной группе больных. Также достоверно выявлено снижение индекса ДНК с 1,5±0,08 в контрольной группе до 1,2±0,07 в основной группе (p≤0,05). Достоверно значимых различий по доле клеток в различных фазах клеточного цикла в опухолях основной и контрольной групп нами выявлено не было. Тем не менее проведение лучевой терапии привело к достоверно значимым отличиям диплоидных опухолей от анеуплоидных по доле клеток в фазе митоза (М) и премитотической (G2) клеточного цикла, которых при диплоидных опухолях выявлено в 32 раза меньше, чем при анеуплоидных (p≤0,05). Проведение предоперационной лучевой терапии при раке прямой кишки в основной группе больных не выявило достоверно значимых отличий по доле анеуплоидных опухолей и среднему содержанию анеуплоидных клеток в опухоли в сравнении с контрольной группой. Для анеуплоидных опухолей основной и контрольной групп характерным оказалось отсутствие опухолей с индексом ДНК до 1,0. Полученные нами данные свидетельствуют о том, что через 6–8 недель после проведения пролонгированной лучевой терапии наблюдается выраженный клинико-морфологический эффект, а изменения на молекулярном уровне в этот срок по многим параметрам уже соответствуют необлученной опухоли. Следовательно, превышение периода между окончанием курса лучевой терапии и оперативным вмешательством может привести к возобновлению роста опухоли и нивелированию эффекта неоадъювантной терапии. Этот факт следует учитывать при планировании комбинированного лечения у больных раком прямой кишки.
Выводы
1. Снижение потенциала злокачественности рака прямой кишки стало главным молекулярно-морфологическим эффектом периоперационной лучевой терапии. Он проявился в лечебном патоморфозе III степени (70%), а также в увеличении частоты опухолей с индексом ДНК до 1,5 в 1,5 раза.
2. Клиническая эффективность предоперационной лучевой терапии проявлялась в уменьшении протяженности опухоли прямой кишки в 1,5 раза, а также в увеличении расстояния от ануса до нижнего края опухоли в 1,2 раза (р<0,05).
Библиографическая ссылка
Новикова И.А., Дженкова Е.А., Шапошников А.В., Гусарева М.А., Харагезов Д.А., Дурицкий М.Н., Дашков А.В., Колесников В.Е., Снежко А.В., Каймакчи Д.О., Мирзоян Э.А., Полуэктов С.И., Донцов В.А., Статешный О.Н. МОЛЕКУЛЯРНО-МОРФОЛОГИЧЕСКИЕ ЭФФЕКТЫ ПРОЛОНГИРОВАННОЙ ЛУЧЕВОЙ ТЕРАПИИ ПРИ РАКЕ ПРЯМОЙ КИШКИ // Современные проблемы науки и образования. 2020. № 2. ;URL: https://science-education.ru/ru/article/view?id=29685 (дата обращения: 18.02.2026).
DOI: https://doi.org/10.17513/spno.29685



