Но-шпалгин – комбинированное лекарственное средство (ЛС) анальгезирующего действия, содержащее парацетамол, дротаверина гидрохлорид (ДГ) и кодеина фосфат (КФ) [5]. В ранее проведенных нами исследованиях установлены оптимальные условия идентификации компонентов препарата Но-шпалгин, а также продуктов их биодеструкции в культуральных жидкостях родококков методом тонкослойной хроматографии [2]. Сведения о возможности количественного определения компонентов исследуемого препарата и продуктов их биодеструкции в культуральных жидкостях микроорганизмов методом высокоэффективной жидкостной хроматографии (ВЭЖХ) отсутствуют.
Цель настоящего исследования
Разработать условия количественного определения компонентов препарата Но-шпалгин в присутствии продуктов их биодеструкции в культуральных жидкостях родококков методом ВЭЖХ.
Материалы и методы исследования
В работе использовали таблетки Но-шпалгин массой 0,65 г (ЗАО «Хиноин», Будапешт, Венгрия) состава: парацетамола 500 мг, дротаверина гидрохлорида 40 мг, кодеина фосфата (в форме гемигидрата) 8 мг и 10% вспомогательных веществ (кислота аскорбиновая, железа оксид желтый (E172), повидон, магния стеарат, кросповидон, тальк, крахмал кукурузный, карбоксиметилцеллюлоза).
Биодеструкцию исследуемого ЛС проводили в условиях периодического культивирования (160 об/мин, 28оС) в колбах Эрленмейера, содержащих 100 мл минеральной среды RS [4], в течение 90 суток. Перед внесением в среду RS таблетки измельчали. Во избежание фотоинициированного окисления ДГ содержимое колб защищали от действия света с помощью светонепроницаемого материала. В качестве штаммов-биодеструкторов использовали Rhodococcus erythropolis ИЭГМ 767 и Rhodococcus rhodochrous ИЭГМ 647 из Региональной профилированной коллекции алканотрофных микроорганизмов (официальный акроним коллекции ИЭГМ, номер во Всемирной федерации коллекции культур 768) [7]. Ранее было показано, что штамм R. erythropolis ИЭГМ 767 является наиболее эффективным катализатором процесса биодеструкции парацетамола [1], а штамм R. rhodochrous ИЭГМ 647 наиболее резистентен к дротаверину и кодеину [6, 9]. Бактериальные клетки используемых в работе штаммов вносили в минеральную среду RS, содержащую Но-шпалгин, в виде инокулята (107 клеток/мл). Поскольку при одновременном внесении данных штаммов происходит взаимное ингибирование их каталитической активности, а также адсорбция дротаверина на осадке образующихся продуктов разложения парацетамола, то процесс биодеструкции Но-шпалгина инициировали внесением клеток R. rhodochrous 647 с последующим добавлением (через 15 суток) клеток R. erythropolis ИЭГМ 767.
Пробоподготовку культуральных жидкостей (2 мл), отобранных на 30-е сутки процесса биодеструкции Но-шпалгина, осуществляли посредством центрифугирования при 10000 об/мин в течение 5 мин («Mini Spin», Германия). Супернатант фильтровали через мембранный фильтр (Agilent Technologies, США) с диаметром пор 0,2 мкм.
В качестве контролей использовали (1) стерильный раствор Но-шпалгина в минеральной среде RS (абиотической контроль); (2) стерильный раствор Но-шпалгина в минеральной среде RS с инактивированными клетками родококков (для оценки степени адсорбции компонентов на инактивированных бактериальных клетках (120оС, 20 мин); (3) минеральную среду RS с клетками родококков без ЛС (биотический контроль).
В качестве модельной смеси использовали метанольный раствор, содержащий парацетамол (5 мг/мл), КФ (0,08 мг/мл) и ДГ (0,4 мг/мл). В качестве свидетелей продуктов биодеструкции Но-шпалгина применяли растворы п-аминофенола, гидрохинона, бензохинона и пирокатехина (Merck, Германия) в абсолютном метиловом спирте с концентрацией 50 мкг/мл. Другие химические реагенты (х.ч., ч.д.а., о.с.ч.) были получены от отечественных фирм–производителей. Количественное определение содержания компонентов исследуемого ЛС в культуральных жидкостях родококков проводили методом абсолютной калибровки. Ввиду большой продолжительности лабораторных экспериментов полученные значения корректировали с учетом поправки на испарение воды с помощью уравнений, приведенных в работе Gauthier et al. [8].
Хроматографический анализ проводили с использованием хроматографа «Shimadzu LC Prominence» (Shimadzu, Япония), оборудованного колонкой из нержавеющей стали Luna 5u С 18 100А 250×4,6 мм, предколонкой Discovery® 2 см × 4,00 мм, в комплектации с насосом LC-20AD (рабочее давление до 20 Мпа), диодно-матричным детектором SPD-M20A, автодозатором SIL-20A/20AC и колоночным термостатом CTO-20A/20AC. Для управления системами хроматографа и получаемыми данными использовали программное обеспечение LC solution. Хроматографирование проводили в изократическом и градиентном режимах со скоростью потока элюента 1 мл/мин. В изократическом режиме в качестве подвижных фаз использовали ацетонитрил в смеси с бидистиллированной водой, а также фосфатными буферными растворами (рН 3 и рН 7) [3] в соотношениях, представленных в таблице 1.
Таблица 1
Подвижные фазы, использованные для хроматографирования компонентов модельной смеси в изократическом режиме элюирования
|
Ацетонитрил: фосфатный буферный раствор (рН 3), % |
Ацетонитрил: фосфатный буферный раствор (рН 7), % |
Ацетонитрил: вода, % |
|
50 : 50 |
50 : 50 |
50 : 50 |
|
30 : 70 |
40 : 60 |
40 : 60 |
|
20 : 80 |
30 : 70 |
35 : 65 |
Результаты исследования и их обсуждение
Установлено, что в условиях изократического режима элюирования компонентов модельной смеси, содержащей парацетамол, КФ и ДГ, пики исследуемых веществ имели асимметричную форму. Кроме того, не наблюдалось полного разделения пиков парацетамола и кодеина. Варьирование количества ацетонитрила в составе подвижной фазы также не позволило получить пики исследуемых веществ симметричной формы с пригодным для анализа временем удерживания. Поэтому для эффективного разделения компонентов модельной смеси применили градиентный режим элюирования. Установлено, что оптимальным является градиент с использованием подвижной фазы состава ацетонитрил –фосфатный буферный раствор (рН 3) при скорости потока элюента 1 мл/мин. Условия подачи подвижной фазы: с 0 до 7 мин – содержание ацетонитрила 10%, с 7 до 12,50 мин – увеличение концентрации ацетонитрила до 90%, к 13,50 мин – увеличение концентрации ацетонитрила до 95%, с 13,50 до 14,60 мин – изократический участок, с 14,61 мин – содержание ацетонитрила 10%.
Градиентный режим обеспечивает более полное и качественное разделение исследуемых веществ, чем изократический, а также сокращение времени их разделения до 20 мин, о чем свидетельствует хроматограмма модельной смеси, содержащей стандартные растворы парацетамола, ДГ и КФ в концентрациях, соответствующих их содержанию в препарате Но-шпалгин (рис. 1).
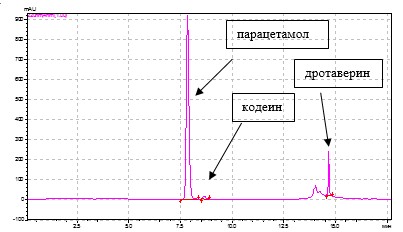
Рис. 1. Хроматограмма модельной смеси стандартных растворов парацетамола, дротаверина гидрохлорида и кодеина фосфата
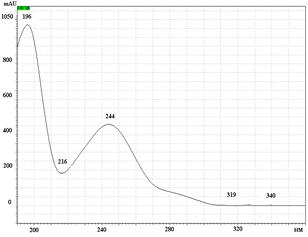 А
А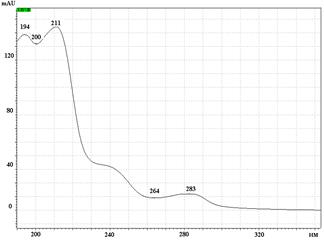 Б
Б
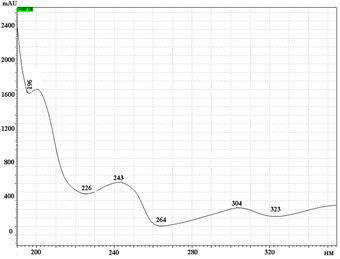 В
В
УФ спектры парацетамола, КФ и ДГ имеют максимумы поглощения при длинах волн 244 нм, 211 нм и 243 нм соответственно (рис. 2).
Рис. 2. УФ спектры парацетамола (А), кодеина фосфата (Б) и дротаверина гидрохлорида (В) в подвижной фазе: ацетонитрил – фосфатный буферный раствор (рН 3,0)
Следовательно, детектирование компонентов Но-шпалгина в культуральной жидкости родококков рационально проводить при длине волны 220 нм (кодеин) и 240 нм (парацетамол, дротаверин). Идентификацию продуктов биодеструкции (гидрохинона, пирокатехина, п-аминофенола) в соответствии с данными [4] также необходимо осуществлять при λ=220 нм, бензохинона – при λ=240 нм.
Таким образом, установлены следующие условия количественного определения ингредиентов препарата Но-шпалгин и детектирования их метаболитов методом ВЭЖХ в постферментационной среде культивирования родококков: состав элюента – ацетонитрил-фосфатный буферный раствор (рН 3); градиентный режим элюирования; скорость потока элюента – 1 мл/мин; температура колонки – 40˚С; объем вводимой пробы – 10 мкл; детектирование при длинах волн 220 нм и 240 нм. Результаты количественного определения компонентов препарата Но-шпалгин и детектирования продуктов их разложения в образцах культуральной жидкости родококков, отобранных на 30-е сутки процесса биодеструкции, с использованием градиентного варианта ВЭЖХ представлены на рисунке 3.
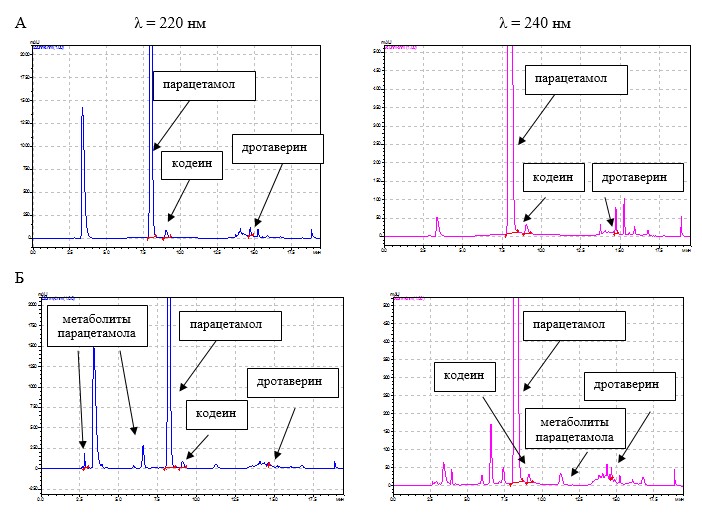
Рис. 3. Хроматограммы компонентов препарата Но-шпалгин и их метаболитов в культуральной жидкости родококков через 30 суток процесса биодеструкции.
А — абиотический контроль; Б — культуральная жидкость родококков
В таблице 2 представлены параметры идентификации компонентов препарата Но-шпалгин и продуктов их биодеструкции с использованием градиентного варианта ВЭЖХ.
Таблица 2
Параметры идентификации компонентов препарата
Но-шпалгин и продуктов их биодеструкции в культуральных жидкостях родококков
|
Название веществ |
Параметры идентификации |
|
|
Время удерживания, мин |
Длина волны, нм |
|
|
Парацетамол |
8,2 |
240 |
|
Кодеин |
9,0 |
220 |
|
Дротаверин |
14,6 |
240 |
|
Продукты биодеструкции парацетамола |
||
|
п-Аминофенол |
2,8 |
220 |
|
Гидрохинон |
6,3 |
220 |
|
п-Бензохинон |
11,3 |
240 |
|
Пирокатехин |
13,7 |
220 |
По нашим данным, на 30-е сутки процесса биодеструкции таблетированного ЛС Но-шпалгин содержание парацетамола в культуральной жидкости родококков составило 77,9%, дротаверина гидрохлорида – 21,2%, кодеина фосфата – 27,4%. В абиотическом контроле и контроле сорбции не наблюдалось снижения концентрации исследуемых веществ. Среди продуктов биодеструкции Но-шпалгина ввиду наибольшего содержания в препарате парацетамола в культуральной жидкости были детектированы в основном метаболиты данного вещества: п-аминофенол, гидрохинон, п-бензохинон и пирокатехин. Низкая степень деградации парацетамола, возможно, связана с тем, что в культуральной среде появляются продукты деградации кодеина, которые снижают каталитическую активность R. erythropolis ИЭГМ 767 .
Заключение
Разработана методика количественного определения ингредиентов комплексного лекарственного средства Но-шпалгин в присутствии продуктов их биологической деструкции в культуральных жидкостях родококков с использованием градиентного варианта ВЭЖХ.
Рецензенты:
Малкова Т.Л., д.фарм.н., зав. кафедрой токсикологической химии ГБОУ ВПО ПГФА Минздрава России, г. Пермь;
Михайловский А.Г., д.фарм.н., профессор кафедры общей и органической химии ГБОУ ВПО ПГФА Минздрава России, г. Пермь.
Библиографическая ссылка
Плотников А.Н., Тумилович Е.Ю., Вихарева Е.В., Рычкова М.И. ИСПОЛЬЗОВАНИЕ ГРАДИЕНТНОГО ВАРИАНТА ВЫСОКОЭФФЕКТИВНОЙ ЖИДКОСТНОЙ ХРОМАТОГРАФИИ ДЛЯ ОПРЕДЕЛЕНИЯ КОМПОНЕНТОВ КОМПЛЕКСНОГО ЛЕКАРСТВЕННОГО СРЕДСТВА НО-ШПАЛГИН И ПРОДУКТОВ ИХ БИОЛОГИЧЕСКОЙ ДЕСТРУКЦИИ В КУЛЬТУРАЛЬНЫХ ЖИДКОСТЯХ РОДОКОККОВ // Современные проблемы науки и образования. 2015. № 2-2. ;URL: https://science-education.ru/ru/article/view?id=21935 (дата обращения: 11.02.2026).



