Метод основан на разделении заряженных частиц компонентов сложной смеси в кварцевом капилляре (в растворе электролита) под действием электрического поля (за счёт подачи высокого напряжения к концам капилляра) [1].
Капиллярный электрофорез характеризуется экспрессностью, высокой эффективностью (более сотни тысяч теоретических тарелок), чувствительностью, что позволяет использовать малые объёмы проб (~2-10 нл). Кроме того, чувствительность метода капиллярного электрофореза с УФ-детектированием может быть существенно повышена за счёт концентрирования образца непосредственно в капилляре (приём стекинга). Концентрирование образца происходит, когда ионы аналитов пересекают границу, которая отделяет зону низкой проводимости раствора и высокой ведущего электролита. В случае более низкой проводимости пробы образца (за счёт разбавления водой или электролитом), чем у ведущего электролита, в зоне образца возникает относительно высокое электрическое поле. Аналиты внутри зоны образца движутся с более высокой скоростью и, замедляясь на границе с зоной ведущего электролита, концентрируются. Стекинг образца применяется только к заряженным аналитам.
Метод позволяет сочетать в автоматическом режиме процессы разделения исследуемой пробы на ингредиенты, их идентификацию и количественное определение при анализе одной и той же пробы с одновременным концентрированием соединения непосредственно в капилляре. Высокая селективность разделения в капиллярном электрофорезе обеспечивается за счёт рН ведущего электролита, изменения напряжения, температурного режима в системе, введения в состав буферного раствора маркеров [5-7].
Капиллярный электрофорез находит всё более широкое применение в анализе лекарственных средств, в том числе и в биологических средах [2-4].
Целью исследования явилось изучение возможности анализа доксициклина в моче капиллярным электрофорезом, с использованием отечественного прибора «Нанофор-01».
Электрофоретическое исследование доксициклина осуществляли на отечественном приборе «Нанофор-01», с использованием кварцевого капилляра (внутренний диаметр 30-80 мкм, общая длина до 1000 мм). Регистрацию компонентов проводили с помощью встроенного спектрофотометрического детектора с диапазоном длин волн 200-700 нм. Режим работы автоматический по заданной программе с непрерывным контролем текущих параметров. Запись и обработка данных производилась с использованием программного обеспечения «МультиХром-КЭФ».
Условия проведения капиллярного электрофореза доксициклина гидрохлорида
Рабочий электролит (РЭ) - боратный буферный раствор рН 10,2 имеет молярность по борной кислоте 0,15 М.
Растворитель пробы (РП) - боратный буферный раствор рН 8,0 имеет молярность по борной кислоте 0,03 М.
Рабочий стандарт (РС) - доксициклина гидрохлорид, отвечающий требованиям НД.
Подготовка капилляра - новый капилляр с внутренним диаметром 30 мкм последовательно промывали под давлением 1,5 бар: водой очищенной (3 мин), 1М-раствором хлористоводородной кислоты (3 мин), водой очищенной (3 мин), 1М-раствором натрия гидроксида (3 мин), водой очищенной (3 мин), рабочим электролитом (5 мин).
После этого проводили «холостой электрофорез» в рабочем электролите при условиях: катод со стороны детектора (нормальная полярность), напряжение 15 kV, электролит по обе стороны капилляра, время 15 мин.
При определении доксициклина в пробе с содержанием выше 0,1 мг/мл пробу растворяли в РЭ и вводили давлением в течение 15 сек, после чего проводили электрофорез при тех же условиях. Время анализа 20 мин. Полученные электрофореграммы при длинах волн 269 и 346 нм представлены на рисунках 1, 2.
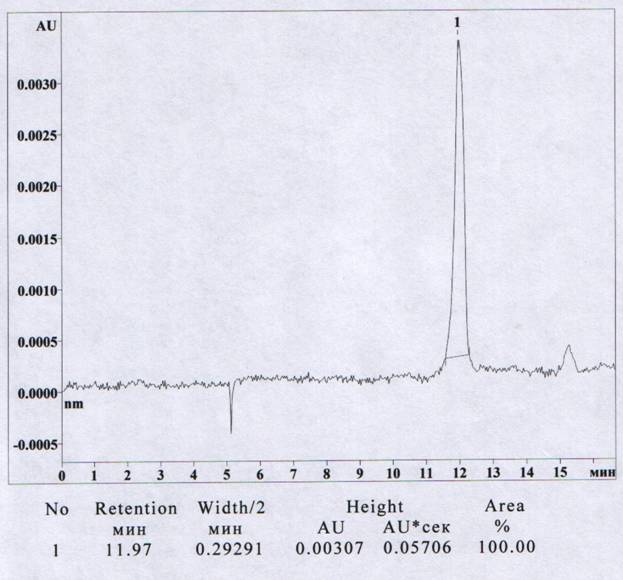
Рис. 1. Капиллярный электрофорез доксициклина (длина волны 269 нм). Доксициклин 0,1 мг/мл. Рабочий электролит - 0,15 М боратный буфер pH 10,2 по обе стороны капилляра, ввод давлением 15 сек, напряжение 15 kV, нормальная полярность, диаметр капилляра 30 мкм.
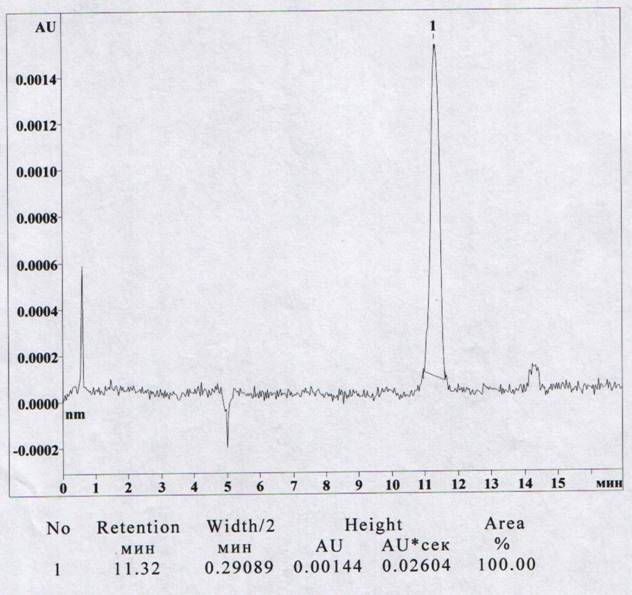
Рис. 2. Капиллярный электрофорез доксициклина (длина волны 346 нм). Доксициклин 0,1 мг/мл. Рабочий электролит - 0,15 М боратный буфер pH 10,2 по обе стороны капилляра, ввод давлением 15 сек, напряжение 15 kV, нормальная полярность, диаметр капилляра 30 мкм.
Как видно из рисунков 1, 2, уровень чувствительности обнаружения доксициклина при длине волны 346 нм значительно выше, чем при 269 нм, поэтому 346 нм избраны в качестве аналитической длины волны.
При определении доксициклина в пробе с содержанием менее 0,01 мг/мл проводили концентрирование пробы непосредственно на приборе на начальной стадии электрофоретического анализа, используя метод стекинга. Метод основан на том, что проба вводится в капилляр в буферном растворе, имеющем электропроводность в десять раз меньше, чем в РЭ (за счёт понижения ионной силы). В таком растворителе как электрофоретическая, так и электроосмотическая подвижность увеличиваются, и зона анализируемого вещества сужается. Для усиления этого эффекта нами использовано понижение значения pH буферного раствора - РП до pH 8,0 при значении pH РЭ - 10,2.
Далее обессоленная проба вводится под давлением 0,5 атм в течение 200 сек, при этом объём введённой пробы во много раз превышает предельно допустимый объём инжекции (1% от рабочей длины капилляра) при капиллярном электрофорезе. В наших условиях первоначальная проба занимает 24% от длины капилляра до окна детектора. Затем в течение 30 сек проводится электрокинетическое удаление буфера РП при обратной полярности рабочих электродов, с одновременным образованием суженной зоны на входе капилляра. Окончание процесса концентрирования фиксируется по току: в этот момент прекращается возрастание тока, и он выходит на плато. После этого полярность электродов меняется на стандартную, т.е. катод на стороне «окна» детектора, и начинается процесс электрофореза при напряжении 15 kV с детектированием элюата исследуемого вещества по поглощению при длине волны 346 нм. Электрофореграмма представлена на рисунке 3.
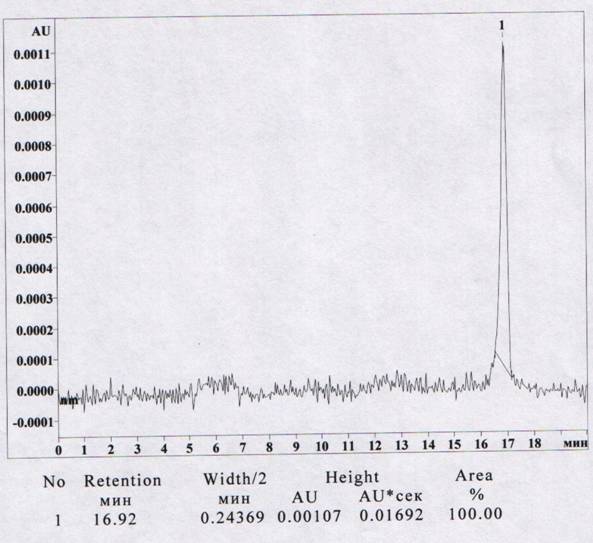
Рис. 3. Капиллярный электрофорез доксициклина (длина волны 346 нм) с использованием стекинга. Доксициклин 5 мкг/мл. РЭ - 0,15 М боратный буфер pH 10,2, буфер-РП - 0,03 М борная кислота pH 8,0, ввод давлением 200 сек, напряжение 15 kV, нормальная полярность, диаметр капилляра 30 мкм. Отгонка буфера-растворителя 30 сек при обратной полярности.
Для построения градуировочного графика количественного определения доксициклина была выбрана также длина волны детекции 346 нм как наиболее селективная и удовлетворяющая по уровню чувствительности. Линейная зависимость наблюдалась в диапазоне концентраций 10-500 мкг/мл. Градуировочный график строго линеен. Расчёт концентрации доксициклина проводили методом сравнения со стандартом по формуле:
![]() ,
,
где:
Сх - исследуемая концентрация;
Сст - концентрация стандарта;
AUсекх - оптическая плотность исследуемой пробы;
АUсекст - оптическая плотность стандарта.
Для оценки погрешности определения доксициклина капиллярным электрофорезом проводили пять параллельных исследований с концентрацией 100 мкг/мл в описанных выше условиях. Результаты определений представлены в таблице 1.
Таблица 1 - Статистическая обработка результатов количественного определения доксициклина капиллярным электрофорезом
|
№ п/п |
Доксициклин, мкг/мл |
AU·сек |
Определено, мкг/мл |
Метрологические характеристики |
|
1 |
100,0 |
0,02625 |
101,44 |
S= 1,36 Sx=0,61
∆
|
|
2 |
100,0 |
0,02620 |
101,26 |
|
|
3 |
100,0 |
0,02553 |
98,67 |
|
|
4 |
100,0 |
0,02552 |
98,63 |
|
|
5 |
100,0 |
0,02581 |
99,74 |
Как видно из таблицы 1, при статистической обработке данных, полученных в ходе количественного определения доксициклина, отражается вполне удовлетворительная сходимость результатов. Рассчитанное стандартное отклонение среднего результата (критерий воспроизводимости результатов измерений) находится в пределах критерия приемлемости (менее 2% по валидационной оценке). Таким образом, капиллярный электрофорез («Нанофор - 01») может быть использован для анализа доксициклина.
Изучение возможности определения доксициклина в моче капиллярным электрофорезом («Нанофор - 01»)
Инжекция пробы мочи непосредственно в капилляр не позволяет выделить пик доксициклина на фоне пиков многочисленных эндогенных компонентов. Кроме того, чувствительность фотометрического детектирования в капиллярном электрофорезе («Нанофор - 01») ограничена малой длиной оптического пути - она равна внутреннему диаметру капилляра. Поэтому, без предварительного концентрирования пробы, в спектральной области селективного поглощения доксициклина (346 нм) удаётся уверенно фиксировать только концентрации порядка 100 мкг/мл и более.
Предложена экспрессная методика пробоподготовки мочи (без экстракционного концентрирования). Для чего проба последовательно фильтруется через бумажный фильтр (или через стекловолоконный микрофильтр с диаметром пор 1-2 мкм), затем через мембранный (инертный к белкам) микрофильтр с диаметром пор 0,2 мкм, после чего обессоливается и депигментируется с помощью самопроточной мини-колонки с бисерным полиакриламидным гелем «Акрилекс Р-10». В мини-колонку с объёмом слоя геля 9 мл вносят 2 мл мочи, затем она промывается буфером-РП для капиллярного электрофореза (0,03 М раствор натрия бората, pH 8,0). Первые 5 мл элюата сливают, а следующие 2,5 мл собирают и используют для отбора пробы на анализ. Весь процесс пробоподготовки занимает 10 мин, причём несколько проб мочи может обрабатываться одновременно на нескольких идентичных мини-колонках. При этом белковая фракция мочи элюируется в первых 5 мл и не используется в анализе, а большинство низкомолекулярных компонентов элюируются из мини-колонки с гелем в объёме, большем 7,5 мл. Такая пробоподготовка в сочетании с избирательным детектированием при длине волны 346 нм обеспечивает отсутствие фоновых пиков при анализе доксициклина.
Для определения чувствительности метода при анализе доксициклина в моче капиллярным электрофорезом («Нанофор-01») проводили концентрирование пробы в капилляре прибора методом стекинга и последующее электрофоретическое исследование доксициклина в приведённых выше условиях. Электрофореграмма мочи с содержанием доксициклина 5 мкг/мл представлена на рисунке 4.
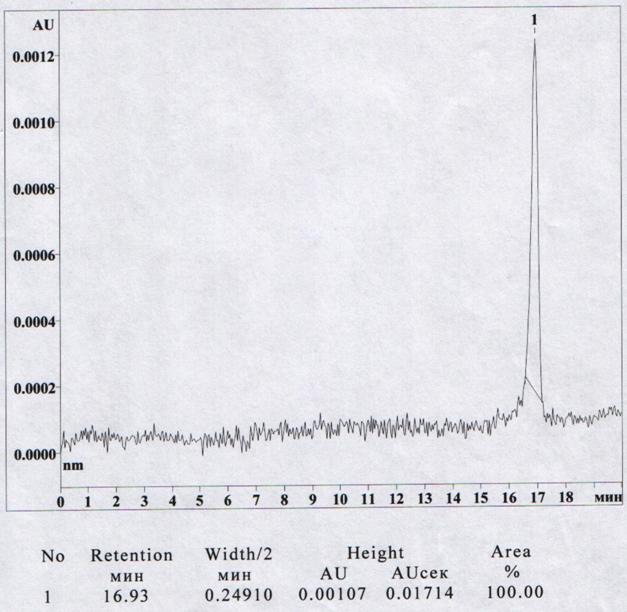
Рис. 4. Анализ доксициклина в моче капиллярным электрофорезом (длина волны 346 нм). Доксициклин 5 мкг/мл (моча). Рабочий электролит - 0,15 М боратный буфер pH 10,2, буфер-растворитель - 0,03 М борная кислота pH 8,0, ввод давлением 200 сек, напряжение 15 kV, нормальная полярность, диаметр капилляра 30 мкм. Отгонка буфера-растворителя 30 сек при обратной полярности.
Таким образом, за счёт пробоподготовки и селективного детектирования удаётся полностью устранить наложение мешающих определению доксициклина низкомолекулярных компонентов мочи, а за счёт обогащения пробы стекингом удаётся обеспечить такую концентрационную чувствительность, при которой доксициклин надёжно определяется при концентрациях меньше 5 мкг/мл, что значительно ниже терапевтического уровня.
Выводы
- Процедура пробоподготовки мочи для анализа на доксициклин заключается в последовательном фильтровании пробы через бумажный или стекловолоконный микрофильтр, затем через мембранный (инертный к белкам) микрофильтр с диаметром пор 0,2 мкм. После чего проба депигментируется через самопроточную мини-колонку «Акрилекс Р-10».
- Безэкстракционная пробоподготовка в сочетании с избирательным УФ-детектированием при длине волны 346 нм позволяет полностью устранить наложение пиков, мешающих определению доксициклина, низкомолекулярных компонентов мочи.
- За счет использования приема обогащения пробы стекингом удается обеспечить такую концентрационную чувствительность, при которой доксициклин надежно определяется при концентрации менее 5 мкг/мл (ниже терапевтического уровня).
Рецензенты
Михалев А.И., д.фарм.н., профессор, зав. кафедрой биологической химии, ГБОУ ВПО «ПГФА» Минздравсоцразвития, г. Пермь.
Ярыгина Т.И., д.фарм.н., профессор кафедры фармацевтической химии очного факультета, ГБОУ ВПО «ПГФА» Минздравсоцразвития, г. Пермь.
Библиографическая ссылка
Фомин А.Н., Хомов Ю.А. ЭКСПРЕССНЫЙ ВАРИАНТ ОПРЕДЕЛЕНИЯ ДОКСИЦИКЛИНА В МОЧЕ МЕТОДОМ КАПИЛЛЯРНОГО ЭЛЕКТРОФОРЕЗА // Современные проблемы науки и образования. 2012. № 4. ;URL: https://science-education.ru/ru/article/view?id=6464 (дата обращения: 02.07.2025).



