Несмотря на имеющиеся успехи и прогресс в онкологии, среди пациентов, получавших хирургическое и комплексное лечение рака пищевода, примерно у 4-29% больных развиваются локорегионарные рецидивы заболевания в различные сроки, у 21-49% пациентов - прогрессирование в виде регионарных лимфогенных и отдаленных метастазов [1; 2]. Основным клиническим проявлением опухолевого поражения верхних отделов ЖКТ является дисфагия, и именно восстановление энтерального питания является первостепенной задачей у данной категории больных [3-5]. Однако большинство паллиативных эндоскопических методик восстанавливают проходимость пищевода на срок от нескольких дней до месяца. Использование способов эндоскопической реканализации без эндопротезирования (аргоно-плазменная реканализация, бужирование) уже на первой недели после выполнения манипуляции приводит к рецидиву дисфагии у 70% пациентов, а также связано с возникновением кровотечений при ненадлежащем выполнении процедуры в 1,5- 23,7% случаев [6-8]. В то же время эффективность применения аргоно-плазменной коагуляции в реканализации стенозирующих опухолей пищевода остается неудовлетворительной, показатели смертности в течение 30 дней после манипуляции составляют 33,3% [9; 10]. Учитывая опыт различных авторов, использование стентов рекомендуется у пациентов, ожидаемая продолжительность жизни которых не будет превышать 4 мес. [10; 11]. Кроме того, стентирование пищевода несет за собой большое количество осложнений (кровотечение во время постановки стента - 5,7% больных, миграция стента - 10%, рестеноз опухоли - 8-57% случаев [10-12]. Таким образом, вопрос о безопасном и эффективном использовании эндоскопических методик в реканализации опухолевых стенозов остается дискутабельным и требующим поиска новых путей решения.
Цель исследования: продемонстрировать эффективность методик внутрипросветной эндоскопической фотодинамической терапии и АПК-реканализации в восстановлении проходимости пищевода при стриктурах опухолевого генеза у больных местными рецидивами эзофагеальной карциномы.
Материалы и методы исследования. В исследование включены 30 больных эзофагеальными карциномами, которым за период с 2013 по 2018 г. выполнены лечебные сеансы эндоскопической внутрипросветной реканализации пищевода по поводу местного рецидива рака. Всем больным в разные сроки выполнена резекция пищевода с двухуровневой (диссекция регионарных лимфоколлекторов грудной и брюшной полостей) лимфодиссекцией, эзофагопластикой желудочным 28 (93,3%) и тонкокишечным 2 (6,7%) трансплантатом, формированием инвагинационного анастомоза по К.Н. Цацаниди. Внутрипросветные воздействия проводили между циклами системной химиотерапии в терапевтическом режиме FLOT (оксалоплатин, натрия лефофолинат, 5-фторурацил, доцетаксел), которые получали все пациенты. Главным клиническим симптомом локорегиональной прогрессии заболевания являлась выраженная дисфагия. Основную группу составили 11 больных (36,6%), получивших сеансы деструкции опухолевых тканей методом внутрипросветной фотодинамической терапии (ФДТ). Средний возраст в основной группе 59,0 ± 1,2 года, средний безрецидивный период составил 14,3 месяца (рис. 1). Контрольную группу составили 19 (63,4%) пациентов, которым выполнялись сеансы аргоно-плазменной реканализации (АПР) опухолевого стеноза пищевода. Средний возраст в контрольной группе составил 62,6 ± 1,7 года, средний безрецидивный период – 15,6 месяца (рис. 1).


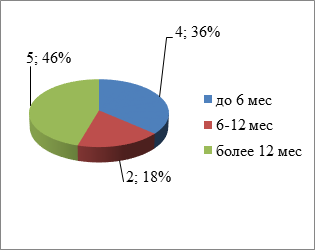
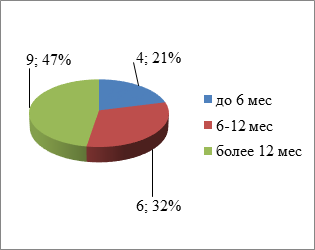
Рис. 1. Распределение больных по времени жизни без рецидива РП:
А – в основной группе ФДТ; Б – в контрольной группе АПР
В группе ФДТ наиболее часто встречались опухоли средней трети пищевода и зоны кардиоэзофагеального перехода – по 5 (45,5%) пациентов, а поражение нижней трети выявлено у 1 (9,0%). В контрольной вовлечение нижней трети отмечено у 11 (57,8%), средней трети - 4 (21,0%), верхней трети пищевода – 1 (5,3%), распространение протяженной опухоли на среднюю и нижнюю треть отмечено у 3 (15,9%) больных группы АПК-реканализации (рис. 2, 3).
Опухоли с глубиной инвазии Т3 имели место у 6 (54,5%) больных, Т4 у остальных больных 5 (45,5%) основной группы. В контрольной группе у всех больных степень глубины инвазии соответствовала Т4 (100%). В основной группе метастатическая лимфаденопатия N3 верифицирована у 5 (45,5%), N2 - 2 (18,2%), у 4 (36,3%) пациентов метастатического поражения лимфоузлов не выявлено. Степень регионального метастазирования в контрольной группе: N2 - 12 (63,1%), N3 – 7 (36,9%) (таблица). По гистологическому варианту в основной группе в большинстве случаев верифицирована низко- и умереннодифференцированная аденокарцинома – у 5 (45,5%) и 2 (18,2%) больных, а низкодифференционный плоскоклеточный рак – у 4 (36,3%) пациентов. У 3 (15,7%) из 19 пациентов контрольной группы диагностирован плоскоклеточный рак pG2-G3, а у 16 (84,3%) – умереннодифференцированная аденокарцинома.
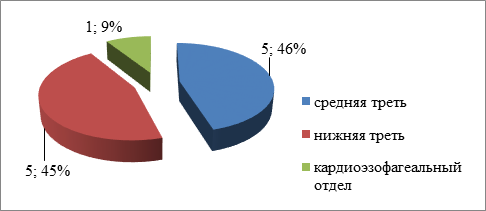
Рис. 2. Распределение пациентов основной группы по локализации опухоли
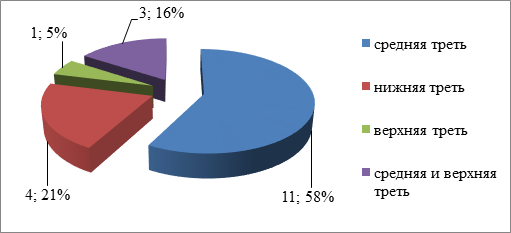
Рис. 3. Распределение пациентов контрольной группы по локализации опухоли
Стадирование опухолевого процесса у больных РП основной и контрольной групп по критериям pTNM согласно TNM 8th ed., 2017
|
Группа больных |
Т3 |
Т4 |
N0 |
N2 |
N3 |
Всего |
|
Основная |
6 (54.5%) |
5 (45.5%) |
4 (36.3%) |
2 (18.2%) |
5 (45.5%) |
11 |
|
Контрольная |
0 |
19 (100%) |
0 |
12 (63,1%) |
7 (36,9%) |
19 |


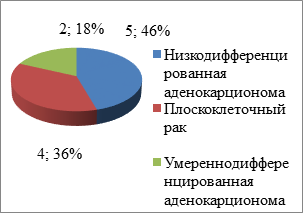
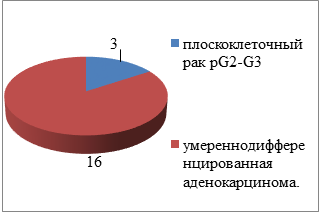
Рис. 4. Распределение пациентов по гистологическому варианту опухоли:
А – в основной группе ФДТ; Б – в контрольной группе АПР
Реканализация опухолевого стеноза осуществлялась методом внутрипросветной фотодинамической терапии. В качестве фотосенсибилизатора (ФС) применялась диметилглюкаминовая соль хлорина Е6 «Фотодитазин» (ООО «Вета-Гранд», РФ). Данный ФС хлоринового ряда второго поколения предназначен для лечения злокачественных новообразований пищевода согласно нозологической классификации (МКБ-10). Однократную инфузию ФС внутривенно капельно в дозах 1,0–1,4 мг/кг массы тела пациента проводили за 90–120 минут до вмешательства в условиях полузатененной палаты с защитой глаз темными очками. Согласно фармакокинетическим свойствам максимальная концентрация ФС в сыворотке крови достигалась через 15–30 минут и достаточно быстро снижалась. В опухоли, наоборот, максимальная концентрация ФС 10–20 мкг/мл достигалась ≈ через 1 час, при более быстром его выведении из окружающих опухоль здоровых тканей.
В качестве источника света использовался полупроводниковый лазер «Латус» (фирмы «Аткус», РФ) с длиной волны 662 ± 10 нм, площадью засвечивания 4 см2, мощностью 8 Вт, временем облучения 30 мин., суммарной световой дозой 24 ± 6 Дж / см2, плотностью мощности 20–30 мВт/см2. Гибкий световод доставлялся к опухоли по инструментальному каналу эндоскопов Gif H180, Gif Q165 фирмы Olympus.
Сеансы АПК-реканализации проводились при помощи высокочастотного генератора ERBE 300D в режиме Pulsed Coagulation, мощность 30-45 ВТ, поток аргона 2 л/мин. Гибкий зонд-электрод подводился к зоне опухолевого стеноза по инструментальному каналу эндоскопа Gif Q165 фирмы Olympus.
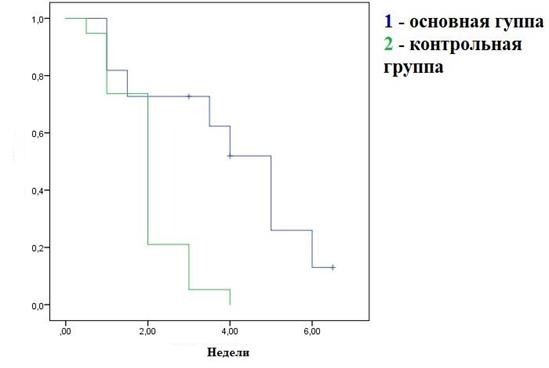
Результаты исследования и их обсуждение. В результате проведении сеансов внутрипросветной фотодинамической терапии и аргоно-плазменной реканализации пищевода у всех больных удалось достичь временного купирования дисфагии. Среднее количество сеансов составили 4,2 ± 0,8 при ФДТ и 8,3 ± 1,7 при АПК-реканализации за весь период лечения. Средний период жизни больных после воздействия внутрипросветной фотодинамической терапии до возврата клиники тяжелой дисфагии, потребовавший повторного вмешательства, составил 25,2 дня, а после сеанса АПК-реканализации – 14,1 дня при уровне значимости различий p = 0.018 по Log-Rank критерию (рис. 5). При оценке непосредственных исходов внутрипросветных вмешательств у 2 (10,5%) пациентов контрольной группы развились кровотечения из зоны опухоли, которые купированы консервативно. У пациентов основной группы осложнений и фототоксических реакций не отмечено.
|
Параметры сравнения |
Значение теста |
Уровень значимости p |
|
Log-Rank Test |
2,119 |
0,018 |
Рис. 5. Кривые времени жизни без рецидива выраженной дисфагии после внутрипросветных вмешательств у пациентов основной и контрольной групп
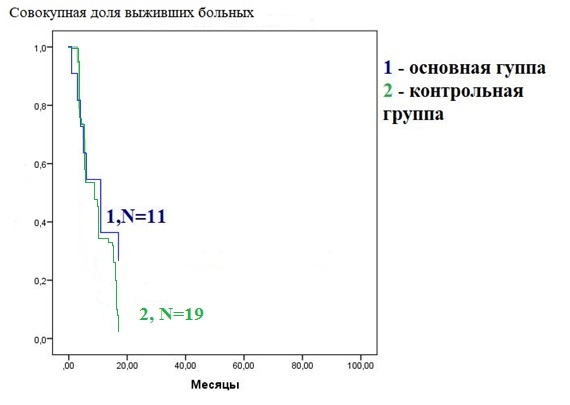
Различия показателей общей скорригированной выживаемости больных в сравниваемых группах оценивались по совокупной доле выживших больных, рассчитанной методом Каплана-Мейера, и сравнивались по логарифмическому ранговому критерию (рис. 6).
Также показаны медианы общей выживаемости больных в зависимости от применяемой методики местного противоопухолевого лечения. В группе больных, получивших ФДТ-реканализацию пищевода, составила 11,1 месяца. В группе пациентов группы АПР-воздействия 50% наблюдаемых больных прожили – 9,8 месяца.

|
Параметры сравнения |
Значение теста |
Уровень значимости p |
|
Log-Rank Test |
1,980 |
0,0678 |
Рис. 6. Кривые общей выживаемости Каплана-Мейера больных РП контрольной группы (зеленая линия) и основной группы (синяя линия)
Из рисунка 6 видно, что при сравнительном анализе общей выживаемости больных контрольной и основной групп статистически значимых различий получено не было (p = 0,068). Это свидетельствует об отсутствии значимого влияния выбора методики внутрипросветного лечения опухолевого стеноза на продолжительность жизни больных с рецидивом рака пищевода. С учетом этого целесообразность выбора того или иного метода паллиативного воздействия на опухолевый стеноз должна определяться кратностью сеансов, требующихся для обеспечения энтерального питания и качества жизни больных.
Выводы. Внутрипросветная фотодинамическая терапия является безопасным и эффективным методом восстановления проходимости пищевода при местном рецидиве эзофагеального рака, позволяет увеличить интервалы между повторными вмешательствами по поводу рецидивирующей дисфагии по сравнению с методикой АПР.
Также следует отметить, что вышеописанные противоопухолевые лечебные методики воздействия на местный рецидив рака пищевода не оказывают влияния на общую продолжительность жизни больных.
Библиографическая ссылка
Павелец К.В., Русанов Д.С., Протченков М.А., Антипова М.В., Оглоблин А.Л., Карпова Р.А., Павелец М.К., Синявская О.Л. ВОЗМОЖНОСТИ ВНУТРИПРОСВЕТНОЙ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ В РЕКАНАЛИЗАЦИИ ОПУХОЛЕВЫХ СТЕНОЗОВ ВЕРХНИХ ОТДЕЛОВ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА // Современные проблемы науки и образования. 2020. № 3. ;URL: https://science-education.ru/ru/article/view?id=29696 (дата обращения: 13.01.2026).



