Нейтрофильные гранулоциты (НГ) являются полноценными иммунокомпетентными клетками с иммунорегуляторными свойствами, способными к экспрессии генов, синтезу de novo цитокинов и образованию нейтрофильных экстрацеллюлярных сетей (Neutrophil extracellular traps – NET). Нейтрофильные гранулоциты обладают мощным микробицидным и цитотоксическим потенциалом и при определенных условиях могут влиять на исход воспалительной реакции. Известна роль нейтрофильных гранулоцитов в инициировании и развитии базисной воспалительной реакции, однако их роль в формировании бактериального и вирусного воспаления, аллергических, аутоиммунных и неопластических процессов неоднозначна. При адекватном функционировании нейтрофильных гранулоцитов инфекционный воспалительный процесс не развивается, т.е. патоген мгновенно уничтожается или происходит достаточно быстрая регрессия острого воспаления. В то же время описана дисфункция нейтрофильных гранулоцитов при различных патологических процессах. Так, при тяжелой острой бактериальной инфекции, при хронических вирусно-бактериальных воспалительных процессах зачастую имеет место дефектность функционирования нейтрофильных гранулоцитов по типу количественного или функционального дефицита. При аутоиммунных заболеваниях преобладают гиперэргические цитотоксические реакции со стороны НГ, которые могут сопровождаться значительным повреждением тканей [1–3]. Роль НГ при неопластических процессах неоднозначна. С одной стороны, они могут активно уничтожать опухолевые клетки, используя свои цитотоксические механизмы, с другой – опухоль может индуцировать в нейтрофильных гранулоцитах продукцию факторов, например онкостатина М, способствующих росту и инвазивности опухоли. Состоятельность функционирования нейтрофильных гранулоцитов обусловливает легкое течение и исход многих острых бактериальных воспалительных процессов. В то же время дисфункции нейтрофильных гранулоцитов могут играть негативную роль в развитии и формировании хронических инфекционно-воспалительных заболеваний, при аутоиммунных и неопластических процессах. В связи с этим полноценная диагностика, направленная на уточнение вида дисфункций нейтрофильных гранулоцитов (количественный и функциональный дефицит, блокада функций, гиперэргическое реагирование и т.д.), необходима для оптимизации персонализированной иммунотерапии у пациентов с тяжелыми острыми гнойными и хроническими инфекционно-воспалительными заболеваниями, аутоиммунными и неопластическими заболеваниями [4–6].
Известно, что нейтрофильные гранулоциты, являясь клетками врожденного иммунитета, осуществляют свою бактерицидную функцию тремя способами. Первым из них является фагоцитоз, открытый еще И. И. Мечниковым (1883, Нобелевская премия за 1908 год), другим важным элементом защиты от патогенов является трансмембранная дегрануляция, обеспечивающая выброс микробицидных компонентов цитоплазмы нейтрофильных гранулоцитов, и, наконец, открытая сравнительно недавно способность нейтрофильных гранулоцитов к образованию NET, которые представляют собой экстрацеллюлярные сетеподобные структуры, состоящие из нуклеиновых кислот и ферментов, секретируемых нейтрофилами в ответ на микробные и немикробные стимулы.
Анализу образования NET и факторам, стимулирующим выброс ДНК НГ во внешнюю среду, посвящено достаточно много работ [7–9]. В то же время особенности формирования NET при повреждении тканей в условиях естественного инфицирования ран и развитии различных фаз воспалительной реакции остаются совершенно не изученными. Известно, что в хирургических отделениях в процессе их функционирования постепенно формируется уникальный бактериальный «пейзаж», который при неблагоприятных условиях может влиять на течение гнойно-воспалительных процессов у пациентов и даже являться причиной внутрибольничных инфекций. В этой связи оценка функциональной активности нейтрофильных гранулоцитов непосредственно в ране представляется весьма актуальной, а изучение динамики появления NET позволяет более детально следить за развитием фаз гнойно-воспалительного процесса и прогнозировать его исход.
Целью нашей работы было изучение динамики возникновения и регрессии NET в экссудате экспериментальной раны мягких тканей и ожоговой поверхности кожи лабораторных крыс при их естественном инфицировании при отсутствии специфического лечения.
Материалы и методы исследования
Иcследование проведено на модели раневого воспалительного процесса, сформировавшегося на фоне естественного инфицирования микрофлорой окружающей среды. Эксперимент был проведен на 20 беспородных крысах-самцах, у 10 из них под местным обезболиванием (0,25%-ный раствор новокаина) была создана модель открытой раны мягких тканей спины размером 2x3 см. У 10 животных в условиях ингаляционного наркоза (препарат «Севаран») была создана модель ожога кожных покровов IIIа степени [10]. Раневые и ожоговые поверхности были подвергнуты естественному инфицированию микробной флорой, присутствующей в воздушной среде вивария. Для оценки динамики формирования NET при развитии инфекционно-воспалительного раневого процесса проводили забор раневого экссудата на 2-е, 4-е, 8-е и 11-е сутки от начала эксперимента. У животных с экспериментальными ожогами изучение раневого отделяемого проводили на 1-е, 3-и, 7-е и 14-е сутки после отхождения струпа. Дизайн эксперимента соответствовал Европейской конвенции о защите позвоночных животных, используемых дня экспериментов или иных научных целей (ЕТ8 N 123, Страсбург, 18.03.1986).
Отпечатки раневого экссудата окрашивали, применяя разработанный нами метод идентификации NЕТ, основанный на модифицированной нами реакции Фельгена выявления ДНК. При этом подсушенные на воздухе отпечатки экссудата помещали в фиксатор на 15 минут в реагент А. Для приготовления реагента А смешивали 100 мл 96° этанола и 100 мл ацетона марки ЧДА. После фиксации производили депуринизацию ДНК нейтрофильных гранулоцитов и NET, для этого помещали мазки-отпечатки в реагент Б на 40 минут при 20°С. Для приготовления реагента Б смешивали 80 мл концентрированной хлористоводородной кислоты и 120 мл дистиллированной воды, после чего производили окраску ядер нейтрофильных гранулоцитов и NET с помощью реактива для специфического выявления депуринизированной ДНК (реагент С). Для приготовления реагента С в 200 мл вскипевшей дистиллированной воды растворяли 1 г основного фуксина для фуксинсернистой кислоты, после растворения фуксина добавляли 4 г сульфита натрия марки ЧДА и 4 мл концентрированной хлористоводородной кислоты. Приготовленный раствор оставляли для созревания на одни сутки. Продолжительность обработки отпечатков экссудата составляла 60 минут. Избыток красителя отмывали трижды по 5 минут реагентом Д. Для приготовления реагента Д в 200 мл дистиллированной воды при комнатной температуре растворяли 4 г сульфита натрия и 4 мл концентрированной хлористоводородной кислоты. Дополнительную промывку осуществляли дистиллированной водой. Высушенные на воздухе отпечатки изучали в световом микроскопе с использованием апохроматических систем при общем увеличении х600 (рис. 1, 4). В отпечатках подсчитывали количество зрелых нейтрофильных гранулоцитов, имеющих сегментированное ядро, и количество NET, наблюдаемых в 10 произвольно выбранных полях зрения микроскопа. Общее число нейтрофильных гранулоцитов, регистрируемых в поле зрения микроскопа, рассчитывали как сумму нейтрофильных гранулоцитов (НГ) и NET (НГ+NET). Динамику числа NET определяли как процентное отношение числа NET к общему числу НГ [11] Результаты обрабатывали методами вариационной статистики с использованием компьютерной программы «Статистика 6».
Результаты исследования и их обсуждение
Среднее количество NET в отпечатках экссудата раневой поверхности на 2-е, 4-е, 8-е и 11-е сутки от начала эксперимента в расчете на одно поле зрения в группе животных с экспериментальным раневым инфекционно-воспалительным процессом составило 9,1±1,1; 15,1±1,4; 3±0,06; 2,±0,04 соответственно. При этом процентное отношение числа NET к общему числу зрелых нейтрофильных гранулоцитов в расчете на одно поле зрения равнялось 10,5%; 16,2%; 4,2% и 3,5% (рис. 1, 2, 3). Следует отметить, что среднее количество НГ экссудата, зарегистрированное в одном поле зрения на 2-е и 4-е сутки эксперимента, достоверно не различались между собой (р>0,05), в то время как различие в числе NET, зарегистрированное в те же сроки, было статистически значимо (р<0,001). Количество НГ и NET экссудата, зарегистрированное на 8-е и 10-е сутки эксперимента, также достоверно различались между собой.
При изучении отделяемого с ожоговой поверхности на 3-и, 7-е и 14-е сутки после отхождения струпа наличия NET зарегистрировано не было, лишь на 1-е сутки исследования в раневом отделяемом наблюдались единичные NET (рис. 4).
Таким образом, уже на 2-е сутки от начала эксперимента при естественном инфицировании раны мягких тканей значительное количество зрелых НГ проявляет способность к образованию NET, которая достигает своего максимума к 4-м суткам от начала эксперимента, после чего закономерно снижается. Полученные данные также свидетельствуют о том, что уже на 2-е сутки от начала эксперимента происходит существенное инфицирование экспериментальной раны бактериальной флорой, присутствующей в окружающей среде, что может приводить к возникновению «суперинфекции».
Начальные этапы воспалительного процесса при ожоговом повреждении тканей протекают под сформированным струпом и изучены нами начиная с 14-го дня от нанесения травмы, т.е. на 2 недели позже по сравнению с открытой раной мягких тканей (1-е сутки после отхождения струпа). Ввиду этого механизмы естественного инфицирования при этих двух видах травмы существенно различаются. Различаются «фазность» течения воспалительного процесса, сроки и скорость репаративного процесса.
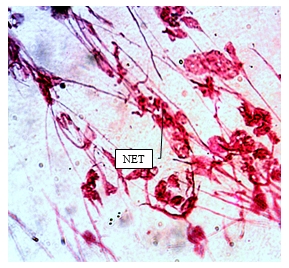
Рис. 1. NET в экссудате экспериментальной гнойной раны мягких тканей
(модификация реакции Фельгена. Ув. х900)
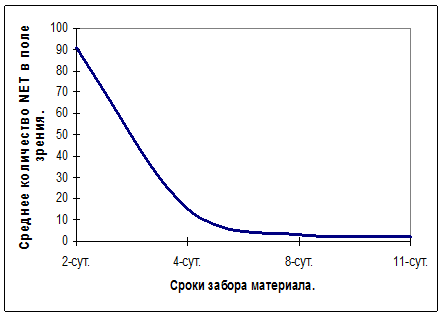
Рис. 2. Среднее количество NET в одном поле зрения экссудата животных с экспериментальным раневым инфекционно-воспалительным процессом
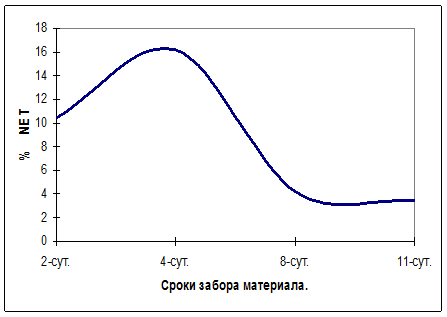
Рис. 3. Процентное отношение числа NET к общему числу зрелых нейтрофильных гранулоцитов в расчете на одно поле зрения экссудата животных с экспериментальным раневым инфекционно-воспалительным процессом
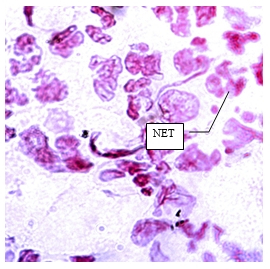
Рис. 4. NET в экссудате раневого отделяемого с экспериментальной ожоговой поверхности на 1-е сутки после отхождения струпа (модификация реакции Фельгена. Ув. х900)
Известно также, что тканевые нейтрофильные гранулоциты функционируют в составе нескольких субпопуляций, из которых далеко не все склонны к образованию NET [1]. Обнаруженные в ходе настоящего исследования особенности формирования и динамики нейтрофильных экстрацеллюлярных сетей при воспалительном процессе разной этиологии следует учитывать в клинической практике. Используя цитологический метод выявления NET, можно объективно оценить динамику заживления гнойных и ожоговых ран.
Библиографическая ссылка
Евглевский А.А., Садков Б.О. ДИНАМИКА НЕЙТРОФИЛЬНЫХ ЭКСТРАЦЕЛЛЮЛЯРНЫХ СЕТЕЙ В УСЛОВИЯХ ЭКСПЕРИМЕНТАЛЬНОЙ МОДЕЛИ ИНФЕКЦИОННО-ВОСПАЛИТЕЛЬНОГО РАНЕВОГО И ОЖОГОВОГО ПРОЦЕССА ПРИ ЕСТЕСТВЕННОЙ РЕПАРАЦИИ // Современные проблемы науки и образования. 2019. № 3. ;URL: https://science-education.ru/ru/article/view?id=28943 (дата обращения: 17.12.2025).



