До недавнего времени большинство полипов толстой кишки относились к одной из двух групп образований: гиперпластические или диспластические (аденомы тубулярные, тубуло-ворсинчатые, ворсинчатые). В 1984 году Urbanski S.J. с соавторами [1] описали полип со смешанной морфологией: зубчатая архитектура крипт, как в гиперпластическом полипе, в сочетании с дисплазией, как аденоме. В 2003 году Torlakovic E.E. с соавторами [2] пересмотрели морфологию гиперпластических полипов и выделили группу образований, характерной особенностью которой было выраженное расширение базальных отделов и горизонтальный рост крипт вдоль мышечной пластинки слизистой оболочки («зубчатая аденома/полип на широком основании»). В 2005 году Goldstein N.S. с соавторами [3] описывает ряд случаев рака толстой кишки, предшественниками которого являлись образования, сходные по строению с гиперпластическими полипами и не имевшие признаков дисплазии эпителия, что послужило включением зубчатых образований в классификацию ВОЗ в группу предопухолевых поражений толстой кишки в 2010 году и активному поиску маркеров, отражающих их потенциал злокачественности.
Зубчатые образования толстой кишки в современной классификации [4] разделены на три основные категории: гиперпластический полип (НР), зубчатая аденома/полип на широком основании (SSA/P) и традиционная зубчатая аденома (TSA). В целом тип зубчатого образования определяется его цитологическими и архитектурными особенностями. Одной из основных проблем в дифференциальной диагностике зубчатых образований толстой кишки является дифференциальный диагноз между НР и SSA/P. Несмотря на существующие сложности, патологам рекомендуется прилагать все возможные усилия для выявления SSA/P, так как их потенциал малигнизации выше, чем у НР, и в ряде исследований схож с потенциалом малигнизации классических аденом [5].
Современная гипотеза о разности потенциала злокачественности и разной частоте малигнизации «зубчатых» образований побуждает к поиску дополнительных критериев отличия различных морфологических типов полипов друг от друга. Продолжается активный поиск прогностически значимых факторов – в литературе уже описаны иммуногистохимические профили экспрессии маркеров белков плотных контактов, молекул адгезии, маркеров опухолевых стволовых клеток, маркеров пролиферативной активности и других [6].
Клаудины – семейство трансмембранных белков, относящихся к белкам плотных контактов. В плотных контактах злокачественных клеток часто наблюдаются структурные и функциональные аномалии, проявляющиеся в изменении уровня экспрессии различных типов клаудинов.
В качестве источника колоректального рака обсуждаются cancer stem cells (CSC), которые способны к самоподдержанию и мультипотентной дифференцировке и могут образовываться из мутантных стволовых клеток или путем дедифференцировки эпителиальных клеток крипты. Маркер Musashi-1 (Msi-1) рассматривается некоторыми авторами как маркер CSC в раке толстой кишки и желудка [7]. Белок CD44, являющийся молекулой адгезии, также рассматривается в качестве маркера CSC. Изменение уровня CD44 ассоциировано с плохим прогнозом, увеличением количества метастазов у пациентов с колоректальным раком [8]. Возможно, изменение уровня или характера реакции этих маркеров может быть обнаружено и в зубчатых образованиях толстой кишки, обладающих большим потенциалом злокачественности.
Бета-катенин – цитоплазматический белок, ядерное накопление которого вследствие инактивирующей мутации в APC или мутации в бета-катенине приводит к активации Wnt-сигнального пути и опухолевой трансформации толстой кишки.
CDX2 – ядерный транскриптационный фактор, являющийся одной из «мишеней» бета-катенина, основной функцией которого является контроль дифференцировки кишечного эпителия. Снижение экспрессии CDX2 в опухоли ассоциировано с более агрессивными морфологическими характеристиками и худшим прогнозом [9]. При исследовании рака толстой кишки была выявлена ассоциация между снижением экспрессии CDX2 в опухоли и наличием BRAF-мутации (p < 0,0001), CIMP-high статуса (p = 0,0051) и MMR-deficiency (p < 0,0001), на основании чего можно предположить, что потеря экспрессии CDX2 играет определенную роль в зубчатом пути канцерогенеза.
P53 – транскрипционный фактор, индуцирующий остановку клеточного цикла с последующим апоптозом посредством клеточного стресса. P53 регулирует множество генов, регулирующих каскад множества сигнальных процессов. Дисрегуляция гена опухолевого супрессора р53 – одно из самых часто встречающихся событий при трансформации колоректального рака, что позволяет использовать уровень экспрессии р53 в качестве маркера потенциала малигнизации [10].
Данная работа посвящена сравнительной оценке ряда морфологических и иммуногистохимических характеристик HP и SSA/P для обоснования новых подходов к классификации.
Материалы и методы. В ходе работы методом сплошной выборки был отобран материал 474 биопсий полиповидных образований толстой кишки, эндоскопических мукозальных резекций и эндоскопических полипэктомий: 315 HP и 159 SSA/P. Злокачественные новообразования толстой кишки, а также образования с фокусами дисплазии тяжелой степени были исключены из исследования. Материал доставлялся в 10%-ном растворе формалина, забуференном при pH 7,4-7,6. Полипы после полипэктомии разрезались по наибольшему размеру таким образом, чтобы в срез попала вся толща слизистой оболочки, включая мышечную пластинку. Весь материал подвергался стандартной гистологической проводке в аппарате Leica ASP300S (Germany), заливке в парафин, после чего изготавливались срезы толщиной 4 мкм. Стекла, окрашенные гематоксилином и эозином, изучались при помощи светового микроскопа Leica DM4000B/DFC495 (Germany).
В качестве критериев HP на основании рекомендаций ВОЗ [4] и обновленных рекомендаций 2012 года [11] были приняты:
- наличие зубчатости цитоплазматического типа;
- отсутствие расширения базальных отделов крипт;
- отсутствие горизонтального роста базальных отделов крипт вдоль мышечной пластинки слизистой оболочки;
- отсутствие очагов дисплазии;
- отсутствие очагов эозинофильных изменений эпителия.
В качестве критериев SSA/P на основании рекомендаций ВОЗ [4] и обновленных рекомендаций 2012 года [11] были приняты:
- наличие зубчатости цитоплазматического типа;
- наличие одного или более из следующих критериев:
· достоверное расширение базальных отделов одной или более крипт;
· горизонтальный рост базальных отделов одной или более крипт вдоль мышечной пластинки слизистой оболочки;
· очаговые эозинофильные изменения эпителия;
· наличие очагов дисплазии.
Статистическая обработка данных проводилась с использованием программы PASW Statistics 22. Уровень значимости (p) принимали равным 0,05 во всех вышеописанных сравнениях.
Для иммуногистохимических определений были отобраны 43 HP и 49 SSA/P. Использовали моноклональные антитела к маркеру пролиферативной активности Ki-67, транскрипционным факторам (бета-катенину и cdx-2), белкам плотных контактов (claudin-1; claudin-3; claudin-4) и маркерам стволовых опухолевых клеток (musashi-1 и CD44) (таблица). В качестве группы сравнения были отобраны 32 TSA, поскольку по современной классификации они включены в группу зубчатых образований.
Характеристика использованных антител
|
П/П |
ГРУППА |
БЕЛОК |
КЛОН АНТИТЕЛ |
РАЗВЕДЕНИЕ |
ПРОИЗВОДИТЕЛЬ |
|
1 |
Ki67 |
MIB1 |
RTU |
Dako (USA) |
|
|
2 |
Транскрипционные факторы |
Beta-catenin |
β-Catenin-1 |
RTU |
Dako (USA) |
|
3 |
Cdx-2 |
DAK-CDX2 |
RTU |
Dako (USA) |
|
|
4 |
Белки плотных контактов |
Claudin-1 |
Поликлональные |
RTU |
Thermo (UK) |
|
5 |
Claudin-3 |
Поликлональные |
RTU |
Thermo (UK) |
|
|
6 |
Claudin-4 |
Поликлональные |
RTU |
Thermo (UK) |
|
|
7 |
Маркеры опухолевых стволовых клеток |
Musashi-1 |
69-Q |
1:100 |
Santa Cruz (USA) |
|
8 |
CD44 |
DF 1485 |
1:25 |
Dako (USA) |
Оценку Ki-67 производили по общепринятой схеме путем подсчета количества окрашенных ядер на 100 ядер препарата, усредненный результат выражался в процентах. Отдельно оценивалось распределение реакции Ki67 по отделам крипты, разделенным на трети (нижняя, средняя и верхняя).
При оценке экспрессии CDX2 в каждом случае оценивалась интенсивность окрашивания (слабая, умеренная или выраженная) и процент окрашенных ядер. Окрашивание 90% и более ядер было принято за нормальный уровень экспрессии. Под интенсивностью реакции понимается яркость. Во всех доступных оценке фрагментах интактной слизистой оболочки, прилежащих к изучаемым образованиям, отмечено выраженное (яркое) ядерное окрашивание 100% клеток.
Для маркера Beta-catenin оценивалось наличие и интенсивность (яркость) ядерной экспрессии, доля и распределение окрашенных клеток.
Реакция клаудинов оценивалась по формуле «интенсивность (0-3) x количество прореагировавших клеток (0-3)» и расценивалась как отрицательная, слабая (1-3), умеренная (4-6) и выраженная (9). Также оценивалась локализация маркера: мембранная, цитоплазматическая, ядерная. Интенсивность и распределение оценивались полуколичественным методом: интенсивность градировалась по шкале 1 – слабая; 2 – умеренная; 3 – выраженная. Распределение реакции в опухолевых клетках расценивалось как 1 – фокальное (<10% клеток); 2 – региональное (11-50% клеток); и 3 – диффузное (>50% клеток). Интенсивность и распределение, выраженные в баллах, перемножались, давая итоговый балл [12].
Интенсивность реакции Msi-1 отдельно оценивалась в цитоплазме (0; "+", "++", "+++") и в ядре (0; "+", "++", "+++"; "++++"; "+++++").
Производилась раздельная полуколичественная оценка мембранной и цитоплазматической реакции CD44 с использованием следующей шкалы: "–" – отрицательная, "+" – слабая, "++" – умеренная, "+++" – выраженная. Также обращали внимание на распределение метки по отделам крипты, разделенным на трети (нижняя, средняя и верхняя).
Нами была оценена интенсивность p53 (слабая, умеренная или выраженная), распределение маркера (нижняя часть крипты, поверхностная часть крипты или крипта целиком) и распределение позитивных клеток.
Результаты
Маркер пролиферативной активности: Ki67
В HP индекс пролиферативной активности варьировал от 3% до 45% (среднее значение 24,1%), и отмечалось два типа распределения метки:
· реакция в базальных отделах полипа (нижней трети крипты) – наблюдалась в 69,2%;
· реакция в базальных отделах с распространением на среднюю треть полипа (рис. 1a) – наблюдалась в 30,8%.
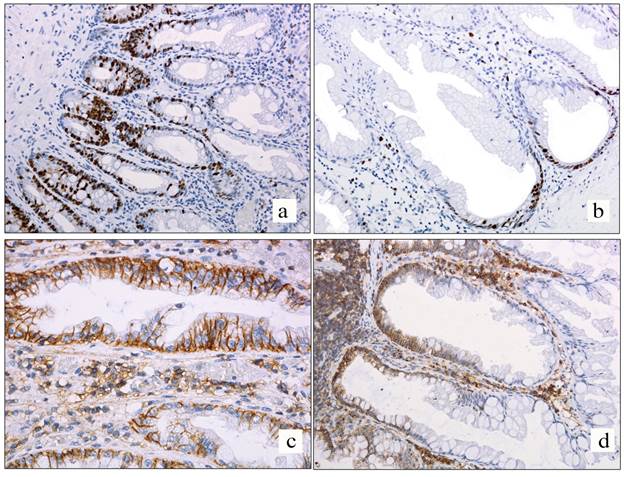
Рис. 1. Ядерная реакция Ki67 в зубчатых образованиях толстой кишки:
а – гиперпластический полип толстой кишки, реакция Ki67 в базальных отделах с распространением на среднюю треть, х100; b – зубчатая аденома на широком основании, ядерная реакция Ki67 в базальных отделах крипт с расширением вдоль мышечной пластинки, х100; с – мембранная реакция CD44 в криптах с «зубчатым просветом», х400;
d – мембранная реакция CD44 в зубчатой аденоме на широком основании в базальных отделах и средней трети крипты; в верхней трети крипты реакция отсутствует, х200
В SSA/P индекс пролиферативной активности варьировал от 10% до 40% (среднее значение – 22,1%). Отмечался только один вариант распределения метки: в базальных отделах полипа, то есть в нижней трети крипты (100%), без распространения на среднюю треть (рис. 1b).
По данным литературы, SSA/P характеризуется смещением пролиферативной зоны из «привычных» базальных отделов крипт, формированием эктопического очага пролиферации, что обусловливает формирование L-, T-образных крипт, а «зубчатость» в HP и SSA формируется за счет того, что зоны созревания располагаются по обе стороны от пролиферативной зоны [13]. В нашем исследовании обнаружить смещение зоны пролиферации в гиперпластических полипах и зубчатых аденомах на широком основании не удалось ни по экспрессии Ki67, ни по уровню формированию зубчатого просвета.
Принципиально иным был характер реакции Ki67 в TSA. Уровень Ki67 в TSA оказался выше, чем в HP и SSA: среднее значение составило 39,7%, иным было и распределение метки по высоте крипты:
· равномерно диффузно по всему полипу (76,5%);
· преимущественно в поверхностных отделах аденомы – (23,5%). Поверхностные отделы аденомы в обязательном порядке включали верхнюю треть крипты.
Маркеры опухолевых стволовых клеток: CD44 и Musashi-1
Во всех наблюдениях в HP и SSA реакция CD44 носила мембранный характер, что является типичной локализацией для данного маркера (рис. 1c), и выявлялась в базальных отделах крипт (нижняя треть) (рис. 1d). В чуть более чем в половине случаев гиперпластических полипов (53,9%) и лишь в 11,4% SSA реакция также обнаруживалась в средних отделах. Интенсивность реакции уменьшалась по направлению к просвету кишки, но последнего не достигала. По исследуемым маркерам Ki67 и CD44, а также маркерам, описанным в предыдущих исследованиях, выявить статистически значимых различий между HP и SSA не удалось (p>0,05). Эти результаты не кажутся нам противоречащими современной классификации, поскольку источник SSA не определен. По некоторым данным, SSA часто развивается из микровезикулярного HP [14], но существует мнение, что SSA развивается de novo. Возможно, данные разногласия связаны с противоречивыми критериями определения SSA. Так, согласно рекомендациям American Gastroenterology Association, наличие одной крипты с расширением базальных отделов достаточно для верификации SSA, а по классификации ВОЗ необходимо минимум три (или две соседние крипты) для подтверждения диагноза [15]. В зависимости от критериев варьирует и общая численность SSA, и их происхождение. Экспрессия CD44 характеризовалась точно такими же закономерностями распределения по полипам, как и Ki67, хотя CD44 не отражает пролиферативную активность. Такая коэкспрессия может быть объяснена участием молекул CD44 в передаче специфических сигналов через компоненты цитоскелета, что стимулирует увеличение митотической активности клеток.
Во всех TSA реакция CD44 наблюдалась в верхней и средней третях. В ряде случаев (64,7%) реакция также выявлялась в нижней трети. Примечательно, что даже если реакция наблюдалась диффузно по всей аденоме (то есть и в верхней, и в средней, и в нижней третях крипты), в 52,9% отмечалось наличие градиента: в апикальных отделах крипт, обращенных к просвету, реакция была значительно более выражена, чем в базальных, что свидетельствовало о распространении реакции «сверху вниз» по аденоме, а не наоборот, в отличие от HP и SSA.
Маркер Msi-1 во всех наблюдениях HP и SSA/P имел ядерную локализацию. Статистической разницы между группами выявить не удалось. В группе TSA в 59,0% реакция оказалась смешанной (цитоплазматическая + ядерная), в остальных 35,0% случаев – ядерная. Статистически распределение реакции и уровень Msi-1 был выше в TSA по сравнению с HP и SSA/P (p<0,05).
Маркеры активации Wnt-пути: Beta-catenin и CDX2
В группах HP и SSA/P ядерная экспрессия Beta-catenin не была выявлена ни в одном случае (статистической разницы между группами выявлено не было). TSA статистически достоверно отличалась от HP и SSA/P (p<0,05): в 15,5% случаев наблюдалась ядерная реакция бета-катенина, из них в 7,7% отмечалось наличие мелких групп окрашенных ядер только в верхней части крипт, в 7,7% – диффузное окрашивание 50% ядер.
В большинстве случаев TSA была выявлена диффузная умеренная или выраженная ядерная экспрессия CDX2 (рис. 2b), причем выраженность реакции во всех случаях была ниже, чем в прилежащих фрагментах интактной слизистой оболочки. Среди HP в 14,3% отмечалось слабое ядерное окрашивание в базальных отделах крипт при более выраженном окрашивании в поверхностных отделах; в 14,3% – мозаичность окрашивания с формированием очагов со слабой интенсивностью реакции. Среди SSA/Р в 11,5% отмечалось слабое ядерное окрашивание в поверхностных отделах крипт при более выраженном окрашивании в базальных отделах; в 11,5% – мозаичность окрашивания с формированием очагов со слабой интенсивностью реакции, в 3,8% – диффузная слабая реакция в 30% ядер (рис. 2а).
Полученные нами результаты оценки экспрессии Beta-catenin свидетельствуют о том, что часть TSA, наряду с тубулярными и тубуло-ворсинчатыми аденомами, обладают аномальным ядерным накоплением Beta-catenin, что свидетельствует о возможности малигнизации через Wnt-сигнальный путь. Отсутствие ядерной экспрессии среди ГП и SSA/Р, на первый взгляд, исключает возможность малигнизации по «классическому» пути канцерогенеза. Однако выявленные аномалии экспрессии белка CDX2 в 28,6% ГП и 26,8% SSA/Р могут свидетельствовать в пользу вовлечения альтернативных механизмов «запуска» классического пути канцерогенеза, так как CDX2 является одной из «мишеней» Beta-catenin. В то же время более слабая экспрессия CDX2 в части ГП и SSA/Р может свидетельствовать о меньшей дифференцированности эпителия в зубчатых образованиях по сравнению с TSA, что может рассматриваться как один из возможных механизмов малигнизации зубчатых образований.
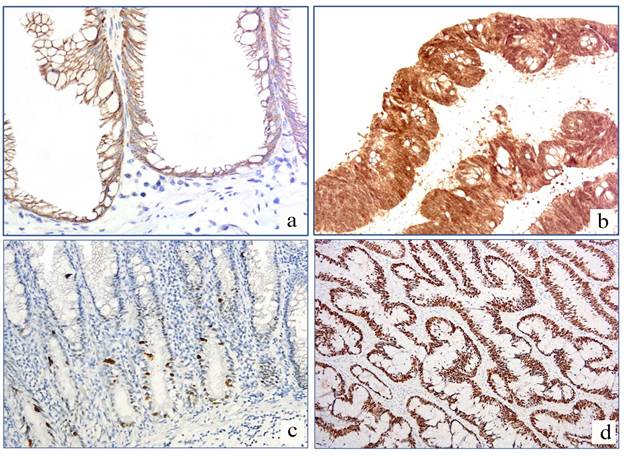
Рис. 2: a – SSA/P: отсутствие ядерной экспрессии бета-катенина, x400; b – TSA: диффузная ядерная экспрессия бета-катенина умеренной интенсивности (яркости), x400;
c – HP: нарушенная экспрессия p53; положительно окрашенные клетки в нижней части крипты, x200; d – TSA: нарушенная экспрессия p53; положительно окрашенные клетки по всей высоте крипты, x100
Несмотря на отсутствие статистически достоверных различий ни в частоте выявления нарушений экспрессии CDX2, ни в ее характере между НР и SSA/P отмечается тенденция к более выраженным нарушениям экспрессии CDX2 в SSA/P. НР и SSA/P, вероятно, представляют собой этапы развития одного образования, в котором происходит постепенное накопление «поломок» генетического аппарата. Одним из биологических маркеров этого процесса, вероятно, является снижение и последующая потеря экспрессии CDX2. Вовлечен ли CDX2 непосредственно в процесс злокачественной трансформации НР и SSA/P или является лишь маркером происходящих молекулярных изменений, а также на каком этапе происходит нарушение экспрессии CDX2, в настоящее время остается не ясным.
Маркер апоптоза: p53
Экспрессия p53 не была обнаружена в 7,1% HP, 13,3% SSA/P и 6,7% TSA. Слабая экспрессия p53 считалась при экспрессии слабой интенсивности или умеренной или выраженной интенсивности в менее чем 5% клеток. Экспрессия слабой интенсивности была выявлена в 50,0% HP, 36,7% SSA/P и 13,3% TSA. Экспрессия умеренной или выраженной интенсивности менее чем в 5% клеток была выявлена в 14,3% HP, 20,0% SSA/P и 6,7% TSA.
Нарушением экспрессии p53 считалась реакция умеренной или выраженной интенсивности в 5% и более клеток. Таковая была выявлена в 28,6% HP, 30,0% SSA/P и 73,3% TSA. Во всех HP и SSA/P p53 позитивно окрашенные клетки (аберрантная экспрессия) были расположены в нижней части крипт (рис. 2с); в TSA – напротив, в поверхностной части или вдоль всей крипты (рис. 2d). Наличие поверхностно расположенной экспрессии p53 было обнаружено в 63,6% TSA с аберрантной экспрессией. Диффузное распределение – в 36.4% TSA с аберрантной экспрессией. Схожее распределение реакции было обнаружено между HP и SSA/P (p<0,05). Среднее количество p53-позитивных клеток (умеренной или выраженной интенсивности) составило 6,6% среди HP, 6,0% среди SSA/P и 25,4% среди TSAs. Статистически значимой разницы по количеству p53 позитивных клеток между HP и SSA/P обнаружено не было (p>0,05). TSA значительно отличались от двух остальных групп.
Маркеры белков плотных контактов: клаудин-1; -3; -4
Уровни клаудина-1 и клаудина-3 в HP (среднее значение 2,38 и 2,38 соответственно) и в SSA/P (среднее значение 3,63 и 3,21 соответственно) оказались примерно одинаковыми. Была выявлена только мембранная локализация маркера, цитоплазматическая реакция маркеров не встречалась. Реакция клаудина-4 носила преимущественно мембранный характер. В 15,4% HP и 26,3% помимо мембранной наблюдалась также цитоплазматическая реакция. Также в 26,3% на фоне мембранной и цитоплазматической реакций была выявлена парадоксальная ядерная реакция с характерной мозаичностью реакции. В TSA уровень всех клаудинов статистически был выше (p<0,05).
Обращает на себя внимание принципиальное отличие TSA от HP и SSA по всем исследуемым маркерам (p<0,01). Несмотря на то что в современной официальной классификации TSA отнесена к «зубчатым» полипам, следует помнить, что исходно эта группа была выделена Longacre T.A. и Fenoglio-Preiser C.M. (1990) по одновременному наличию в них признаков и традиционных аденом (AT и ATV), и гиперпластических полипов (HP). Кроме того, основной классификационный признак, на основании которого выделена группа «зубчатых» полипов – так называемая зубчатость просвета крипт – но характер «зубчатости» просвета крипт в TSA, с одной стороны, и в HP и SSA - с другой стороны, принципиально различен. Так, HP и SSA характеризуются «зубчатостью» цитоплазматического типа, формирование которой связано с выбуханием цитоплазмы клеток в просвет крипты в виде зубцов (просвет продольно ориентированных крипт пилообразный, поперечно ориентированных – звездчатый). «Зубчатость» просвета крипт в TSA обусловлена патологическим ветвлением крипт с формированием так называемых эктопических крипт, расположенных перпендикулярно основной оси предсуществующей крипты, формирует особый тип гистоархитектоники, отличной от нормального строения слизистой оболочки.
Заключение. Полученные нами результаты указывают на то, что иммуногистохимический профиль (оцененный по белкам плотных контактов – клаудин-1, -3, -4, транскрипционным факторам основного Wnt-пути канцерогенеза – beta-catenin, cdx2, p53, опухолевым стволовым клеткам – CD44, Msi-1 и маркеру пролиферативной активности Ki67) не отличается между зубчатыми образованиями с цитоплазматическими типом зубчатости. Непрерывность и неравномерность изменения морфологических характеристик в ряду НР – SSA/P усложняет патологоанатомическую диагностику и критерии выделения каждого подтипа в отдельности. TSA принципиально отличается от HP и SSA/P иммунофенотипом, что также может свидетельствовать о разных путях канцерогенеза этих типов полипов, несмотря на объединение в общую группу «зубчатые образования». Таким образом, в работе показано отсутствие статистической разницы между НР и SSA/P и принципиальное отличие от них TSA, что может являться основанием для модернизации классификации полипов толстой кишки.
Исследование выполнено при финансовой поддержке гранта РФФИ в рамках научного проекта № 16-34-00179 мол_а.
Библиографическая ссылка
Харлова О.А., Олейникова Н.А., Мальков П.Г., Данилова Н.В. НОВЫЕ ПОДХОДЫ К КЛАССИФИКАЦИИ ЗУБЧАТЫХ ОБРАЗОВАНИЙ ТОЛСТОЙ КИШКИ // Современные проблемы науки и образования. 2018. № 2. ;URL: https://science-education.ru/ru/article/view?id=27471 (дата обращения: 13.12.2025).
DOI: https://doi.org/10.17513/spno.27471



