Лечение ишемизированных дефектов кожных покровов разной этиологии все еще остается важной медицинской проблемой [1]. Воспаление является неизбежным первым шагом в процессе заживления ран и тесно связано с образованием рубцов [2]. Однако непрерывное и хроническое воспаление стимулирует секрецию провоспалительных цитокинов и вызывает чрезмерное рубцевание [3-6]. Основные провоспалительные цитокины выделяются макрофагами, активно участвующими в первой воспалительной фазе раневого процесса [7]. Содержание макрофагов на этапах раневого процесса в ишемизированных длительно незаживающих дефектах кожного покрова изучено недостаточно [8], а сведения об их присутствии в условиях введения полинуклеотидов единичны и редки.
В исследовании Woonhyeok Jeong et al. (2017) [9] сообщается, что введение дезоксирибонуклеотидных полимеров (PDRN), извлекаемых из спермы лососевых рыб и содержащих дезоксирибонуклеотидные полимеры с 50-2000 парами азотистых оснований [10], снижает содержание провоспалительных медиаторов, таких как фактор некроза опухоли альфа (TNF-α), интерлейкин 6 (IL-6) и внеклеточный высокомобильный протеин-1 семейства бокс (extracellular high-mobility group box protein-1 (HMGB-1)). Механизм действия полимеров, как полагают, обусловлен их способностью замещать поврежденные азотистые основания ДНК и РНК молекул, поэтому PDRN первоначально был описан как стимулирующий тканевой ремонт-агент, восстанавливающий клеточные повреждения, взаимодействуя с пуринергическим рецептором А2 и ускоряя дифференцировку фибробластов [11]. Кроме того, PDRN оказывают противовоспалительное действие, ингибируя дегрануляцию тучных клеток и воспалительные цитокины [12].
Целью исследования было оценить противовоспалительное действие полинуклеотидов (PDRN) путем изучения содержания макрофагов в биоптатах новообразованного эпидермиса и дермы на этапах регенерации модельной кожной ишемизированной раны.
Материалы и методы
Дизайн эксперимента. Исследование выполнено на 36 мышах линии С57/В1 в возрасте 4-6 месяцев, которые содержались в виварии Медицинской академии имени С.И. Георгиевского. Животные были разделены на контрольную и экспериментальную группы по 18 особей в каждой. Эксперименты проводили со следованием всем принципам гуманности, содержащимся в директиве Европейского сообщества (86/609/ЕС), и в соответствии с «Правилами выполнения работ с привлечением экспериментальных животных». Во всех группах операцию по моделированию кожной раны в лопаточной области производили после внутрибрюшинного введения 2,5%-ного раствора авертина 0,3–0,4 мл. Кожу однотипно иссекали в виде круга диаметром 12 мм, к краям раны кожно-фасциальными узловыми швами фиксировалось силиконовое кольцо с наружным диаметром 12 мм атравматичным шовным материалом «Полипропилен» 5-0 для исключения возможности быстрой эпителизации раны и закрытия её мобильной кожей области спины [13]. Ишемизацию раны проводили путем наложения кисетного шва нитью «Полипропилен» 5-0 на расстоянии 1,0 см латеральнее наружного диаметра раны, что нарушает циркуляцию крови в системе окололопаточных артерий мыши. Артериальный анастомоз вокруг лопаток образован ветвью подмышечной артерии a. Circularis scapula и ветвью поперечной артерии шеи Ramus descendense, отходящей от подключичного Truncus thiriocervicales. В контрольной группе рана оставалась не леченной. В экспериментальной группе в дно раны и вокруг нее вводили 0,4 мл раствора полинуклеотидов Plenhyage Medium фирмы I.R.A. Istituto Ricerche Applicate Sri (Италия).
Морфологическое исследование рубцов. На 4, 7, 10, 12, 15 и 23-и сутки после операции у мышей всех групп иссекали образовавшийся рубец и фиксировали 10%-ным забуференным формалином. После промывки от формалина материал обезвоживали в спиртах возрастающей концентрации, просветляли в ксилоле, заливали в парафин, нарезали на микротоме, полученные срезы окрашивали гематоксилином и эозином, дегидратировали и заключали под покровные стекла. Изучение гистологических препаратов проводили с помощью светооптического микроскопа OLIMPUS СХ-31 с цифровой камерой OLIMPUS З5050Z.
Иммуногистохимический метод определения макрофагов. Присутствие макрофагов определяли иммуногистохимическим методом после депарафинизации и регидратации парафиновых срезов. Для восстановления антигенных свойств клеток тканей регенерата после фиксации в формалине проводили тепловую индукцию эпитопного (антигенного) восстановления (HIER – heat induction of epitope retrieval). Для этого стёкла нагревали в микроволновой печи Samsung 2739Nr-S (2015 год выпуска) при мощности 800 Вт в течение 10 минут в цитратном буфере при рН 6,0. Первичными антителами были CD68 Gene Tex Inc (США) (поликлональные) в разведении 1:100. Титр антител подбирали с использованием раствора для разведения антител (antibody diluents). Вторичные антитела, которые содержали большое количество молекул пероксидазы хрена, наносили на срезы и инкубировали во влажной камере на протяжении 30 минут с промыванием в растворе Tris-buffer между каждым этапом на протяжении 10 минут. Для детекции и визуализации реакции добавляли на каждый срез 1–3 капли 3,3-диаминобензидина (DAB Substrate Chromogen) Gene Tex Inc (США). Затем инкубировали 20–30 секунд под контролем микроскопа до появления темно-коричневого окрашивания специфических структур (цитоплазматическая реакция). Для адекватного представления структуры ткани и ядер клеток срезы дополнительно окрашивались гематоксилином Майера в течение 3 минут. Срезы подвергали дегидратации и заключали в гель Aquatex® (aqueous mounting agent, Andwin Science, Франция) под покровные стекла. Кроме того, выполнялось контрольное исследование с целью исключения псевдопозитивных и псевдонегативных результатов.
Индекс макрофагов определяли путем подсчета количества CD68-позитивных клеток на 100 клеток при увеличении микроскопа ×1350 с последующим вычислением показателя в процентах в среднем по результатам изученных срезов каждых биоптатов в контрольной и экспериментальной группах.
Статистический анализ. Статистическую обработку цифровых данных проводили с использованием лицензионного программного обеспечения MS Office Excel 2007, аналитического пакета приложения STATISTICA Enterprise (StatSoft Inc., США). Рассчитывали среднюю арифметическую и стандартную ошибку средней. Для сравнения двух выборок использовали t-критерий с уровнем значимости р<0,05. Сравнения средней величины индекса макрофагов проводили в процентах по отношению к контрольной группе в каждом сроке исследования.
Результаты и обсуждение. У мышей экспериментальной группы на фоне введения полинуклеотидов самопроизвольное отпадение силиконового кольца вокруг раны зафиксировано на 9,2+0,02 день (против 12,4+0,10) после операции по созданию модельной раны, что на 25,81% раньше, чем в контроле.
На 4-е сутки после операции и обкалывания полинуклеотидами силиконовое кольцо присутствует у мышей обеих групп. На срезах, окрашенных гематоксилином и эозином, виден обширный струп, закрывающий рану (рис. 1А). Он состоит из клеточного дебриса и клеток воспалительного ряда. При окраске на макрофаги (рис. 1Б) струп ярко-коричневый, что свидетельствует о большом количестве макрофагов в его составе. Также макрофагов много в подлежащей жировой ткани, поднявшейся из гиподермы и выполнившей дефект кожи. Индекс макрофагов в контрольной группе составляет 25,11+0,12, а в экспериментальной группе – 20,31+011, что на 19,12% меньше. Толщина струпа больше в контрольной группе.
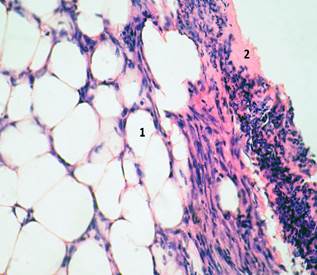 А
А
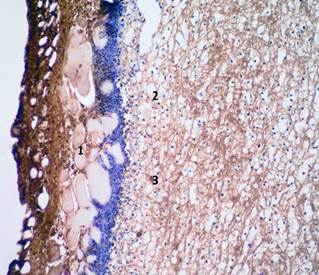 Б
Б
Рис. 1. Биоптаты кожи мыши на 4-е сутки после операции и введения PDRN (экспериментальная группа). А – окраска гематоксилином и эозином. Увеличение: х320;
1 – жировая ткань; 2 – струп. Б – иммуногистохимическая реакция с антителами против антигена CD68. Увеличение: х200; 1 – струп; 2 – жировая ткань; 3 – CD68-позитивная клетка (макрофаг)
На 7-е сутки кольцо по-прежнему присутствует вокруг раны. Под струпом произошла частичная эпителизация раны: присутствует эпидермис, состоящий из 1-2 рядов кубических эпителиальных клеток в контроле. После введения PDRN эпидермис биоптатов мышей экспериментальной группы насчитывает до 3 рядов кубических эпителиоцитов. Клеточный дебрис в составе струпа проявляет яркое окрашивание на CD68, возможно, за счет компонентов погибших макрофагов. Под эпидермисом видно начало образования грануляционной ткани, в которой еще мало капилляров, фибробластов и коллагеновых волокон. CD68-позитивные клетки, являющиеся макрофагами, локализуются в основном вокруг кровеносных сосудов или в просвете сосудов, что подтверждает их гематогенное происхождение. Индекс макрофагов в грануляционной ткани контрольных и экспериментальных биоптатов составляет 24,18+0,02 и 18,49+0,04 соответственно. Насыщенность макрофагами в экспериментальной группе на 23,53% меньше.
На 10-е сутки кольцо у мышей экспериментальной группы самопроизвольно отпало за счет активной эпителизации раны. Развитие грануляционной ткани здесь наиболее значительно продвинулось, просматривается сеть коллагеновых волокон, между которыми лежат фибробласты. Макрофаги диффузно разбросаны в грануляционной ткани недалеко от кровеносных сосудов. Индекс макрофагов (14,29+0,03) заметно снизился по сравнению с контролем (21,95+0,05) - на 43,35%. Струп в контроле намного толще, а эпидермис тоньше.
На 12-е сутки силиконовое кольцо отсутствует у мышей обеих групп, но эпидермис толще и выглядит более дифференцированным в экспериментальной группе. На срезах рубца в контрольной группе эпидермис представлен еще формирующимся многослойным эпителием. В эпидермисе определяется базальный слой и несколько рядов шиповатых клеток. Роговой слой очень тонкий и находится на начальных стадиях дифференцировки кератиноцитов. Над эпидермисом видны остатки струпа, в котором клеточные элементы уже отсутствуют. Дерма рубца не образует сосочков, вдающихся в эпидермис, и граница между эпидермисом и дермой рыхлая и ровная. Весь кожный дефект заполнен развивающейся грануляционной тканью, в которой встречаются клетки тканевого и гематогенного происхождения. Сосочковый и сетчатый слои дермы не разграничиваются и образованы равномерно локализованными коллагеновыми волокнами, между которыми присутствуют клетки, преимущественно функционально активные фибробласты. Немногочисленные кровеносные капилляры и венулы расширены. В биоптатах после введения полинуклеотидов регенераторный гистогенез происходил более благоприятно. С поверхности эпидермиса струп полностью отделился. Значительно продвинулась дифференцировка слоев эпидермиса. На поверхности заметен выраженный роговой слой, наметилось появление сосочкового слоя дермы в виде волнистой границы между базальной мембраной эпидермиса и подлежащей грануляционной тканью. Грануляционная ткань характеризуется усилением процессов ангиогенеза и коллагенообразования. Она беднее на 26,44% CD68-позитивными клетками (индекс макрофагов составляет 12,66+0,02 против 17,21+0,04 в контроле).
На 15-е сутки модельная рана у мышей находится на пути рубцевания ярче выраженного на фоне присутствия полинуклеотидов. Это находит подтверждение на срезах, где появляются признаки фиброзирования грануляционной ткани. Коллагеновые волокна теряют сетчатую структуру и располагаются тонкими пучками параллельно эпидермису (рис. 2А). Формируется сосочковый слой дермы, когда линия разграничения эпидермиса и дермы становится волнистой. Макрофаги встречаются редко, в основном CD68-позитивные клетки контрастируются в глубоких слоях биоптата (рис. 2Б). Индекс макрофагов составляет 9,18+0,01, что на 25,85% меньше, чем в контрольной группе (12,38+0,01).
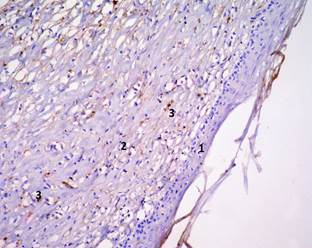 А
А
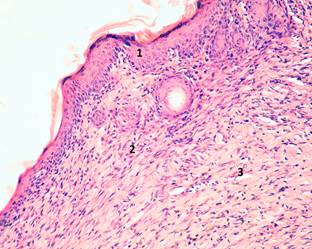 Б
Б
Рис. 2. Биоптаты кожи мыши на 15-е сутки после операции и введения PDRN (экспериментальная группа). А – окраска гематоксилином и эозином. Увеличение: х100;
1 – эпидермис; 2 – грануляционная ткань; 3 – сосуд. Б – иммуногистохимическая реакция с антителами против антигена CD68. Увеличение: х100; 1 – эпидермис; 2 – грануляционная ткань; 3 – CD68-позитивная клетка (макрофаг)
На 23-и сутки рана у мышей экспериментальной группы делается мало заметной и даже покрывается шерстью, что не происходит без полинуклеотидов. У этих мышей на гистологических срезах эпидермис полностью дифференцирован в 4 слоя. Видны закладки волос. В дерме коллагеновые волокна собраны в пучки параллельно поверхности эпидермиса. Макрофаги встречаются редко, их индекс равен всего 7,35+0,01. Он меньше, чем в контрольной группе, на 22,55%. В контрольной группе сформировался более грубый рубец без волос с толстыми пучками коллагеновых волокон, среди которых много капилляров.
Хотя точный механизм действия PDRN неизвестен, показано, что PDRN проявляют свои эффекты посредством активации рецепторов аденозина A2A, которые регулируют сеть цитокинов, ингибируя секрецию воспалительных цитокинов из макрофагов in vitro [14]. Связь между аденозиновыми A2A-рецепторами и PDRN при воспалении была проиллюстрирована противовоспалительным эффектом применения PDRN при периодонтите и отменой опосредованного PDRN противовоспалительного эффекта конкретными антагонистами A2A [15].
Заключение. Получено, что индекс макрофагов в экспериментальной группе после введения PDRN во всех сроках ниже, чем в контроле (рис. 3). Максимальная разница присутствует к 10-м суткам, что свидетельствует об уменьшении интенсивности воспаления и сокращении воспалительной фазы заживления раны. На этом фоне формирование грануляционной ткани происходит раньше, более активно и умеренно.
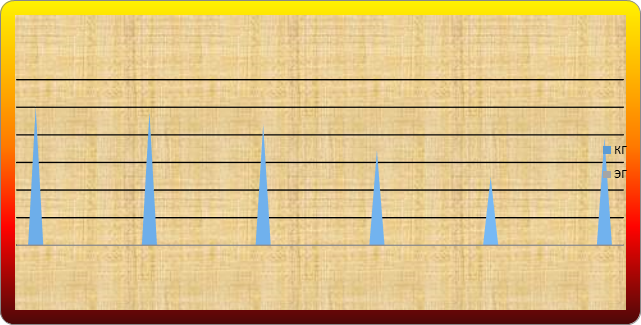
Рис. 3. Динамика индекса макрофагов в дерме биоптатов контрольной (КГ) и экспериментальной групп (ЭГ)
Фиброзирование грануляционной ткани начинается раньше, чем в контроле, в результате чего сокращаются сроки формирования рубца, который по своим характеристикам является нормотрофическим и в котором появляются дериваты кожи – шерсть.
Работа поддержана проектом «Сеть академической мобильности «РНИЭМ» ФГАОУ ВО «КФУ имени В.И. Вернадского» и выполнена с использованием инфраструктуры НУЗ «НКЦ ОАО «РЖД» (г. Москва).
Библиографическая ссылка
Шаповалова Е.Ю., Бойко Т.А., Барановский Ю.Г., Харченко С.А., Юнси Г.А. ВЛИЯНИЕ ПОЛИНУКЛЕОТИДОВ НА СОДЕРЖАНИЕ МАКРОФАГОВ В ТКАНЯХ РЕГЕНЕРИРУЮЩЕЙ ИШЕМИЗИРОВАННОЙ РАНЫ // Современные проблемы науки и образования. 2017. № 6. ;URL: https://science-education.ru/ru/article/view?id=27352 (дата обращения: 12.01.2026).
DOI: https://doi.org/10.17513/spno.27352



