Важное значение в поддержании здоровья человека отводится микробной экологии. Функции нормальной микрофлоры человека разнообразны – от синтеза биологически активных соединений, обеспечения антимутагенной защиты организма до регуляции поведенческих реакций. Одной из наиболее важных функций является обеспечение колонизационной резистентности, под которой, как известно, понимается совокупность механизмов, придающих стабильность нормальной микрофлоре. Однако механизмы взаимодействия микроорганизмов и макроорганизма до конца не изучены.
Многочисленными клиническими исследованиями доказана связь качественных и количественных изменений микрофлоры с формированием различных патологических состояний и заболеваний организма [1; 2]. По мнению ряда ученых, спектр клинических синдромов, патогенез которых может быть связан с изменениями состава и функций микрофлоры, достаточно широк. Это гипо- и гипертензии, гиперхолестеринемия, злокачественные новообразования, дерматиты, кариес зубов и многие другие. Также имеются данные о влиянии дисбиоза кишечника на развитие атеросклеротических изменений стенок сосудов [3], ожирение [4], сахарный диабет [5], патологию печени и желчевыводящих путей [6], развитие аутизма [7], аутоиммунных и аллергических заболеваний [8].
Пищевое поведение, вызванное образом жизни современного человека, имеет ряд особенностей. Это преобладание углеводно-жировой компоненты, резкое увеличение потребления в пищу рафинированных продуктов и простых сахаров (Е.И. Ткаченко). На основании этого особенно важным является изучение количественных показателей простых углеводов (сахаров) в питании детей как наиболее вероятных факторов риска в отношении развития раннего атеросклероза, ожирения, сахарного диабета, кариеса зубов и других заболеваний.
Ранее нами проведено изучение пищевого рациона детей [9], находящихся на санаторно-курортном лечении, результаты которого указывают на значительное превышение количества потребляемого простого сахара (в 2-3 раза) детьми разных возрастных групп, в частности за счет скрытых сахаров пищевых продуктов.
Целью нашей работы явилось изучение влияния разных концентраций простых углеводов (сахаров), определенных нами из расчета рекомендуемой нормы потребления и фактическим потреблением на микробиоту толстого кишечника экспериментальных животных.
Материалы и методы исследований
Нами проведено хроническое экспериментальное исследование продолжительностью 6 месяцев на 30 крысах-самцах линии Вистар с исходной массой 232±5,0 г. Животные содержались в условиях вивария медицинского факультета ЧГУ им. И.Н. Ульянова под постоянным наблюдением ветеринарного врача. Кормление, уход за экспериментальными животными осуществлялись в соответствии с требованиями нормативной документации «Правила проведения работ с использованием экспериментальных животных» (Приложение к приказу МЗ СССР от 12.08.1977 № 755).
В соответствии с целью и задачами исследования были сформированы три группы экспериментальных животных: контрольная и две опытные по 10 крыс в каждой группе. Контрольная группа животных находилась на обычном кормовом и питьевом режиме. К питьевой воде первой опытной группы животных (опыт 1) добавляли 60 г сахара на 1 л чистой питьевой воды. Для второй опытной группы крыс (опыт 2) использовали питьевую воду с сахарной нагрузкой из расчета 90 г на 1 л воды. Расчет количества сахара на массу животных проводили с учетом рекомендуемых нормативов потребления углеводов в рационе питания для детей 7-11 лет [10] и данных, полученных в ходе физиолого-гигиенической оценки питания детей, находящихся на санаторно-курортном лечении [9], результаты которой указывают на значительное преобладание в питании доли простых углеводов (сахаров).
Забор проб полостной и пристеночной микрофлоры кишечника крыс для микробиологических исследований проводили в соответствии с разработанной авторами методикой (рационализаторское предложение № 1110 от 28.06.2007 г.) на базе ПНИЛ кафедры дерматовенерологии с курсом гигиены медицинского факультета [11]. Микробиологические исследования (качественное и количественное изучение полостной и пристеночной микрофлоры толстого кишечника) проводили на базе бактериологической лаборатории БУ «Городская клиническая больница № 1 Минздрава Чувашии».
Результаты исследований и их обсуждение
Динамическое наблюдение за активностью и массой экспериментальных животных показало отсутствие различий в поведении животных контрольной и опытных групп. Разница в средней массе тела между крысами с увеличенной долей простого сахара в рационе и со стандартным питанием составила 8-10% (рис. 1).
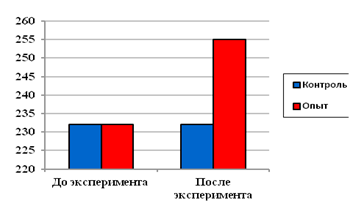
Рис. 1. Масса тела экспериментальных животных
Данные, полученные в ходе микробиологических исследований толстого кишечника, свидетельствуют о различиях качественного и количественного состава микрофлоры экспериментальных групп животных. Так, у экспериментальных животных (опыт 1) качественные и количественные изменения связаны с увеличением количества патогенной и условно-патогенной микрофлоры в восходящем, поперечном ободочном и прямом отделах толстого кишечника. Наиболее существенные микроэкологические нарушения установлены в кишечнике крыс, получавших значительную сахарную нагрузку (опыт 2). Так, при детальном анализе состава полостной микрофлоры в слепом отделе кишечника зафиксировано снижение количества бифидобактерий и лактобактерий (Bifidobacterium, Lactobacillus). Наблюдается увеличение количества факультативной и транзиторной микрофлоры (Klebsiella, Staphylococcus haemolyticus, Proteus), способной условно вызвать инфекционную патологию (рис. 2). Значительно (в 100 раз) увеличилось количество золотистого стафилококка, в 10 раз – грибов рода Candida. Эти данные свидетельствуют о развитии дисбиотических нарушений в кишечнике опытных групп животных под влиянием сахарной нагрузки.
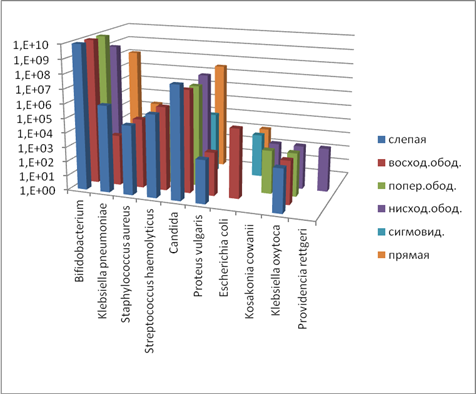
Рис. 2. Содержание микроорганизмов (полостная микрофлора, опыт 2), КОЕ10
Для контрольной группы животных характерно нормальное содержание бифидобактерий практически во всех отделах кишечника. В восходящем и поперечном отделах наблюдается снижение количества лактобактерий (рис. 3).
Анализ пристеночной микрофлоры указывает на снижение бифидобактерий во всех отделах кишечника опытных групп животных (опыт 1 и опыт 2), значительное видовое разнообразие патогенных и условно-патогенных микроорганизмов. Кроме того, в кишечнике животных группы «опыт 2» обнаружены ассоциации со значительным количеством бактерий Esherichia coli, Candida, Proteus vulgaris, Enterobacter cowanii и др. Такое видовое разнообразие способствует подавлению облигатной микрофлоры, действует угнетающе на местный иммунный статус, в дальнейшем может явиться предрасполагающим фактором развития воспалительных процессов в кишечнике. В ходе микробиологических исследований пристеночной микрофлоры установлено присутствие в значительном количестве (более 10% от общего количества) факультативных микроорганизмов в виде Staphylococcus haemolyticus, Staphylococcus aureus в кишечнике крыс группы «опыт 2», что свидетельствует о развитии стафилококкового дисбиоза (рис. 4).
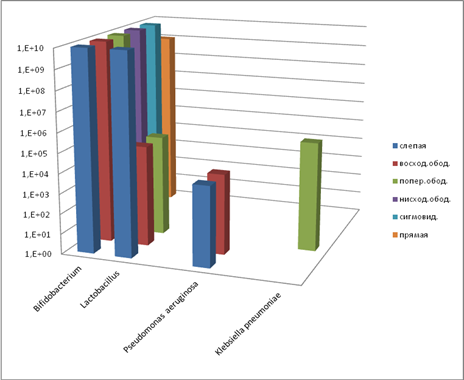
Рис. 3. Содержание микроорганизмов (полостная микрофлора, контроль), КОЕ10
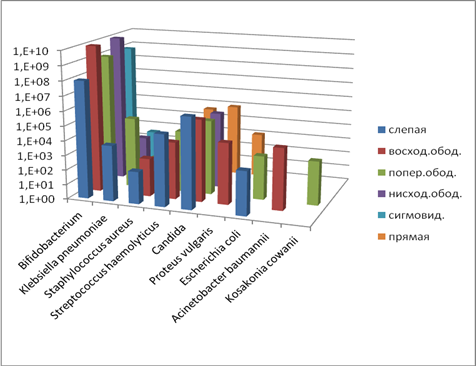
Рис. 4. Содержание микроорганизмов (пристеночная микрофлора, опыт 2), КОЕ10
Изучение пристеночной микрофлоры контрольной группы экспериментальных животных (рис. 5) указывает на нормальное содержание бифидобактерий во всех отделах кишечника и незначительное снижение количества лактобактерий в восходящем и поперечном отделах.
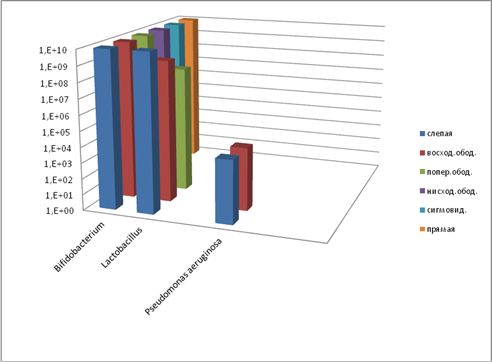
Рис. 5. Содержание микроорганизмов (пристеночная микрофлора, контроль), КОЕ10
Выводы. Результаты бактериологических исследований показали, что под влиянием сахарной нагрузки отмечаются существенные изменения в качественном и количественном составе микрофлоры кишечника экспериментальных животных. Снижается колонизационная резистентность, наблюдается разрастание и ассоциативное присутствие условно-патогенной и патогенной микрофлоры, которая существенным образом подавляет и угнетает бактерии нормальной микрофлоры. По-нашему мнению, избыточное поступление простых углеводов (сахаров) в условиях эксперимента выступает потенциальным дисбиотическим фактором, который оказывает влияние на ферментативную активность микрофлоры (инактивация амилазы и фосфатазы), способствует подавлению функций симбиотических микроорганизмов (бифидобактерий, лактобацилл и др.). Дисбаланс микробной экологии может явиться пусковым механизмом в развитии аллергических реакций, воспалительных процессов органов и систем, гиповитаминозов, гипомикроэлементов, нарушений, связанных с обменными процессами организма, аутоиммунных заболеваний.
По мнению известных отечественных ученых (Е.И. Ткаченко), нормальная микрофлора является мишенью негативного влияния разных по своей природе факторов. В зависимости от интенсивности и характера воздействия формируются микроэкологические нарушения, степень выраженности и характер проявления которых могут быть различными. Многочисленные группы факторов (экзо- и эндогенной природы) способны изменить состав, видовое разнообразие аутомикрофлоры, способствовать появлению в определенном штамме микроорганизмов генов вирулентности и др. Одним из основополагающих факторов, влияющих на состав кишечной микрофлоры человека, является питание, и в особенности качественный состав рациона питания. К примеру, преобладание потребления мясных продуктов стимулирует развитие значительного количества грамположительных анаэробных бактерий – Faecali bacterium prausnitzii [12], растительной пищи – Bacteroides [13]. Низкокалорийная диета ассоциируется со значительным снижением численности Firmicutes и ростом численности Bacteroides [14]. Повышенная доля рафинированного сахара (простых углеводов) на фоне малоподвижного образа жизни создает предпосылки к развитию ряда заболеваний органов и систем организма. Особенно неблагоприятным является формирование дисбиоза у детей, так как дисбиотические нарушения способствуют снижению общего и местного иммунитета на фоне еще незрелой в целом иммунной системы организма.
Заключение. Полученные в ходе эксперимента результаты указывают на неоспоримый факт влияния повышенных концентраций простых углеводов (сахаров) на изменения микробиоценоза кишечника, с преобладанием патогенной и условно-патогенной флоры, которая является важным звеном сложной патогенетической цепи развития хронических неинфекционных заболеваний. Последующее обоснование экспериментальных данных позволит обратить более пристальное внимание на вопросы этиопатогенеза, ранней диагностики и профилактики целого ряда заболеваний.
Полученные результаты требуют дальнейшего детального изучения патоморфологических изменений внутренних органов экспериментальных животных под влиянием повышенных концентраций простых сахаров.
Библиографическая ссылка
Толмачева Н.В., Маслова Ж.В., Колбовская Л.В., Капитонова Н.А., Чернова Н.М., Цыганова Ю.В., Мамина Т.Н., Скворцова А.Б. ДОЗОЗАВИСИМОЕ ВЛИЯНИЕ ПРОСТЫХ САХАРОВ НА МИКРОБИОТУ КИШЕЧНИКА ЭКСПЕРИМЕНТАЛЬНЫХ ЖИВОТНЫХ // Современные проблемы науки и образования. – 2017. – № 5. ;URL: https://science-education.ru/ru/article/view?id=27088 (дата обращения: 26.04.2024).



