Тема исследования обосновывалась распространённостью кардиоаритмий (КА) при ИБС, недостаточной изученностью патогенеза вегетативного участия в нарушениях функций синоатриального узла сердца (ДФСУ) и сложностями формализованной диагностики этой патологии при хронической ИБС [1]. При этом конкретное участие вегетативной системы (ВС) в возникновении ДФСУ не изучено из-за отсутствия до недавнего времени клинического метода, адекватно характеризующего состояние ВС в синоатриальном узле сердца (СУ). Известно, что КА развиваются не только при поражении сердца, но и вследствие большого спектра экстракардиальной патологии [2-6]. В норме быстрое и адекватное изменение хронотропной деятельности сердца регулируется исключительно ВС [1; 2]. Можно предполагать, что нарушения вегетативного (автономного) контроля пейсмекерной активности в СУ являются наиболее значимым звеном патогенеза в формировании ДФСУ. С разработкой методологии и клинического метода ритмокардиографии (РКГ), ориентированного на диагностику периферической автономной регуляции СУ, возможности объективной диагностики ДФСУ усовершенствовались, в том числе в дифференциальной оценке между функциональными и органическими расстройствами пейсмекерной активности СУ [7]. Хотя строгая детерминированность между этими двумя вариантами – ДФСУ и синдромом слабости синусового узла, сомнительна. Особенно в случаях их ишемического этиопатогенеза, поскольку при ИБС есть морфологический субстрат – атеросклеротическая бляшка, хроническое же нарушение перфузии тканей сердца неминуемо ведёт к структурным изменениям в его тканях. Ранее нами сообщалось о применении анализа ВСР при ДФСУ [2] в несколько ином аспекте и без оценки данных электронной микроскопии при СССУ на фоне автономной кардионейропатии, с которой связывают тяжесть заболевания и высокий риск смерти.
Целью исследования было изучение особенностей дизрегуляции СУ по данным анализа вариабельности сердечного ритма (ВСР) при ДФСУ и СССУ у больных ИБС.
Материалы и методы. Стандартными кардиологическими методами (ЭКГ с ВЭМ, ЭхоКГ, ХМ, мониторирование АД, КАГ в 137 случаях перед хирургическим лечением) в лаборатории нейрокардиологии областной больницы в течение 5-8 лет несколькократно были обследованы более 3 тысяч пациентов с ИБС. Из их числа для представляемого исследования были отобраны и проанализированы 362 случая с ДФСУ, сопровождавшейся синкопами и пресинкопами. При каждом обследовании применялось специализированное исследование ВСР с помощью РКГ на аппаратно-программном комплексе высокого разрешения КАП-РК-01-«Микор» (регистрационное удостоверение № ФС022б2005/2447-06 федеральной службы по надзору в сфере здравоохранения и социального развития) [1; 2]. Последовательно регистрировались RR-интервалы с дискретизацией ЭКС в 1000±3 Гц (в 8-14 раз точнее записи ЭКГ, в том числе при ХМ) и анализом изменений волновой структуры межсистолических RR-интервалов ритмокардиограмм (Ркг). В математической обработке применялись методы статистического автокорреляционного и спектрального анализа с непараметрическим с быстрым преобразованием Фурье и окнами Хамминга и Парсена [1; 2]. Данные анализа ВСР у пациентов сопоставлялись с контрольной группой здоровых лиц (48 чел.). Синхронно с Ркг регистрировалась ЭКГ, эпизоды аритмий детально анализировались программными средствами с точностью до 1 миллисекунды. В статистическом временном анализе выделялись средние ВСР-показатели: средняя величина продолжительности RR-интервалов в секундах на анализируемой Ркг – (RR), стандартная девиации всех волн от средней величины RR (SDNN), среднеквадратические отклонения каждого вида ВСР волн – гуморально-метаболических (σl), а также симпатических (σm) и парасимпатических (σs) автономных регуляций, средняя амплитуда дыхательной аритмии (ARA). При определении соотношения степеней влияния названных 3 факторов регуляции пейсмекерной активности в СУ в программу анализа после быстрого преобразования и разложения волновой структуры ВСР на разночастотные гармоники включено спектральное вычисление соответствующих 3 энергетических вкладов в общий тотальный спектр колебаний ВСР (100%) с применением их разделения спектральными окнами. В программе «Микор» степень воздействия каждого фактора регуляции представлена процентными долями воздействия на пейсмекеры – гуморально-метаболического влияния в очень низкочастотном диапазоне (VLF%), симпатическом низкочастотном (LF%) и парасимпатическом высокочастотном (HF%) (рис. 1). Как принято в клинической вегетологии, запись ВСР осуществлялась с использованием стимулирующих проб в клинико-экспериментальном методе А.М. Вейна с соавт. (2003), направленных преимущественно на один из факторов, характеризующих регуляцию СУ в состоянии покоя (Ph), в пробах парасимпатической Вальсальвы-Бюркера (Vm), гуморально-метаболической Ашнера (pA), симпатической активной ортостатической (Aop) и в нагрузочной пробе, дозированной по ЧСС120 (PWC). В каждой из 5 позиций регистрировалось 260-300 RR-интервалов в соответствии с требованиями спектрального анализа, всего 1500-1800 при однократном РКГ-исследовании. Анализировались постстимульный результат стационарной Ркг, а также отдельно периоды стимуляции в пробах по максимальной реакции на стимул в процентах относительно исхода (ΔRR%), по времени достижения её (tAB) и восстановления после действия стимула (tr). Все показатели статистического анализа, tAB и tr представлены в секундах (с), спектрального соотношения факторов регуляции и максимальной реакции в пробах – в процентах [1; 3]. Вычислялись также показатели, нормированные на исход по формуле Wielder (1957) -nu для учёта «Закона исходного уровня» – nuRR, nu SDNN и т.д. При обработке материалов использовались программа Stat-10, метод Спирмена с пакетом SPSS 12.0, нормальность распределения проверялась по коэффициенту Колмогорова с апроксимацией по Ю.Н. Тюрину. Использовались критерии t и z – аналог t для непараметрических выборок большого объёма (рис. 1).
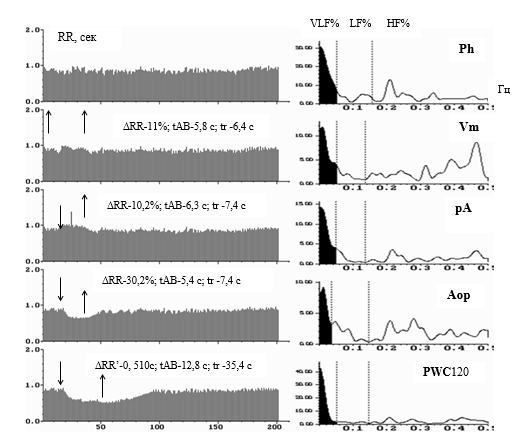
Рис. 1. Ритмокардиограммы и спектрограммы здорового человека в 5 позициях: в покое лёжа (Ph), в пробах Вальсальвы-Бюркера (Vm), Ашнера (pA), активной ортостатической (Aop), с физической нагрузкой (PWC120). На всех РКГ в спектральном анализе преобладает спектральная площадь высокочастотной парасимпатической регуляции-HF% (белая часть спектрограмм между 0,15 и 0,4 Гц), средняя часть спектра характеризует симпатическое влияние в СУ- LF% (между 0,033 и 0,15 Гц), черная часть спектра соответствует очень низкочастотной гуморально-метаболической периодике – VLF% (<0,01-0,033 Гц). Спектральное соотношение регулирующих факторов соответствует нормальному преобладанию парасимпатического и симпатического воздействия. Достаточные реакции в пробах в периодах стимуляции, с восстановлением после действия стимула в пределах нормы
Результаты и их обсуждение. Применение в течение 24 лет на практике РКГ-обследований пациентов с кардиоваскулярной патологией доказывает, что на Ркг регистрируется большинство клинических форм КА, в том числе при ДФСУ и СССУ. 25-минутный неинвазивный РКГ-мониторинг удобен, имеет ряд преимуществ, не реализуемых при других электродиагностических методах, в том числе при ЭКГ и ХМ с низкой частотой дискретизации ЭКС. ДФСУ имеет дифференцированные РКГ-симптомы, поддающиеся точной оценке по частоте, клиническим формам и их соотношению между собой. Это имеет значимость в дифференциальной диагностике между ДФСУ и синдромом слабости СУ (СССУ) органического патогенеза, необходимой при выборе интервенционного и/или консервативного лечения. РКГ-исследование, как дополнительный метод, полезно и позволяет решить многие интрадиагностические и лечебные вопросы. РКГ-исследование было проведено у 270 и 92 пациентов с ДФСУ и СССУ 2 степени 1 и 2 типа ишемического генеза. В анамнезе и при обследовании у больных на ЭКГ регистрировались изменения величины и формы з. Р, как предиктора миграции водителя ритма по СУ и предсердиям. На РКГ и ЭКГ у 360 пациентов регистрировалась периодика Венкебаха характерной формы с блокированной первой паузой, удлинёнными последующими интервалами с уменьшающимся декрементом, синоатриальная блокада 2 степени, другие симптомы аритмии (рис. 2).
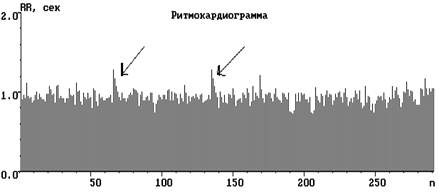
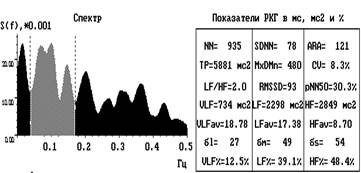
Рис. 2. Ритмокардиограммы, спектрограммы и цифровые значения показателей ВСР
молодого человека 19 лет с ДФСУ на фоне нормальной волновой структуры. СА блокада 1 ст., 1 типа представлена в виде периодики Венкебаха группами удлинённых интервалов с уменьшающимся декрементом. В спектральном соотношении регулирующих факторов парасимпатическая доля влияния на пейсмекеры СУ наибольшая
По нашим данным, при ДФСУ аритмии не обязательно возникали на фоне брадикардии. Среди наблюдавшихся больных было 83 случая с нормокардией и даже умеренной тахикардией. Классическим же вариантом РКГ-симптомов ДФСУ были: увеличение средней величины RR (брадикардия), повышенная реакция RR-интервалов на парасимпатические стимулы и учащение эпизодов КА в Vm и pA (рис. 3), зависимость частоты КА от симпатических стимулов после постурального перехода в Аор и при нагрузке в PWC120; снижение уровня РКГ, а также урежение эпизодов КА в ответ на введение атропина в достаточной дозе.
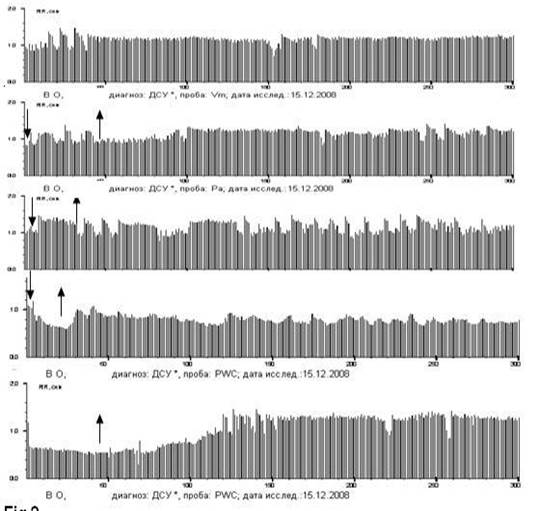
Рис. 3. Ритмокардиограммы 54-летнего мужчины с ДФСУ на фоне артериальной гипертензии, о чём свидетельствует увеличение симпатической периодики – LF%, особенно выраженная в активном ортостазе. ДФСУ проявляется периодикой Венкебаха с удлинённой блокированной первой паузой и последующими удлинёнными интервалами со снижающимся декрементом. Хорошая реакция в Аор, в PWC120 c быстрым восстановлением после действия стимулов свидетельствуют об отсутствии поражения миокарда. Имеется зависимость СА-блокады от парасимпатического фактора регуляции, и снова в PWC аритмии стали чаще в начале позы лёжа, а также в пробе Ашнера, в позе лёжа на уровне интервалов 120-160 на нижней РКГ. В данном случае необходимо лечение препаратами симпатомиметического действия в титрованной дозе
Выделение из ДФСУ формы СССУ с органическим нарушениями в СУ носит условный характер. Однако в силу общепринятых представлений это может считаться целесообразным для выбора врачебной тактики. При СССУ наиболее постоянными РКГ особенностями были: меньшая, чем при ДФСУ, зависимость КА от тонуса того или иного отдела автономной системы, характер зависимости СССУ от регуляции парасимпатического отдела был не столь прямолинейный, как при ДФСУ. При СССУ оказалось возможным изменение клинической формы КА с переходом в парасистолию, аллоритмию и суправентрикулярную бигеминию – в 22 (23%) случаях. Экстрасистолия может перейти в аллоритмию или фибрилляцию предсердий (рис. 4).
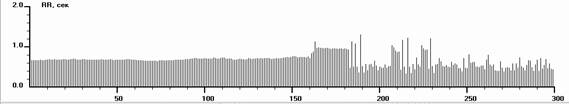

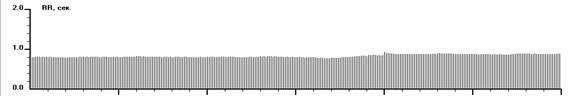
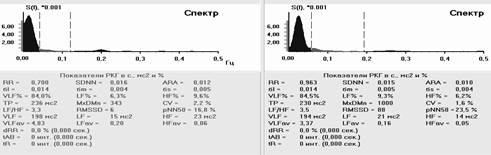

Рис. 4. Ритмокардиограммы, спектрограммы и значения РКГ-показателей у больного с СССУ на фоне автономной кардионейропатии, выраженной стабилизацией ВСР и отсутствием реакций на стимулы в пробах. От 182 интервала в Ph до 138 в Vm фибрилляция предсердий. Отсутствуют реакции на стимулы в пробах. Спектральный анализ показывает стойкий переход на гуморально-метаболический – VLF% уровень регуляции ритмом. Близок переход в перманентную форму фибрилляции предсердий. В данном случае необходима установка искусственного водителя ритмом в сочетании с препаратами трофотропного действия
При СССУ достоверно чаще, у 74 (80, 43%), чем при ДФСУ – у 139 (51,48%) пациентов, соответственно (p<0,01). У больных с СССУ ВСР сопровождалась снижением амплитуды волн вплоть до автономной кардионейропатии (АКН), со стабилизацией ритма, значительным снижением или отсутствием реакций в пробах. Атропиновая проба обычно была отрицательная, у 74 (80,4%) пациентов с СССУ. При ДФСУ после атропина аритмии не исчезали, но в зависимости от его дозы они становились реже, у 205 (75,9%). У больных с ДФСУ с более сохранной ВСР снижались на атропин средние значения SDNN, ARA, ss, уменьшалось число КА. Однако при СССУ КА никогда не исчезали полностью. СССУ чаще, чем ДФСУ, сопровождалась ЭКГ-предикторами миграции водителя ритма по предсердиям в виде изменений з. Р - у 92 (100%) и 132 (48,9%) пациентов с СССУ и ДФСУ (p<0,001).
При дифференциальной РКГ-диагностике между ДФСУ и СССУ найдено, что у больных с ДФСУ ВСР более сохранная (рис. 2), нежели при СССУ. При синоатриальной блокаде 1 ст. на РКГ были: RR более 1 сек., снижалось значение SDNN, нарушалось нормальное соотношение частотных диапазонов в спектрах. При синоатриальной блокаде 2 ст. снижение ВСР было более выраженное, чем при 1 ст., и регистрировалась стабилизация ВСР – у 112 (30,93% из всех пациентов) (рис. 4). На ЭКГ были изменения величины PQ, размеров и формы з. Р, а также альтернация з. R. ЭКГ-симптомы миграции водителя ритма были у 133 (49,2%) при ДФСУ и у 94 (100%) больных при СССУ (p<0.001). Эпизоды Венкебаха встречались чаще блокад Мобитца (всего в 2 случаях). Им сопутствовали и другие КА, часто суправентрикулярные экстрасистолы, аллоритмии, непостоянная форма фибрилляции предсердий и другие. Они хорошо регистрировались на РКГ и удобно анализировались. При проспективном наблюдении 18 случаев и сохранности в пробе с атропином трёхкомпонентной структуры ВСР лечебное вмешательство может быть минимальным. Клинически выраженные СССУ в 74 (80,4%) случаях сопровождались стабилизацией ВСР, отсутствием или снижением реактивности ВСР, что соответствовало АКН. Все показатели ВСР при АКН были в 2-5 раз ниже нормы при критерии t=8,23-18,4 и p<0,01-0,001, то есть с высокой достоверностью (рис. 4). При наблюдении за больными в динамике (28 чел. из числа отобранных с ДФСУ и СССУ) АКН формировалась сначала в виде потери нормального парасимпатического преобладания в СУ, затем увеличивалась доля VLF% за счёт снижения спектральной мощности автономных показателей – HF% и LF%, снижались реакции в пробах. Гистоморфологические исследования аутопсийных материалов 2 умерших пациентов, у которых по данным РКГ при жизни была АКН, выявили признаки дистрофии пейсмекерных клеток в СУ, что даёт основание считать, что АКН обусловлена не только автономной денервацией в СУ, но также морфологическими и, соответственно, функциональными изменениями в самих пейсмекерных клетках. После работ D. Ewing et al. (1978) и других авторов АКН признана предиктором высокого риска летального исхода (рис. 5).
Одно из главных преимуществ РКГ-исследования – возможность оценки многовариантного, диагностически и терапевтически значимого аритмогенного периферического вегетативного фона КА. РКГ-оценка автономной регуляции пейсмекерной активности СУ оказалась результативной и в диагностике ДФСУ ишемического генеза.
 1
1 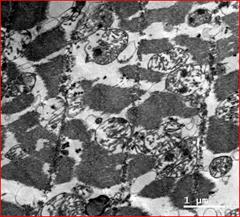 2
2
Рис. 5. Электронноскопические гистологические структуры пейсмекерных клеток синоатриального узла у человека, погибшего от некардиологической причины (слева - 1), и у пациента с автономной кардионейропатией при жизни (справа - 2), с ишемической болезнью и нарушениями ритма сердца разных клинических форм, в том числе с синоатриальной блокадой 2 типа, 2-3 степени
Примечание: 1. На гистологическом препарате Р-клетки синоатриального узла человека, не болевшего и погибшего от травмы, нормальная тканевая структура, хорошо выраженные митохондрии с кристами. 2. На гистологическом препарате Р-клетки синоатриального узла пациента, имевшего при жизни на РКГ симптомы автономной кардионейропатии со стабилизацией ВСР и отсутствием реакций на стимулы в пробах. Видны структурные изменения митохондрий, разрушенные кристы, скопления кальцинатов в митохондриях, что соответствует дистрофическим субклеточным изменениям
На сегодня РКГ – пока единственный метод, который позволяет определить автономный аритмогенный фон и гемодинамическое значение эпизодов аритмии. АКН с наибольшей вероятностью соотносится с СССУ и ставит вопрос об искусственном водителе ритма. РКГ не инвазивна, поэтому может быть рекомендована как многократный, кратковременный, контролируемый и управляемый мониторинг основной сократительной деятельности сердца. Метод определяет направление диагностического поиска, форму и особенности ДФСУ. Частота КА при СССУ прямо средне значимо коррелировала (r=0,383-0,456) с увеличением частоты и продолжительности эпизодов стабилизации, характерных для отрицательной динамики при формировании острого коронарного синдрома – у 34 (36,2%) пациентов с СССУ. Сердечной недостаточности при ИБС соответствовало прогрессирующее снижение, медленное восстановление ВСР в пробах. Связь ДФСУ с приступами и нарушениями гемодинамики доказывалась предиспонирующим усугублением снижения амплитуды ВСР из-за гибернации пейсмекерных клеток при нарушении перфузии в СУ. Провокация КА холодом также была обусловлена ишемией миокарда, сопровождалась смещением ST и снижением ВСР (r=0,354). АКН предшествовала фибрилляции предсердий (ФП) по известному сценарию - пароксизмы ФП и затем её постоянная форма – 38 случаев с СССУ за период наблюдений. РКГ-исследование позволяло оценить гемодинамическую значимость эпизодов КА при ДФСУ. Она проявлялась изменением уровня Ркг и снижением ВСР после КА, снижением реагирования в пробах, изменением их клинической формы, учащением ишемических эпизодов на РКГ, сменой фиксированного порога ишемии на вариабельный, увеличением периода восстановления после действия стимулов в пробах и др. В 118 (32,6%) случаях КА провоцировались ишемическими эпизодами со стабилизацией ВСР, в 112 (34,35%) КА предшествовали ишемическим эпизодам.
Следовательно, ДФСУ, как синдром преимущественно функциональных нарушений пейсмекерной активности СУ, сопровождается более сохранной волновой структурой ВСР по сравнению с СССУ, хотя на фоне хронического нарушения перфузии тканей сердца из-за ИБС эта сохранность - явление временное и манифестирует несостоятельность пейсмекеров СУ, требует наблюдения и лечения. СССУ является более тяжёлой и мало перспективной патологией, проявляющейся нередко стабилизацией ВСР в виде АКН с повышенным риском летального исхода. Характерными проявлениями тяжести этого варианта патологии СУ ишемического генеза являются, помимо ЭКГ-симптомов, прогрессирующее снижение ВСР вплоть до АКН, отсутствие реакций на стимулы любой направленности, отрицательная проба с атропином, пароксизмы ФП, грубые аритмогенные нарушения автономного фона регуляции ритма с переходом руководства хронотропной деятельностью сердца на медленный и неадекватный гуморально-метаболический уровень, возникновение гемодинамически значимых аритмий.
Таким образом, у пациентов с ИБС ДФСУ обязательно сопровождается нарушениями ВСР и клинически отрицательным усилением гуморально-метаболического влияния в СУ. В многоуровневой системе вегетативного руководства функциями сердца высокоточная клиническая оценка периферической автономной регуляции в СУ, где окончательно формируются симптомы болезни, наиболее близка к решению проблем аритмических форм ИБС и распознаванию клинических вариантов дисфункции СУ. Периферические дизрегуляции в СУ разнообразны, опосредуют клинику эктопии, имеют отношение и к формированию ДФСУ, патогенетически обусловленной ослаблением СУ, как пейсмекера первого порядка. Это ослабление функции СУ при РКГ-исследовании манифестируется снижением ВСР, адекватным степени потери роли главного пейсмекера в сократительной деятельности сердца. В этой связи АКН является максимальным выражением описываемой патологии. На сегодня РКГ высокого разрешения - единственный метод оценки периферической симпато-парасимпатической автономной регуляции СУ и влияния на неё гуморально-метаболической среды.
Выводы
1. У больных ИБС ДФСУ облигатно сопровождается многовариантной периферической автономной дизрегуляцией пейсмекерной активности СУ сердца.
2. При ДФСУ ишемического генеза РКГ-исследование с математическим анализом ВСР позволяет достаточно точно зарегистрировать и клинически интерпретировать форму дисфункции, определить автономный аритмогенный фон дизрегуляции, а также гемодинамическое значение каждого эпизода нарушений ритма.
3. Высокоточный РКГ-анализ ВСР содержит дифференцированные характеристики ДФСУ и СССУ для последующего выбора инвазивного и неинвазивного лечебного вмешательства.
4. Найдено, что СССУ с автономной кардионейропатией и предельно выраженным угнетением вегетативного руководства автоматически возбудимых клеток в СУ соответствуют структурные гистоморфологические дистрофические изменения пейсмекерных клеток в СУ сердца.
Библиографическая ссылка
Миронов В.А., Миронова Т.Ф., Куватова Е.В., Николаенко О.В. ВЫСОКОРАЗРЕШАЮЩИЙ АНАЛИЗ ВАРИАБЕЛЬНОСТИ СЕРДЕЧНОГО РИТМА У БОЛЬНЫХ С СИНОАТРИАЛЬНОЙ ДИСФУНКЦИЕЙ // Современные проблемы науки и образования. – 2017. – № 5. ;URL: https://science-education.ru/ru/article/view?id=27032 (дата обращения: 08.05.2024).



