Одним из основных направлений современных астробиологических исследований является определение пределов существования земной формы жизни и изучение возможностей и механизмов ее адаптации к стрессовым факторам среды. Ответы на эти вопросы могут быть получены при изучении экстремальных местообитаний Земли, по своим физико-химическим параметрам приближенным к условиям различных объектов Солнечной системы и открытого космоса. Такими экотопами являются жаркие и холодные пустыни, древние мерзлые отложения, горячие источники, подледные озера и др. В настоящее время активно ведутся исследования подобных местообитаний [1], изучается биоразнообразие и устойчивость населяющих их микроорганизмов к воздействию различных условий, в том числе не встречающихся на Земле. Имеющиеся на сегодняшний день данные убеждают в высокой резистентности земной формы жизни и демонстрируют многообразие механизмов ее адаптации и устойчивости, нередко взаимосвязанных. Тем не менее, пределы устойчивости микроорганизмов in situ ко многим факторам достоверно не определены, что подтверждается обнаружением все более экстремотолерантных микроорганизмов и микробных экосистем [1].
Биоразнообразие экстремальных экотопов также явно недостаточно изучено, несмотря на их интенсивные исследования в последние десятилетия [2]. Это связано с труднодоступностью данных местообитаний, высокой гетерогенностью почв и грунтов, обилием некультивируемых и труднокультивируемых микроорганизмов, а нередко и селективностью методических подходов. В частности, микробные сообщества пустыни Гибсона в центральной Австралии и юго-восточного района пустыни Сахара практически не исследованы [2]. Для данных экотопов характерны значительные флуктуации температур от экстремально высоких до экстремально низких, в течение как сезонных, так и суточных циклов, чрезвычайно низкая обеспеченность влагой и питательными веществами, повышенная инсоляция. Такой физико-химический режим приводит к постоянным изменениям условий существования микроорганизмов. В связи с этим возникает вопрос о возможности формирования таксономически и функционально разнообразных микробных сообществ в указанных местообитаниях. Ответ на этот вопрос необходим для понимания процессов адаптации, эволюции и функционирования микробных экосистем и биосферы в целом, а также для оценки возможности существования биологических форм жизни за пределами Земли.
Нами исследована численность и разнообразие бактерий в поверхностных грунтах пустыни Гибсона (центральная Австралия) и пустыни Сахара (северо-восточная Африка), а также реакция бактериальных комплексов на изменение температуры.
Материалы и методы
Для исследования использованы образцы поверхностного грунта, отобранные в пустыне Гибсона (образец GD) в центральной Австралии (22°00’N/126°29’E) и в северо-восточной части пустыни Сахара (образец SD) в Египте (22°21’N/25°28’E) с глубины 0–3 см. Объекты исследования выбраны, исходя из их приуроченности к малоисследованным регионам географически изолированных друг от друга пустынь и неблагоприятных климатических условий: контрастного температурного режима (флуктуации температур от –5 до + 50 °С), сильного высушивания (среднегодовое количество осадков 25–200 мм), высокой интенсивности солнечного излучения [3]. Оба образца являются грунтами песчаного гранулометрического состава. Образец SD – преимущественно кварцевый песок; образец GD – кварцевый песок, обогащенный железосодержащими минералами.
Определение численности аэробных гетеротрофных бактерий проводили методом прямого посева на плотную глюкозо-пептоно-дрожжевую (ГПД) питательную среду (глюкоза 1 г/л, пептон 2 г/л, дрожжевой экстракт 1 г/л, гидролизат казеина 1 г/л, CaCO3 0.5 г/л, агар-агар 20 г/л). Водные суспензии образцов обрабатывали на вортексе Heidolph Multi Reax в течение 30 мин при 2000 об./мин с целью десорбции клеток с минеральных частиц, затем суспензии в различных разведениях рассевали в трехкратной повторности с одновременным контролем стерильности среды и контролем присутствия воздушной микрофлоры. Культивирование проводили при температурах +10, +25 и +50 °С в течение 14 суток. Расчет содержания культивируемых бактерий проводили по формуле n = (m×P)/(b×a), где n – число колониеобразующих единиц (КОЕ) в 1 г образца, m – количество колоний на чашке, Р – показатель разведения, b – объем аликвоты суспензии, мл, a – масса абсолютно сухой навески, г [4].
Общую численность клеток прокариот определяли методом эпифлуоресцентной микроскопии (ЭФМ). Водную суспензию образца (1:50) обрабатывали на вортексе Heidolph Multi Reax в течение 60 мин при 2000 об./мин, затем готовили препараты в шестикратной повторности и фиксировали их нагреванием. Препараты окрашивали акридиновым оранжевым (раствор 1:10000) и просматривали на люминесцентном микроскопе Биомед-6 ПР ЛЮМ по 20 полей зрения для каждой повторности при увеличении ×700. Учитывали клетки с зеленым свечением. Численность клеток прокариот рассчитывали по формуле: N=(S1•a•n)/(V•S2•c), где N – число клеток в 1 г образца, S1 – площадь препарата, мкм2, a – количество клеток в поле зрения, n – показатель разведения почв, V – объем капли, наносимой на стекло, мл, S2 – площадь поля зрения микроскопа, мкм2, с – масса абсолютно сухой навески, г [4].
Идентификацию выделенных бактерий проводили с помощью анализа нуклеотидных последовательностей гена 16S рРНК. Геномную ДНК прокариот экстрагировали с использованием набора «Проба-экспресс» («Синтол», Россия) с добавлением 5 % Triton X-100 («AppliChem», Германия). Далее суспензию клеток в лизирующем растворе кипятили при 100 °C в течение 15 минут, после чего подвергали гомогенизации с использованием стеклянных шариков (50–200 µm) на гомогенизаторе Mini-BeadBeater (США) при 5000 об/мин в течение 60 с. Полимеразную цепную реакцию (ПЦР) проводили с использованием ПЦР-смеси «ScreenMix» («Евроген», Россия) с праймерами 63f + 1387r [5]. ПЦР-продукты были очищены и секвенированы (по методу Сэнгера) компанией «Синтол» (Москва, Россия) с использованием внутреннего праймера 1100r [5]. Полученные нуклеотидные последовательности редактировали с помощью программы Chromas Lite 2.01. Выравнивание, сравнение и идентификацию нуклеотидных последовательностей проводили, используя программу CLUSTALW2 и алгоритм BLAST базы данных GenBank. Полученные последовательности депонированы в базу данных NCBI GenBank под номерами MF773878, MF773879, MF927543 - MF927569.
Выделенные штаммы бактерий депонированы в Астробиологическую коллекцию микроорганизмов Национального банка-депозитария живых систем «Ноев ковчег» под номерами KBP.AS.95 - KBP.AS.104, KBP.AS.123 - KBP.AS.155,
KBP.AS.376 - KBP.AS.378.
Статистическую обработку данных проводили в программе Microsoft Office Excel 2013. Индексы биоразнообразия и сходства микробных сообществ рассчитывали согласно [6].
Результаты и обсуждение
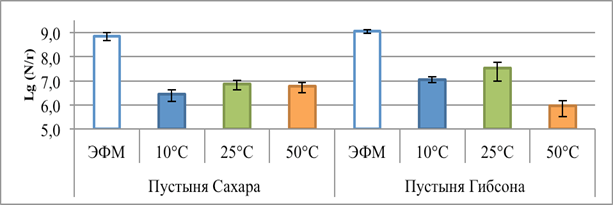 Численность клеток, выявляемая методом ЭФМ, составила 5.5-8.5×108 кл/г в образце из SD и 0.9-1.3×109 кл/г в образце GD (рис. 1).
Численность клеток, выявляемая методом ЭФМ, составила 5.5-8.5×108 кл/г в образце из SD и 0.9-1.3×109 кл/г в образце GD (рис. 1).
Рис. 1. Показатели численности клеток в исследуемых образцах, полученные методом эпифлуоресцентной микроскопии (ЭФМ) и методом посева на плотные питательные среды при разных температурах культивирования (+10 °С, +25 °С, +50 °С)
Максимальную численность аэробных гетеротрофных бактерий, репродуцирующих на питательных средах, во всех образцах наблюдали при культивировании в мезофильном температурном диапазоне (+25 °С), она составляла 5.5-8.7×106 КОЕ/г и 1.3-5.3×107 КОЕ/г для образцов SD и GD соответственно. Такие показатели позволяют говорить о высокой обогащенности исследуемых пустынь микробными клетками и дают основания утверждать, что значительная доля имеющихся в образцах клеток культивируется на питательных средах; коэффициент К (отношение общей численности клеток к числу КОЕ) равен 99.2 и 34.3 для образцов SD и GD соответственно.
Близкие значения численности культивируемых бактерий были обнаружены в почвах северо-западных районов Египта и составляют 0.6-2×108 КОЕ/г [7]. В то же время, в почвах чрезвычайно жаркой и засушливой пустыни Атакама (Чили) методом анализа фосфолипидных маркеров (PLFA) было обнаружено 2.0×106–1.0×107 эквивалентов кл/г, в то время как репродуцировали на питательных средах 1.6-4.6×103 КОЕ/г и коэффициент К составлял 466.6 [8]. Возможно, высокая численность бактерий в исследованных нами пустынных грунтах связана с атмосферным привносом клеток. Однако необходимо отметить, что высокая доля культивируемых на питательных средах бактерий ранее обнаруживалась и в других экстремально ксерофитных экотопах [9].
При культивировании посевов при +50 °С численность КОЕ уменьшалась на один – два порядка во всех образцах, что коррелирует с данными, полученными для других засушливых экосистем [7]. Отмечено значительное снижение видового разнообразия по сравнению с мезофильными условиями культивирования: в обоих сообществах наблюдали развитие только представителей рода Bacillus. Ранее было показано наличие в пустынных экосистемах представителей этого рода, устойчивых к повышению температуры [10]. В целом, известна высокая устойчивость бацилл и их спор к широкому спектру экстремальных воздействий [11].
При температуре +10 °С число КОЕ в образцах было в 2 раза ниже численности репродуцирующих при +25 °С клеток. Однако, в отличие от реакции сообществ на повышение температуры, не наблюдалось значительных изменений таксономического состава сообществ. При пониженных температурах существенно изменялась динамика появления колоний на питательной среде – при температурах +25 и +50 °С появление колоний начиналось через 48–72 часа, в то время как при +10 °С формирование колоний наблюдали примерно на 14-е сутки культивирования и процесс прекращался в течение суток. Такая реакция бактериального комплекса на понижение температуры, вероятно, связана с внутренними физиологическими перестройками в клетках, синтезом индуцибельных ферментов и белков холодового шока, необходимых для роста и размножения при пониженных температурах [12] или же с выходом из анабиотического состояния [13].
Структура аэробных гетеротрофных бактериальных комплексов, культивируемых на ГПД среде при +25 °С, представлена на рис. 2. Отметим, что структура комплекса, развивавшегося при +10 °С, идентична структуре комплекса репродуцирующего при +25 °С (на рисунке не показана). Микробные комплексы в обоих исследованных аридных образцах имели умеренное сходство: индекс общности Жаккара равен 31 %, по индексу Чекановского-Серенсена сообщества сходны на 48 %.
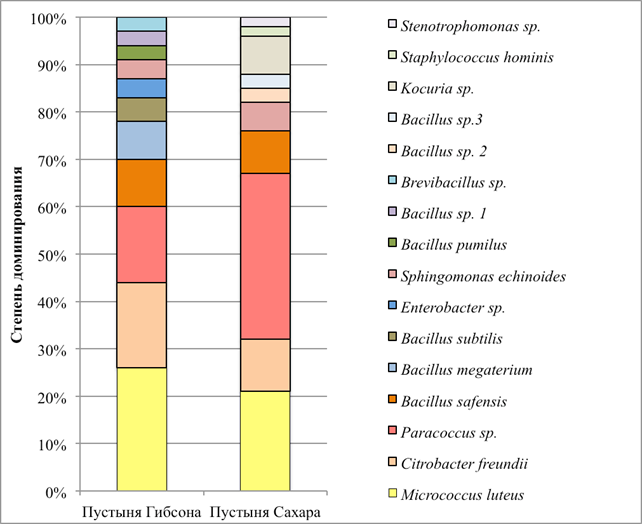
Рис. 2. Структура аэробных гетеротрофных бактериальных комплексов исследованных образцов
Исследованные экотопы характеризуются умеренным видовым разнообразием, большее разнообразие отмечено в бактериальном комплексе пустыни Гибсона (таблица). В обеих экосистемах доминируют пигментированные актинобактерии Micrococcus luteus и протеобактерии Paracoccus sp. В бактериальном комплексе пустыни Гибсона доминирующую позицию занимают также протеобактерии Citrobacter frеundii.
Индексы биологического разнообразия и сходства сообществ
|
Индекс |
Образец GD |
Образец SD |
|
Индекс Шеннона, Н |
3.04 |
2.73 |
|
Выровненность, Е |
87 % |
82 % |
|
Индекс Жаккара, Sj |
31 % |
|
|
Индекс Чекановского-Серенсена |
48 % |
|
|
Модифицированный индекс Серенсена |
61 % |
|
Cубдоминантами в этом бактериальном сообществе являются Bacillus safensis, Bacillus megaterium, в виде минорных компонент идентифицированы Bacillus subtilis, Enterobacter sp., Sphingomonas echinoides, Bacillus pumilus, Bacillus sp. 1, Brevibacillus sp. В образце из пустыни Сахара субдоминантную позицию занимают также Bacillus safensis и Citrobacter freundii, в виде минорных компонент обнаружены Sphingomonas echinoides, Bacillus sp. 2, Bacillus sp. 3, Kocuria sp., Staphylococcus hominis и Stenotrophomonas sp.
Ранее в аридных почвах центральной части чрезвычайно засушливой пустыни Атакама были обнаружены представители филумов Actinobacteria и Firmicutes с незначительным участием представителей филума Proteobacteria; идентифицированы представители родов Bacillus, Sphingomonas, Asticcacaulis, Mesorhizobium, Bradyrhizobium и Afipia; методом дифференциального градиентного гель-электрофореза обнаружены представители семейства Gemmatimonadetes, и филумов Actinobacteria, Planctomycetes, Thermomicrobia, и Proteobacteria [8, 12]. Высокая доля пигментированных форм в структуре обоих исследованных бактериальных сообществ, по-видимому, связана с высокой инсоляцией и агрессивной физико-химической обстановкой в исследованных экосистемах, в условиях которых пигменты осуществляют протекторную функцию [12]. В целом, микробные комплексы проявляют термотолерантные свойства: сообщества активно функционируют в диапазоне от +10 до +25 °С включительно, с повышением температуры наблюдается сокращение метаболически активного сегмента комплекса, однако, как упоминалось выше, наибольшее разнообразие наблюдается в мезофильном температурном диапазоне.
Таким образом, в аридных почвах пустынь выгодной для сохранения жизнеспособности и физиологической активности является стратегия толерантности к флуктуациям температуры, а не выделение фактор-ориентированных групп (психрофилов, мезофиллов, термофилов). Ранее было показано, что микробные комплексы экстремально холодных ксерофитных местообитаний наиболее активно развиваются в мезофильных условиях, несмотря на то, что in situ длительное время существуют и метаболизируют в условиях низких температур и хорошо к ним адаптированы [9]. При наступлении неблагоприятных условий происходит переход отдельных представителей сообщества в неактивное состояние. Результаты настоящего исследования и полученные ранее аналогичные выводы для постоянно холодных аридных местообитаний: древней мерзлоты Арктики и Антарктиды, позволяют говорить о том, что адаптация к стрессу (в данном случае, резким колебаниям температуры) развивается по пути расширения диапазона толерантности природных микробных сообществ к воздействию стресс-факторов.
В составе исследованных микробных комплексов представлены основные физиологические группы микроорганизмов: присутствуют как аэробные гидролитические бактерии (Bacillus, Brevibacillus, Kocuria, Micrococcus), так и микрофлора рассеяния (Citrococcus, Enterobacter, Paracoccus, Stenotrophomonas, Sphingomonas, Staphylococcus), что свидетельствует о функциональном разнообразии сообществ.
Исследованные бактериальные гетеротрофные сообщества экстремально засушливых экотопов реализуют преимущественно r-стратегию развития [6] при наступлении благоприятных условий комплекс быстро переходит в репродуктивно активное состояние. При снижении температуры до +10 °С изменяется скорость репродукции при неизменном таксономическом составе сообществ. Это свидетельствует о наличии механизмов устойчивости к резкому изменению температуры. Повышение температуры до +50 °С переводит большую часть комплекса в состояние метаболического покоя до возвращения условий к благоприятным для жизнедеятельности. В частности, для доминирующих в обоих исследованных сообществах представителей вида Micrococcus luteus ранее была показана высокая устойчивость к высушиванию и быстрое восстановление метаболической активности при повторном увлажнении [14].
Заключение
Природные экстремальные местообитания, широко распространенные в современной биосфере, являются уникальным резервуаром живых организмов, адаптировавших свой метаболизм к комплексу различных стрессовых воздействий. В силу многообразия таких природных сред и высокой гетерогенности, вмещающей микробные клетки минеральной матрицы, до сих пор актуальным является изучение биологического разнообразия этих экотопов. Исследования экстремальных местообитаний Земли позволяют оценить предельные возможности существования жизни, коренным образом меняют представления о жизнеспособности организмов и представляют собой базовую информацию для развития новой области научного знания – астробиологии.
Проведенное нами исследование позволяет утверждать, что бактериальные комплексы поверхностных грунтов пустыни Гибсона (центральная Австралия) и пустыни Сахара (северо-восточная Африка) характеризуются высокой общей численностью прокариот и высоким содержанием репродуцирующих клеток. Отмечено умеренное биологическое разнообразие и обнаружены микроорганизмы различных физиологических групп, что свидетельствует о возможности полноценного функционирования систем в естественных условиях и подтверждает высокую резистентность природных микробных сообществ к неблагоприятным факторам среды.
Полученные данные о таксономическом и потенциальном физиологическом разнообразии исследуемых природных пустынных комплексов свидетельствуют о том, что экстремальные аридные условия инициируют формирование физиологических механизмов защиты от стрессовых колебаний температуры с сохранением репродукции, поддержанием обилия бактериальных популяций и гомеостаза экосистем в целом.
Таким образом, предполагается потенциальная возможность круглогодичного сохранения репродуктивной и метаболической активности в пустынных экосистемах и, следовательно, их участия в глобальных биогеохимических циклах. Новые сведения о высокой заселенности наиболее экстремально аридных экотопов Земли при биоразнообразии населяющих их микробных сообществ свидетельствуют в пользу мнения о возможности выживания микроорганизмов земного типа в минеральной среде в космических и инопланетных условиях.
Исследования пустынных экосистем Земли требуют продолжения. Необходим анализ воздействия различных природных комбинаций физико-химических факторов на населяющие эти биотопы микробные сообщества, выявление ключевых лимитирующих воздействий, оценка продуктивности в градиенте стрессовой нагрузки, исследование адаптивного потенциала и универсальных и специфических механизмов устойчивости.
Авторы выражают благодарность сотрудникам кафедры общего почвоведения факультета почвоведения МГУ им. Ломоносова за предоставленные образцы пустынных грунтов.
Работа выполнена при поддержке гранта Российского научного фонда № 14-50-00029 (в части количественной оценки бактериальных комплексов, выделения и идентификации культур), а также Программой фундаментальных исследований президиума РАН «Эволюция органического мира и планетарных процессов».
Библиографическая ссылка
Белов А.А., Чепцов В.С., Воробьева Е.А. БИОРАЗНООБРАЗИЕ И ТАКСОНОМИЧЕСКАЯ СТРУКТУРА АЭРОБНЫХ ГЕТЕРОТРОФНЫХ БАКТЕРИАЛЬНЫХ КОМПЛЕКСОВ НЕКОТОРЫХ ПУСТЫННЫХ ЭКОСИСТЕМ // Современные проблемы науки и образования. 2017. № 5. ;URL: https://science-education.ru/ru/article/view?id=26864 (дата обращения: 01.07.2025).



