В клинической практике хорошо известны случаи различного течения опухолевого процесса и его исхода у больных РП (раком почки), которые имели идентичные морфологические формы и стадию заболевания. Причины этого нередко наблюдаемого в клинической практике явления остаются неясными. Понимание механизмов, задействованных в процессах прогрессирования ПКР - один из возможных путей совершенствования методов прогноза и его рационального лечения.
Среди разнообразных направлений исследований в фундаментальной онкологии последние два десятилетия большое внимание уделяют изучению микроокружения (МкО) опухоли и вопросу о его морфологических составляющих. К таковым относят экстрацеллюлярный матрикс и клетки соединительной ткани (стромы органа), клетки системы иммунитета, кровеносные и лимфатические сосуды. Основными клетками, определяющими особенности МкО, являются фибробласты, миофибробласты, перициты. муральные клетки (формируют внутренний слой сосудов), многочисленные клетки системы иммунитета, в первую очередь нейтрофилы, макрофаги, тучные клетки (ТК) и др., а в некоторых случаях адипоциты [3; 7].
Интерес к изучению микроокружения клеток злокачественных новообразований, и в том числе к стромальным интратуморальным тучным клеткам (ТК), сохраняется на протяжении последних десятилетий [2; 4; 6; 10; 11]. Известно, что подобно другим клеткам системы иммунитета, их роль в опухолевом процессе может быть двоякой - усиление или торможение роста опухоли [1].
ТК присутствуют в нормальной и патологически измененной почке [6; 13]. Имеется небольшое количество работ, посвященных исследованию прогностического значения ТК при почечно-клеточном раке (ПКР). По данным Tune B. и соавт. [15], содержание интратуморальных ТК было значительно выше при раке почки (РП), чем в нормальной почечной ткани, что, по заключению данных авторов, объясняется их участием в туморогенезе. Но в то же время авторами не было найдено взаимосвязей между числом ТК в опухоли ПКР и клинической стадией, размером опухолевого узла, градацией по Fuhrman, кроме гистологического типа. Авторы отмечают, что количество ТК значительно возрастало в светлоклеточных карциномах. Более высокое число интратуморальных ТК в светлоклеточных карциномах авторы объясняют значительной метаболической потребностью клеток данного гистологического варианта РП. Аналогичные данные получили и другие авторы [12]. В то же время Guldur M.E. и соавт. [9] нашли значимые взаимосвязи между числом ТК в опухоли и стадией, градацией по Fuhrman, размером и гистологическим типом опухоли. Этими авторами также было показано, что число ТК значительно возрастало в светлоклеточном варианте рака, по сравнению с другими гистологическими типами ПКР.
Таким образом, данные исследователей о роли ТК, при злокачественных новообразованиях довольно противоречивы, а исследований, посвященных изучению ТК при ПКР, незначительное количество, и поэтому ТК опухоли при ПКР нуждаются в дальнейшем изучении.
Цель исследования – изучить частоту встречаемости интратуморальных ТК при почечно-клеточном раке и поиск взаимосвязей с важными клинико-анатомическими факторами прогноза и послеоперационной выживаемостью больных
Материал и методы исследования
Изучен операционный материал 63 больных ПКР. Сведения о выживаемости больных получали по данным канцер-регистра злокачественных заболеваний и амбулаторных карт КГБУЗ АКОД «Алтайский краевой онкологический диспансер» (за 2010-2016 гг.).
Контролем служила ткань почек, забранная из максимально удаленных от опухоли участков, без выраженных явлений воспаления и склероза.
После фиксации в 10%-ном нейтральном забуференном формалине на протяжении 12-24 часов и заливки в парафин срезы окрашивали гематоксилин-эозином и изучали под световым микроскопом. ТК выявляли иммуногистохимическим методом с помощью моноклональных антител С-kit (CD117) (клон А4052, разведение 1:200, DAKO) по рекомендованному производителем протоколу. В каждом случае высчитывали среднее количество ТК в 3 полях зрения при увеличении микроскопа х 400.
Средний возраст пациентов составил 58,2±1,2 года. Мужчин было 34 (54%), женщин - 29 (46%). По гистологическому строению опухоли были представлены следующим образом: светлоклеточный рак - 48; зернистоклеточный рак - 4; папиллярный рак – 5; хромофобный рак – 3 и веретеноклеточный (саркоматоидный) рак – 3.
Степень распространенности опухолевого процесса оценивалась в соответствии с TNM-классификацией злокачественных опухолей (TNM Classification of Malignant Tumors, editedby SobinL.H., 2002) [14]. Среди наших больных Ι клинической стадии (T1N0M0) соответствовали 47 (74,6%) наблюдений; ΙΙ стадии (T2N0M0) - 3 (4,8%); ΙΙΙ стадии (T1N1M0, T2N1M0, T3N0M0, T3N1M0) - 8 (12,7%) и ΙV стадии (T4N0M0, T4N1M0, TлюбаяN2M1, TлюбаяNлюбаяM1) - 5 (7,9%).
Степень злокачественности опухолевых клеток оценивали по Fuhrman S.A. и соавт., (1982) [5; 8]. Степени анаплазии G1 соответствовала 31 опухоль (49,2%), степени анаплазии G2 – 14 (22,2%) опухолей, степени анаплазии G3 - 13 (20,6%) и степени анаплазии G4 – 5 (8%).
Карцином с регионарными и отдаленными метастазами было 11 (17,5%), локализованных опухолей – 52 (82,5%).
Средний размер опухолевого узла составил - 7,1±0,3 см.
Статистическая обработка материала проводилась при помощи статистического пакета Statistica 6.0, с использованием методов непараметрической статистики: U-критерий Манна-Уитни, коэффициент ранговой корреляции Спирмена (r), при сравнении нескольких независимых групп - критерий Краскела-Уоллиса. Построение кривых выживаемости проводили по методу Kaplan-Meier, достоверность различий показателей выживаемости оценивали с помощью log-rank теста. Данные считали статистически значимыми при значении р < 0,05.
Результаты исследования и их обсуждение
Результаты проведенного исследования показали, что в неизмененной ткани почки ТК располагались поодиночке или группами. Они имели круглую, овальную или отросчатую форму и располагались преимущественно в интерстициальной ткани, около сосудов и между канальцами. В среднем число ТК в ткани почки составило 2,3±0,2 в 3 полях зрения при увеличении микроскопа х 400. Во фрагментах, взятых из центральных отделов опухоли, ТК имели округлую, овальную, реже отросчатую форму. Среди всех больных ПКР вне зависимости от пола, возраста, гистологического типа и других клинико-морфологических показателей разброс средних значений плотности распределения ТК колебался от 0 до 10. Среднее значение плотности распределения ТК при ПКР составило 2,5±0,2.
Сопоставление среднего числа интратуморальных ТК в строме опухоли c прогностически важными клинико-анатомическими факторами ПКР позволило выявить некоторые важные корреляционные взаимосвязи. Плотность распределения ТК была взаимосвязана: c клинической стадией заболевания (r = 0,69; p = 0,0001), c размером опухолевого узла (r = 0,58; p = 0,0001), со степенью анаплазии опухоли по Fuhrman (r = 0,89; p = 0,001), c наличием регионарных и дистантных метастазов (r = 0,48; p = 0,0001) и с послеоперационной выживаемостью больных (r = 0,40; p = 0,001). Не было обнаружено взаимосвязей с полом (r = - 0,03; p = 0,8), возрастом (r = - 0,15; r = 0,25) больных и гистологическим вариантом опухоли (r = 0,16; p = 0,19) (табл. 1).
Таблица 1
Корреляционные взаимосвязи плотности распределения ТК с клинико-морфологическими параметрами ПКР
|
Клинико-морфологический параметр |
Коэффициент корреляции (r) |
Значение (р) |
|
Клиническая стадия |
0,69 |
0,0001 |
|
Размер опухолевого узла |
0,58 |
0,0001 |
|
Степень анаплазии опухоли по Fuhrman |
0,89 |
0,001 |
|
Наличие регионарных и дистантных метастазов |
0,48 |
0,0001 |
|
Послеоперационная выживаемость больных |
0,40 |
0,001 |
|
Пол пациентов |
0,03 |
- |
|
Возраст пациентов |
- 0,15 |
- |
|
Гистологический вариант опухоли |
0,16 |
- |
Среднее значение интратуморальных ТК в опухолях у мужчин составило 2,6±0,2, у женщин - 2,4±0,2 (p = 0,6).
В зависимости от возраста пациентов средние показатели числа ТК составили у больных в возрасте от 30 до 39 лет – 1,0±0,4; от 40 до 49 лет - 3,7±0,4; от 50 до 59 лет - 2,5±0,3; от 60 до 69 лет - 2,4±0,3 и от 70 до 79 лет - 1,8±0,25. Таким образом, наиболее высокие показатели интратуморальных ТК в строме опухоли наблюдали в возрастной группе больных от 40 до 49 лет, а наиболее низкие в группе от 30 до 39 лет.
При анализе содержания ТК в опухоли в зависимости от клинической стадии заболевания по TNM получены следующие результаты: у пациентов с I клинической стадией среднее число ТК составило 1,85±0,15; со II стадией число ТК возрастало до 2,7±0,4 (p = 0,2); при III стадии количество ТК увеличивалось до 4,3±0,4 (p = 0,003), и при IV стадии оно равнялось 6,3± 0,6 (p = 0,005). Таким образом, в III и IV стадиях отмечали достоверное увеличение ТК по сравнению с I стадией, а в IV стадии число ТК значимо возрастало по сравнению с III стадией патологического процесса.
В зависимости от гистологического варианта ПКР наибольшее среднее количество интратуморальных ТК обнаружено в веретеноклеточной карциноме (6,3±0,6), а наименьшее значение имел папиллярный рак 1,05±0,4. Промежуточное положение занимали светлоклеточный (2,2±0,2) и хромофобный (2,4±0,4) раки и зернистоклеточный вариант светлоклеточного рака (6,1±0,8). Таким образом, наибольшее число ТК выявляли в веретеноклеточном варианте ПКР, а наименьшее значение в папиллярном.
При сопоставлении степени ядерной атипии по Fuhrman с числом интратуморальных ТК получены следующие данные: при GI число ТК составило 1,1±0,1, при GII оно возрастало до 2,0±0,2 (р = 0,000006), при GIII оно составило - 4,8±0,3 (p = 0,0000001) и при GIV - 6,3±0,5 (p = 0,007). Таким образом, обнаружено достоверное возрастание числа интратуморальных стромальных ТК при увеличении степени анаплазии клеток опухоли.
При размере опухолевого узла < 7,0 см число стромальных ТК равнялось 1,9±0,15, а при размере ≥ 7,0 см количество ТК в опухоли достоверно увеличивалось до 4,7±0,4 (p = 0,0000001).
В опухолях больных без регионарных и отдаленных метастазов содержание ТК составило 2,0±1,2, а при наличии метастазов оно достоверно возрастало до 4,7±0,4 (p = 0,0000001) (табл. 2, рис. 1 а, б).
Таблица 2
Содержание интратуморальных стромальных ТК в опухоли в зависимости от клинико-морфологических параметров ПКР
|
Клинико-морфологический параметр |
Количество ТК |
Значение (р) |
|
Пол: мужчины женщины |
2,6±0,2 2,4±0,2 |
- |
|
Возраст: 30 – 39 лет 40 – 49 лет 50 – 59 лет 60 – 69 лет 70 – 79 лет |
1,0±0,4 3,7±0,4 2,5±0,3 2,4±0,3 1,8±0,25 |
р = 0,005 - - - |
|
Стадия TNM: І стадия ІІ стадия ІІІ стадия ІV стадия |
1,85±0,15 2,7±0,4 4,3±0,4 6,3± 0,6 |
- p = 0,003 p = 0,005 |
|
Гистологический вариант опухоли: папиллярный светлоклеточный хромофобный зернистоклеточный веретеноклеточный |
1,05±0,4 2,2±0,2 2,4±0,4 6,1±0,8 6,3±0,6 |
p = 0,01 - - - |
|
Градация по Fuhrman: GІ GІІ GІІІ GІV |
1,1±0,1 2,0±0,2 4,8±0,3 6,3±0,5 |
p = 0,000006 p = 0,0000001 p = 0,007 |
|
Размер опухолевого узла: < 7,0 см ≥ 7,0 см |
1,9±0,15 4,7±0,4 |
p = 0,0000001 |
|
Метастазы: N0 N+ |
2,0±1,2 4,7±0,4 |
p = 0,0000001 |
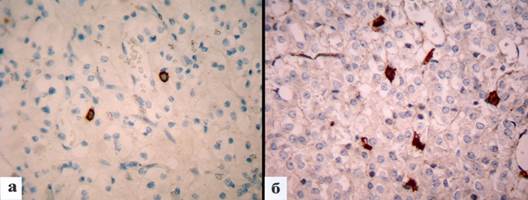
Рис. 1. Плотность распределения интратуморальных тучных клеток в строме рака почки в зависимости от наличия метастазов: a – локализованная опухоль; б – опухоль с метастазами. Иммуногистохимическое окрашивание на CD117. Увеличение х 400
Для оценки отдаленных результатов 5-летней послеоперационной выживаемости больных, в зависимости от плотности распределения интратуморальных ТК в опухоли, наблюдения были разделены на 2 группы. Первую группу составили карциномы с малым числом ТК (< 3), вторую группу составили карциномы c большим числом ТК (≥ 3). При анализе выживаемости больных по Каплан-Мейеру было обнаружено, что когда число ТК в опухоли было < 3, то кумулятивная доля выживших к 1800 дню составила 1 (100%), а когда количество ТК в опухоли было ≥ 3, то кумулятивная доля выживших к 1800 дню снижалась до 0,62 (62%). При сравнении показателей выживаемости в группах больных с использованием логарифмического рангового критерия было получено, что различия данных были достоверными (log-rankp = 0,00015) (рис. 2).
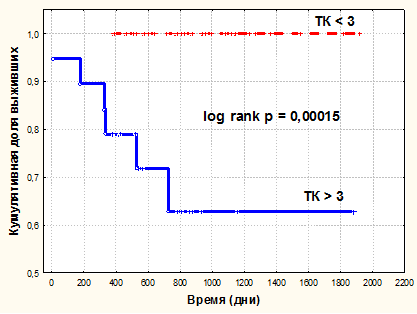
Рис. 2. Кумулятивная пропорция 5-летней послеоперационной выживаемости больных ПКР в зависимости от числа интратуморальных ТК в опухоли
Заключение. Результаты проведенного исследования показали, что выявлены корреляционные взаимосвязи плотности распределения ТК в опухоли с клинической стадией (r = 0,69; p = 0,0001), размером опухолевого узла (r = 0,58; p = 0,0001), градацией опухоли по Fuhrman (r = 0,89; p = 0,001), наличием регионарных и дистантных метастазов (r = 0,48; p = 0,0001) и послеоперационной выживаемостью больных (r = 0,40; p = 0,001).
Так, наибольшее число интратуморальных тучных клеток отмечается: при III и IV стадии заболевания, степени анаплазии GIII и IV, размере опухолевого узла ≥ 7 см и в опухолях с наличием отдаленных метастазов, поэтому данный морфологический феномен может быть использован в качестве дополнительного неблагоприятного фактора прогноза течения данного заболевания. Высокий уровень содержания ТК в опухоли является неблагоприятным фактором 5-летней послеоперационной выживаемости больных при ПКР.
Таким образом, проведенное исследование указывает на важное значение интратуморальных стромальных ТК рака почки для прогрессии опухолевого процесса, а увеличение количества ТК ≥ 3 в опухолевой ткани можно рассматривать как критерий вероятного возникновения метастазов.
Библиографическая ссылка
Бобров И.П., Черданцева Т.М., Крючкова Н.Г., Лепилов А.В., Лазарев А.Ф., Авдалян А.М., Климачев В.В., Климачев И.В., Мяделец М.Н., Казарцев А.В., Малинина Е.И. ДИАГНОСТИЧЕСКОЕ И ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ ИССЛЕДОВАНИЯ ТУЧНЫХ КЛЕТОК ПРИ РАКЕ ПОЧКИ // Современные проблемы науки и образования. 2017. № 3. ;URL: https://science-education.ru/ru/article/view?id=26537 (дата обращения: 01.07.2025).



