Основным методом диагностики пола плода в медицинской практике на данный момент является УЗИ диагностика, самый ранний срок определения пола по УЗИ – 11–12 недель, но точным данный метод может считаться только на 18 неделе. В то же время определение пола плода необходимо не только для удовлетворения любопытства родителей, но также и для определения наличия трисомий, моносомий и прочих аберраций числа половых хромосом, имеющих довольно высокую частоту в популяции: Синдром Шерешевского – Тёрнера 1:1500; Синдром Клайнфельтера 1:500; Синдром де ля Шапеля 1:20000 XYY-синдром 1:1000, ХХХ – 1:1000 и другие [2, 6, 14, 15].
Существующие методы инвазивной пренатальной диагностики позволяют определить пол плода на ранних стадиях гестации, но из-за недостатков: угроза прерывания беременности, развитие кровотечения и т.д., не целесообразно применять их без серьезных медицинских показаний [1, 10]. Поэтому использование методов неинвазивной пренатальной диагностики, для которых исследуемым материалом является кровь матери, может быть как ранней альтернативой УЗИ, так и безопасной альтернативой существующим инвазивным методам [3, 4].
Один из перспективных неинвазивных методов: захват трофобластов, циркулирующих в крови матери – генетический материал трофобластов при должном уровне обогащения и захвата может служить источником фетальной ДНК для пренатального генетического анализа начиная с 9-й недели гестации [9,11]. В то же время низкое содержание трофобластов в материнском кровотоке делает необходимым совершенствование протоколов молекулярной диагностики амплифицированного генетического материала, полученного из единичной клетки [12, 13].
Для определения пола можно использовать STR анализ, для этого библиотека амплифицированных фрагментов должна репрезентативно отражать геном единичной клетки и давать воспроизводимые результаты в ходе фрагментного STR анализа микросателлитной ДНК [5, 7, 8].
Цель исследования заключалась в ранней диагностике пола плода и аберраций числа половых хромосом, на основе STR анализа локусов половых хромосом на основе ДНК трофобластов, циркулирующих в кровотоке матери.
Материал и методы
В работе были исследованы 15 образцов периферической крови, полученные от женщин с одноплодной беременностью в сроках гестации 8–13 недель. Средний возраст обследованных женщин составил 28 лет (от 23 до 37 лет). У 8 (53,3 %) настоящая беременность была первой, у остальных – повторные.
Периферическую гепаринизированную венозную кровь беременных разбавляли фосфатно-солевым буфером и выделяли мононуклеары центрифугированием на градиенте Histopaque-1077 (плотность 1.077 г/мл). Полученный образец мононуклеарных клеток (~ 2×107 клеток в 800 мкл) подвергали негативной иммуномагнитной сепарации по маркерам зрелых линейно дифференцированных клеток (набор BD Human Lineage Cell Depletion Set). Клетки окрашивали антителами против HLA-G, Trop-2, и CD45, ядра окрашивали Hoechst 33342. Сортировку трофобластов выполняли на BD FACS AriaIII (BD Biosciences, США). Полногеномную амплификацию ДНК отсортированных клеток проводили с набором PicoPLEX™ WGA Kit (Rubicon Genomics, США) на амплификаторе С-1000 (Bio-Rad Laboratories, Inc., США) с электрофоретическим контролем на Agilent 2200 TapeStation (Agilent Technologies, США). Амплифицированную ДНК использовали для количественной флуоресцентной ПЦР с реагентами Aneufast Multiplex QF-PCR Kit (Genomed, United Kingdom), содержащими STR маркеры к микросателлитной ДНК половых хромосом. Фрагментный анализ продуктов количественной флуоресцентной ПЦР выполняли на генетическом анализаторе ABI PRISM ABI ABI 3500xL (Applied Biosystems, США) с размерным стандартом GeneScan™ 600 LIZ® Size Standard v2.0 и программным обеспечением GeneMapper® Software v5.0.
Результаты
Центрифугирование в градиенте плотности с последующей магнитной сепарацией позволило получить взвесь клеток, максимально обогащенную трофобластами. Средняя концентрация выделенных клеток после негативной сепарации составила ~ 4,72×105 клеток/мл, степень истощения превышала 90 % (93,1±2,14 %).
Негативную фракцию клеток подвергали специфическому иммуно-окрашиванию для выявления популяции трофобластов. Внутри гейта живых ядросодержащих клеток, негативных по панлейкоцитарному маркеру (CD45), выделяли двойной позитивный гейт HLA-G+Trop-2+, который использовали для дальнейшей сортировки (рис. 1).
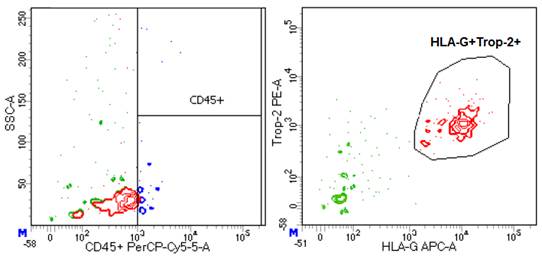
Рис. 1. Выделение гейта сортировки трофобластов (Trop-2+HLA-G+) среди популяции клеток негативных по CD45
Число клеток-кандидатов, удовлетворяющих критериям сортировки CD45–HLA-G+Trop-2+, составило 34,4±10,3 клеток. Далее отсортированные в пробирки единичные клетки-кандидаты подвергали полногеномной амплификации. Электрофоретический контроль во всех образцах был положительным со средней концентрацией ДНК после очистки 56,8±10,1 нг/мкл.
На основе полногеномной амплификации получали библиотеку амплифицированных фрагментов ДНК единичных клеток для последующей мультиплексной количественной флуоресцентной ПЦР с использованием флуоресцентно-меченных праймеров, специфичных к индивидуальным STR последовательностям, с последующим разделением фрагментов капиллярным электрофорезом для сравнения числа пиков и их высоты для каждого STR маркера.
Наибольшая плотность длин фрагментов ДНК, полученных в ходе полногеномной амплификации, приходилась на диапазон 400–700 п.н., в связи с этим для определения пола были отобраны наиболее короткие STR маркеры (длиной менее 300 п.н.) для половых хромосом (табл. 1).
Таблица 1
STR маркеры, использованные для определения полиморфизмов гоноосом (указаны максимальные диапазоны длин аллелей)
|
Хромосома X |
Хромосома Y |
|
X22 (189-253 п.н.) |
DXYS267 (330-354 п.н.) |
|
HPRT (264-313 п.н.) |
DXYS218 (266-294 п.н.) |
|
AMXY (104 п.н.) |
AMXY (109 п.н.) |
|
— |
SRY-гену (463 п.н.) |
Для определения пола использовали маркеры к последовательностям половых хромосом – X22 (189-253 п.н.), DXYS267 (330-354 п.н.) и DXYS218 (266-294 п.н.), X-сцепленного маркера HPRT (264-313 п.н.), SRY-гену (463 п.н.) и амелогенину (AMXY: для Х хромосомы – 104 п.н.; для Y хромосомы – 109 п.н.).
Параллельно выполняли фрагментный анализ родительской ДНК по тем же микросателлитным маркерам, это позволило верифицировать фетальное происхождение выделенных клеток и исключать образцы, сильно контаминированные материнской ДНК (табл. 2).
Таблица 2
STR маркеры и их генотипы в выделенных трофобластах
№ |
Срок гестации |
Число трофобластов |
Информативность STR маркеров |
Число "+" |
Результат |
||||||||
|
X и Y |
ПОЛ |
||||||||||||
|
X22 |
HPRT |
AMXY (104 п.н.) |
DXYS267 |
DXYS267 |
DXYS218 |
AMXY (109 п.н.) |
SRY-ген |
||||||
|
1. |
9 |
10 |
+ |
+ |
- |
+ |
- |
+ |
+ |
+ |
6 |
XY |
М |
|
2. |
11 |
25 |
+ |
+ |
+ |
- |
+ |
+ |
+ |
+ |
7 |
XY |
М |
|
3. |
10 |
26 |
++ |
++ |
+ |
- |
- |
- |
- |
- |
5 |
XX |
Ж |
|
4. |
8 |
18 |
+ |
+ |
- |
+ |
+ |
+ |
+ |
+ |
7 |
XY |
М |
|
5. |
10 |
45 |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
8 |
XY |
М |
|
6. |
12 |
38 |
+ |
- |
+ |
+ |
+ |
+ |
+ |
+ |
7 |
XY |
М |
|
7. |
9 |
36 |
++ |
++ |
++ |
- |
- |
- |
- |
- |
6 |
XX |
Ж |
|
8. |
9 |
53 |
+ |
- |
+ |
+ |
- |
+ |
+ |
+ |
6 |
XY |
М |
|
9. |
11 |
27 |
+ |
+ |
+ |
+ |
+ |
- |
+ |
+ |
7 |
XY |
М |
|
10. |
8 |
34 |
+ |
- |
- |
+ |
+ |
+ |
+ |
+ |
6 |
XY |
М |
|
11. |
13 |
44 |
++ |
+++ |
+++ |
- |
- |
- |
- |
- |
8 |
XX |
Ж |
|
12. |
10 |
41 |
+ |
+ |
+ |
+ |
+ |
- |
+ |
+ |
7 |
XY |
М |
|
13. |
9 |
38 |
+ |
- |
+ |
+ |
+ |
+ |
+ |
+ |
7 |
XY |
М |
|
14. |
8 |
39 |
++ |
+ |
++ |
- |
- |
- |
- |
- |
5 |
XX |
Ж |
|
15. |
11 |
24 |
+ |
++ |
++ |
- |
- |
- |
- |
- |
5 |
XX |
Ж |
В табл. 2 представлена обобщенная информация об информативности генотипов всех наборов STR маркеров для каждой из исследованных хромосом.
Пол плода определялся по совокупности показателей, таких как соотношение аллелей и наличие аллелей Y хромосомы.
Согласно полученным данным во всех наблюдениях был установлен пол плода (10 мужского пола и 5 женского). При ретроспективном анализе полученные результаты полностью соответствовали данным УЗИ на 18–19 неделе и по факту рождения.
Так как женский пол гомогаметный, а мужской гетерогаметный, то при успешном прохождении анализа по всем локусам число «+» у мужского пола должно быть ≥6, а у женского ≤6. В одном из 15 исследованных образцов имело место отклонение от этого правила – № 11. В данном образце сигнал указывал на соотношение аллелей 2:1, вероятно, имела место значительная контаминация материнской ДНК, а не трисомия по Х хросоме, так как повторное исследование не подтвердило данный результат, и ретроспективный анализ показал рождение ребенка женского пола нормального кариотипа.
Тем не менее помимо определения пола данный метод подходит для диагностики аберраций половых хромосом. Таких как Синдром Шерешевского – Тёрнера – по одной аллели X хромосомы и отсутствие аллелей Y хромосомы; Клайнфельтера – 2 и более копии аллелей X хромосомы при наличии аллелей Y хромосомы; Синдром де ля Шапеля – наличие только SRY гена при двойном наборе аллелей X хромосомы, и другие. В данном исследовании таких случаев выявлено не было.
Позитивная корреляция между числом выделенных трофобластов и числом информативных пиков STR маркеров для всех исследованных хромосом составила r = + 0,69. Связь меду длинной фрагмента STR маркера и числом их успешных идентификаций в ходе капиллярного электрофореза носила негативный характер и составила r = – 0,61. Таким образом, размер фрагментов, получаемых в ходе полногеномной амплификации генетического материала единичных клеток, затрудняет воспроизведение длинных аллелей STR маркеров. Однако проблема может быть минимизирована при увеличении числа выделенных трофобластов.
Обсуждение
Настоящее исследование показало возможность оптимизации технологии обогащения и сортировки клеток трофобласта, циркулирующих в крови матери, а также использование количественной флуоресцентной ПЦР с последующим капиллярным электрофорезом флюоресцентного продукта для анализа STR маркеров половых хромосом на основе генома единичных трофобластов.
Для получения геномной библиотеки фрагментов, репрезентативно представляющей геном единичных клеток при проведении микросателлитного анализа, применялся метод на основе технологии MALBAC (Multiple Annealing and Looping-Based Amplification Cycles). Полученные результаты показали эффективность комплекса использованных методов, полученная геномная библиотека содержала концентрацию ДНК 56,8±10,1 нг/мкл (после очистки) и состояла преимущественно из фрагментов длиной от 300 до 700 пар нуклеотидов.
Учитывая ограниченность длин фрагментов для идентификации половых хромосом, использовали STR маркеры к псевдоаутосомным последовательностям, X-сцепленный маркер и два маркера к неполиморфным последовательностям – SRY-гену и амелогенину, длина которых не превышала 300 п.н. Набор микросателлитных маркеров, использованный в настоящем исследовании, позволил определить пол плода во всех наблюдениях, а также исключить мозаицизм и загрязнение образца материнской ДНК. При использовании метода, с трофобластами в качестве источника ДНК плода, достоверность результатов не зависит от наличия предыдущих беременностей.
Заключение
Используемые методы выделения трофобластов из крови беременной в ранних сроках гестации позволили реализовать метод раннего (с 8 недели гестации) определения пола плода и аберраций половых хромосом. Подобное исследование может быть выполнено быстро и не требует большого количества геномной ДНК.
Библиографическая ссылка
Гудков Г.В., Пивень А.В., Золотавина М.Л. РАННЯЯ ДИАГНОСТИКА ПОЛА И АБЕРРАЦИЙ ПОЛОВЫХ ХРОМОСОМ ПЛОДА НА ОСНОВЕ STR АНАЛИЗА К МАРКЕРАМ ПОЛОВЫХ ХРОМОСОМ ГЕНЕТИЧЕСКОГО МАТЕРИАЛА ПЛОДНЫХ КЛЕТОК // Современные проблемы науки и образования. 2017. № 3. ;URL: https://science-education.ru/ru/article/view?id=26505 (дата обращения: 17.01.2026).



