Изучение молекулярных механизмов воздействия загрязнителей на организмы представляет чрезвычайную актуальность для эколого-генетической оценки зоны Каспия.
В настоящее время широко используемым инструментом ДНК-анализа стал метод RAPD-PCR-анализа. В основе метода RAPD (Random Amplified Polymorphic DNA) лежит ПЦР-амплификация анонимных участков ДНК с помощью одного, обычно короткого (до 10 пар основании, п.о.) праймера произвольной последовательности, который индуцирует в каждой реакции синтез до нескольких десятков фрагментов ДНК случайной локализации. Возможность исследовать полиморфизм всего генома без предварительного знания конкретных последовательностей ДНК составляет главное преимущество RAPD-анализа. Высокий уровень полиморфизма, определяемый RAPD-PCR-методом, является достаточно информативным в популяционных исследованиях для выявления скрытого генетического полиморфизма в линиях и близкородственных видах, а также индивидуальной идентификации [1, 2].
В исследованиях осетровых рыб RAPD в основном применяется на видовом уровне, когда дифференциация основывается на обнаружении ряда видоспецифичных бэндов. С помощью восьми различных RAPD-праймеров были дискриминированы шесть видов осетровых рыб [3]. Позже, используя RAPD, наблюдали только незначительные различия между близкородственными видами A. persicus и A. Gueldenstaedtii [4]. В работе Рожкован и иных для идентификации четырех межвидовых гибридов от скрещивания A. schrenckii, A. baerii и A. ruthenus успешно использовали 10 RAPD-праймеров. Следует отметить, что идентификация межвидовых гибридов осетровых особенно актуальна в условиях их интенсивного разведения в аквакультуре [5].
Определение аккумуляции полициклических ароматических углеводородов (ПАУ) и их метаболитов как специфических ксенобиотиков в зоне добычи, переработки и транспортировки нефти является чрезвычайно актуальной проблемой, в том числе казахстанского шельфа Каспийского моря [6, 7]. Целью настоящей работы является проведение рекогносцировочного исследования влияния нефтяного загрязнения на устойчивость генома тест-объектов методами молекулярно-генетического анализа.
Материалы и методики исследования
Объектами исследований были выбраны рыба – бычок (Neogobius gorlap) и кольчатые черви - полихеты (Nereis diversicolor), отловленные в прибрежной зоне Каспия. Для анализа методом полимеразной цепной реакции ДНК-спектров рыб и полихет был отобран материал из трех точек с разным уровнем загрязнения: побережье Каспия в дельте реки Урал, нижнее течение реки Урал и зона реки около города Атырау.
Данные виды гидробионтов могут быть использованы для биомониторинга исследуемой зоны, так как повсеместно распространены в водоеме, хорошо изучена их биология, отсутствуют длительные миграции [8]. Материалом для исследования служили плавники рыб и ткани полихет.
Выделение ДНК. Для экстракции геномной ДНК использовали набор реагентов QIAamp DNA Mini Kit («Qiagen», США). Количественную и качественную оценку выделенных ДНК проводили с помощью ДНК-фотометра «Biofotometer Plus» (Eppendorf, Германия) и электрофоретического анализа. Для фотометрического анализа проводили измерение адсорбции водных растворов ДНК при трех длинах волн: 260 нм, 280 нм и 320 нм. Размер молекул ДНК определяли методом электрофореза в 0,7%-ном агарозном геле после окрашивания бромистым этидием. Визуализация ДНК проводилась с использованием трансиллюминатора в ультрафиолетовом свете.
RAPD-PCR анализ. Полимеразную цепную реакцию проводили с десятичленными олигонуклеотидными праймерами, синтезированными в РГП «Институт общей генетики и цитологии» (Алматы, Казахстан) на синтезаторе ASM-800 (Биосет, Новосибирск, Россия) (таблица 1). Для минимизации ошибки реакцию оптимизировали путем подборки необходимых концентраций каждого компонента и приготовлением общей смеси для всей выборки. Реакцию PCR проводили в следующем температурном режиме: первоначальная денатурация при 94°С 2 мин, 40 циклов, состоящих из четырех ступеней, включая 45 с при 92°С, 30 с — при 37°С, 15 с - при 45°С и 2 мин - при 72°С. Реакцию завершала 10-минутная стадия элонгации при 72°С. Негативный контроль реакции (тест на контаминацию) содержал реакционную смесь без добавления ДНК.
Таблица 1
Праймеры, использованные для RAPD-PCR анализа рыб и полихет
|
Праймер |
5′ → 3′ |
|
OPA-02 |
TGC CGA GCT G |
|
OPA-09 |
GGG TAA CGC C |
|
OPA-10 |
GTG ATC GCA G |
|
OPA-11 |
CAA TCG CCG T |
Гель-электрофорез. Электрофорез амплифицированных фрагментов ДНК проводили в 2%-ном агарозном геле в ТАЕ буфере (0,89M Tрис, 0,1М ацетат натрия, 0,05М ЭДТА), pH 7,8 с бромистым этидием (5 мкг/мл) и обрабатывали с помощью гель-документирующей системы Quantum-ST5-1100 (Vilber Lourmat, Франция). Размер каждого фрагмента определяли путем сравнения с маркерными фрагментами ДНК GeneRuller 100 kbDNALadder (ThermoScientific, USA).
Результаты исследования и обсуждение
На первом этапе исследований были подобраны наиболее информативные праймеры для проведения ПЦР-анализа по литературным данным. Далее был проведен анализ вариабельности случайно амплифицированной ДНК методом RAPD-PCR по выбранным стандартным 10-нуклеотидными праймерам (табл. 1).
В ходе анализа полученных методом полимеразной цепной реакции ДНК-спектров рыб, отловленных в окрестностях с разным уровнем загрязнения, были обнаружены как полиморфные, так и мономорфные фрагменты ДНК. По ранее опубликованным данным мономорфную ДНК следует отличать от полиморфной и рассматривать как проявление генетического мономорфизма на уровне ДНК [2].
Результаты исследований влияния антропогенных факторов на особенности ДНК-спектров исследованных рыб, полученных методом RAPD-PCR-анализа, представлены на рисунке 1.
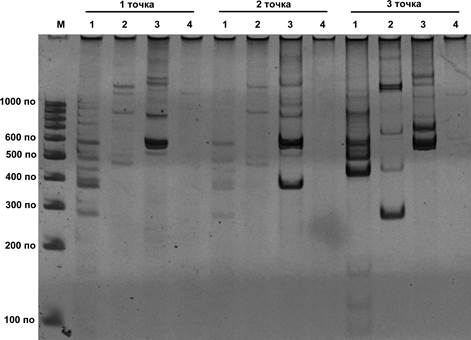
М – ДНК-маркер (Gene Ruller 100 kb DNA Ladder). 1 – праймер ОРА-02; 2 – праймер ОРА-09; 3 – праймер ОРА-10; 4 – праймер ОРА-11. 1-я точка - побережье Каспия в дельте реки Урал; 2-я точка – нижнее течение реки Урал; 3-я точка – зона реки около города Атырау;
Рис. 1. RAPD-полиморфизм рыб (Neogobius gorlap), выявленный с помощью праймеров ОРА-02, ОРА-09, ОРА-10 и ОРА-11
В общей выборке из выбранных трех точек выявлено от 4 до 11 фрагментов. При визуальном анализе ДНК-фрагменты, полученные у вида Neogobius gorlap выборок из различных биотопов, имели очень высокую степень различия. Все выбранные праймеры показали разные картины внутривидовой дифференциации. Но абсолютно надежных маркеров (гибридспецифичных фрагментов ДНК) для идентификации фенотипических гибридов исследованных рыб выявлено не было. Для изученных образцов наиболее интересными праймерами оказались OPA-09 и OPA-10. На рисунке 1 видны отчетливые полоски (ДНК-фрагменты) с разными размерами.
Таким образом, в ходе анализа полученных методом RAPD-PCR-анализа ДНК-спектров рыб, отловленных из различной степени загрязненности биотопов, были обнаружены полиморфные ДНК. В исследованных образцах рыб выявлены также мономорфные ДНК.
Следующим объектом для исследований были кольчатые черви — полихеты (Nereis diversicolor), отловленные в тех же биотопах, что и рыбы. В работе использованы те же праймеры OPA-02, OPA-09, OPA-10 и OPA-11.
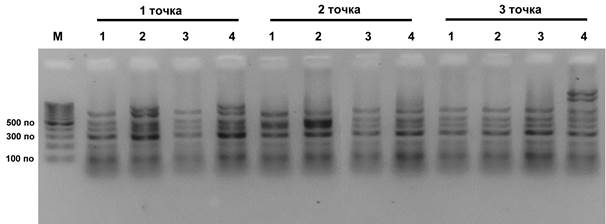
М – ДНК-маркер (GeneRuller 100 kb DNA Ladder). 1 – праймер ОРА-02; 2 – праймер ОРА-09; 3 – праймер ОРА-10; 4 – праймер ОРА-11; 1-я точка - побережье Каспия в дельте реки Урал; 2-я точка – нижнее течение реки Урал; 3-я точка – зона реки около города Атырау;
Рис.2. RAPD-полиморфизм полихет Nereis diversicolor, выявленный с помощью праймеров ОРА-02, ОРА-09, ОРА-10 и ОРА-11
Проведенные исследования показали, что ДНК-спектр полихет содержит от 6 до 9 случайно амплифицированных ДНК-фрагментов длиной от 100 до 1200 пар нуклеотидов (рис. 2), причем фрагмент на 4-м образце 3-ей точки, который содержит свыше 1000 п.о., отсутствует у других особей. Выявленные ДНК-фрагменты могут служить маркерами различных процессов и характеристик, отличающих данные особи.
Из литературных данных следует, что RAPD-маркеры локализованы в основном в некодирующей области ДНК, поскольку она составляет подавляющую часть генома эукариот [9, 10]. Скорость же мутирования в некодирующей ДНК примерно вдвое выше, чем в кодирующей. К тому же RAPD-маркеры иногда амплифицируются из регионов повторяющейся ДНК и таким способом могут отражать высокие скорости их мутирования, которое может быть индуцировано радиационным или химическим загрязнением окружающей среды.
Таким образом, рыбы считаются наиболее адекватным объектом для оценки загрязнителей воды с мутагенным и канцерогенным потенциалом, поскольку метаболизируют и накапливают в организме содержащиеся в воде химические соединения. В нашем случае как рыбы, так и полихеты реагируют на токсические соединения аналогично высшим позвоночным. Они могут применяться для скрининга химических соединений, потенциально мутагенных и канцерогенных для человека.
Выводы. Выявлены особенности ДНК-спектров исследованных рыб и полихет в двух районах, различающихся уровнем загрязнения среды обитания. Также обнаружен уникальный ДНК-фрагмент у особей, обитающих в более загрязненной среде. В ходе анализа полученных методом полимеразной цепной реакции ДНК-спектров рыб, отловленных из различной степени загрязненности биотопов, были обнаружены полиморфные ДНК. В исследованных образцах рыб выявлены также и мономорфные ДНК. ДНК-спектр полихет содержит в себе от 6 до 9 случайно амплифицированных ДНК-фрагментов длиной от 100 до 1200 пар нуклеотидов. Фрагмент на 3-м образце, который содержит свыше 1000 п.н., является наиболее ярко выраженным. ДНК-фрагменты, выявленные у остальных особей, могут служить маркерами различных процессов и характеристик, отличающих данные особи. Выявлен ДНК-фрагмент длиной 300 п.н., который обнаружен у всех исследованных особей полихет (100%-ная частота встречаемости). Фрагмент ДНК длиной 300 п.н. отличается от полиморфной; его можно рассматривать как проявление генетического мономорфизма на уровне ДНК и использовать в качестве молекулярного маркера для конкретно исследуемых видов.
Рецензенты:
Заядан Б.К., д.б.н., профессор, декан факультета биологии и биотехнологии Казахского национального университета имени аль-Фараби, Министерства образования и науки РК, г.Алматы;
Канаев А.Т., д.б.н., профессор, заведующий кафедрой биоразнобразия и биоресурсов Казахского национального университета имени аль-Фараби, Министерства образования и науки РК, г. Алматы.
Библиографическая ссылка
Кожахметова А.Н., Шаметов А.К., Бигалиев А.Б., Толебаева А.Д., Бекманов Б.О. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЙ АНАЛИЗ ГИДРОБИОНТОВ ИЗ РАЗЛИЧНЫХ АНТРОПОГЕННО-ЗАГРЯЗНЕННЫХ БИОТОПОВ // Современные проблемы науки и образования. 2015. № 2-1. ;URL: https://science-education.ru/ru/article/view?id=18785 (дата обращения: 02.07.2025).



