Введение
Гамма-гидроксимасляная кислота является естественным тормозным медиатором ЦНС, в анестезиологии, психиатрии, неврологии, офтальмологии и других областях медицины широко применяется её натриевая соль (натрия оксибутират). Благодаря уникальному для наркозных средств антигипоксическому эффекту этот препарат незаменим для многих стандартов лечения. Также натрия оксибутират находит применение в спортивной медицине в качестве снотворного, антиоксидантного и рекреационного средства. К сожалению, психотропный и рекреационный эффекты стали причинами немедицинского употребления натрия оксибутирата в качестве наркотического средства и допинг-препарата [1, 2, 3].
В начале XXI века резко возросло число случаев немедицинского употребления натрия оксибутирата и его прекурсоров за рубежом, как одного из «клубных наркотиков» [8, 10], рост немедицинского употребления натрия оксибутирата на территории РФ и, в частности, Омской области отмечается в основном с 2010-го года [4, 5]. Применение гамма-гидроксимасляной кислоты (натрия оксибутирата) и её прекурсоров (бутиролактона) с целью «кайфа» в токсических дозах вызывает угнетение ЦНС, кому и апноэ, что без своевременной квалифицированной помощи может привести к летальному исходу. Неспецифическая картина отравления депримирующими и психотропными средствами, характерная для отравлений натрия оксибутиратом, требует лабораторного подтверждения диагноза. При анализе литературных данных выявлено, что основной метод анализа натрия оксибутирата – газовая хроматография/масс-спектрометрия (ГХ/МС) [1].
Цель нашего исследования – разработка доступного экспресс-метода качественного и количественного определения натрия оксибутирата в биологических жидкостях человека и вещественных доказательствах.
Известны способы обнаружения и определения лекарственных препаратов фотоколориметрическим методом на основе гидроксамовой реакции, в том числе и натрия оксибутирата [9], однако данный метод является качественным. Итогом нашего исследования явилась разработка метода фотометрического количественного определения натрия оксибутирата в растворе для целей химико-токсикологического и судебно-химического анализа. Методика может быть использована в обычных лабораториях, исключает применение дорогостоящего оборудования, высокотоксичных и летучих реактивов.
Материалы и методы эксперимента
Исследуемые образцы с концентрациями 0,1, 0,2, 0,4, 0,5 и 0,6 мг/мл готовили с использованием лекарственного препарата « Натрия оксибат», раствор для внутривенного и внутримышечного введения 200 мг/мл; амп. 5 мл; «Московский эндокринный завод» (Россия), воды очищенной (водные растворы) и мочи (модельные растворы), полученной от здоровых лиц 25-30 лет обоих полов, не принимавших лекарственных препаратов в течение 24 часов.
Реактивы: 50% раствор кислоты серной, 1М раствор гидроксиламина гидрохлорида, 20% раствор натрия гидроксида, кислота хлористоводородная концентрированная, 15% раствор железа (III) хлорида (по ГФ РФ XII издания).
Оборудование: спектрофотометр СФ-2000.
Методика: в чистые сухие пробирки помещали по 1,0 мл исследуемых растворов с концентрациями 0,1, 0,2, 0,4 и 0,6 мг/мл натрия оксибутирата, к каждой пробе добавляли 0,5 мл 50% раствора кислоты серной (рН=1-2), выдерживали 5 мин при 20°С; добавляли 0,5 мл 1М раствора гидроксиламина гидрохлорида, 2,5 мл 20% раствора натрия гидроксида (до рН=12-13) и выдерживали 30 мин при 20°С; добавляли 0,5 мл кислоты хлористоводородной концентрированной (до рН=1-2) и 0,5 мл 15% раствора железа (III) хлорида, тщательно перемешивали в течение 10 мин (развитие фиолетовой окраски); полученные окрашенные растворы спектрофотометрировали в интервале длин волн 400-759 нм в кварцевых кюветах с длиной поглощающего слоя 1 см на спектрофотометре СФ-2000.
Статистическую обработку результатов эксперимента проводили с использованием пакета программ Statistica 6.0 для доверительной вероятности р=0,95.
Результаты эксперимента и их обсуждение
Гидроксамовая проба основана на взаимодействии гидроксиламина гидрохлорида в щелочной среде с определяемым веществом, сопровождается гидроксиламинолизом с образованием гидроксамовой кислоты, которую фиксируют по образованию окрашенного комплекса с раствором железа (III) хлорида. Применение гидроксамовой пробы для определения натрия оксибутирата требует предварительного переведения исследуемого соединения в лактон. Схема реакции приведена на рисунке 1:
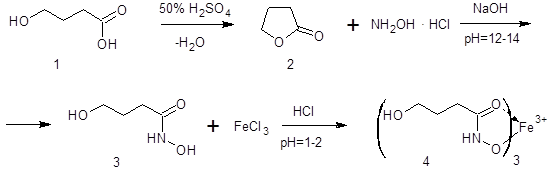
Рисунок 1 – Схема гидроксамовой реакции:
1 – гамма-гидроксимасляная кислота, 2 – бутиролактон, 3 – гидроксамовая кислота,
4 – комплекс гидроксамовой кислоты с солями железа (III).
Подбор отпимальных условий гидроксамовой реакции (концентрация реактивов, рН, температура и время различных этапов реакции) выполняли согласно принципам проведения полного факторного эксперимента. Результат оценивали по достижению максимального значения оптической плотности раствора с известной концентрацией.
Регистрировали спектры 20 образцов для каждой концентрации водных растворов и 10 образцов для каждой концентрации модельных растворов. На всех полученных спектрах отмечены характерной формы максимумы поглощения при длине волны 521±2 нм и минимумы при 720±2 нм, что свидетельствует об отсутствии влияния компонентов биологических жидкостей на продукт реакции. Спектры поглощения полученного комплекса в водных и модельных растворах представлены на рисунке 2.
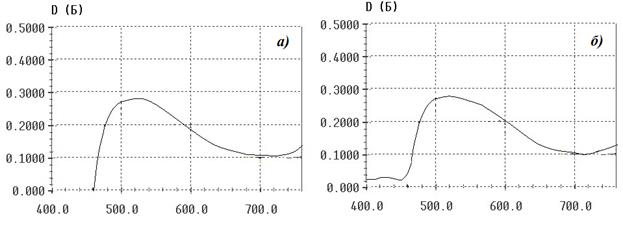
Рисунок 2 – Спектр поглощения комплекса продукта реакции с железа (III) хлоридом в кислой среде в водном растворе (а) и в модельном растворе (б).
Результаты статистической обработки экспериментальных данных представлены в таблицах 1 и 2.
Таблица 1.
Статистические параметры результатов спектрофотометрирования водных растворов (n=20, р=0,95).
|
С (мг/мл) |
А, Хср |
А, Sr |
А, σ |
А, доверительный интервал |
А, коэффициент вариации, % |
|
0,1 |
0,1297 |
0,0307 |
0,0009 |
±0,017 |
23,67 |
|
0,2 |
0,1980 |
0,0368 |
0,0014 |
±0,0136 |
18,59 |
|
0,4 |
0,2439 |
0,0256 |
0,0007 |
±0,0112 |
10,50 |
|
0,5 |
0,2985 |
0,0344 |
0,0018 |
±0,015 |
15,46 |
|
0,6 |
0,3351 |
0,0459 |
0,0021 |
±0,0225 |
13,70 |
Таблица 2.
Статистические параметры результатов спектрофотометрирования модельных растворов (n=10, р=0,95).
|
С (мг/мл) |
А, Хср |
А, Sr |
А, σ |
А, доверительный интервал |
А, коэффициент вариации, % |
|
0,1 |
0,1458 |
0,0193 |
0,0004 |
±0,0161 |
12,97 |
|
0,2 |
0,1835 |
0,0045 |
0 |
±0,0047 |
2,39 |
|
0,4 |
0,2541 |
0,0325 |
0,0011 |
±0,0271 |
12,79 |
|
0,5 |
0,3106 |
0,0367 |
0,0017 |
±0,0109 |
13,46 |
|
0,6 |
0,3414 |
0,0486 |
0,0024 |
±0,0432 |
14,24 |
Из представленных данных следует, что компоненты биологической жидкости не оказывают значимого влияния на величину оптической плотности и последующий расчёт количественного содержания натрия оксибутирата для всех исследуемых концентраций.
Для подтверждения линейной зависимости оптической плотности от концентрации натрия оксибутирата строили градуировочный график на 5 уровнях концентраций его водных (рисунок 3) и модельных (рисунок 4) растворов.
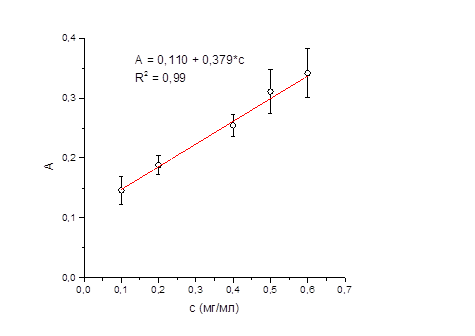
Рисунок 3 – График зависимости оптической плотности от концентрации натрия оксибутирата в водном растворе.
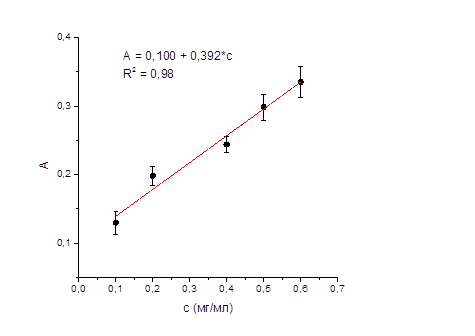
Рисунок 4 – График зависимости оптической плотности от концентрации натрия оксибутирата в модельном растворе.
Зависимость оптической плотности от концентрации натрия оксибутирата в водных растворах была аппроксимирована линейным уравнением с помощью метода наименьших квадратов. Полученное уравнение для водных растворов имеет вид:
А = 0,110 + 0,379·С,
где А – оптическая плотность (величина светопоглощения) раствора,
С – концентрация исследуемого раствора.
На всём интервале концентраций наблюдалась линейная зависимость оптической плотности от концентрации раствора, что свидетельствует о выполнении закона Бугера-Ламберта-Бера. Критерием приемлемости линейности явился и коэффициент корреляции (R2), его расчетная величина близка к единице (0,99). Таким образом, в данных интервалах концентраций методика обеспечивает определение натрия оксибутирата с требуемой линейностью.
Используя результаты построения градуировочного графика, рассчитывали молярный показатель поглощения и чувствительность определения натрия оксибутирата, приняв за Аmin=0,01. Результаты расчётов представлены в таблице 3.
Таблица 3.
Характеристики спектрофотометрической методики.
|
Определяемое вещество |
Молярная масса, г/моль |
Область линейности графика, мг/мл |
Молярный коэффициент поглощения продукта реакции |
Определяемый минимум, мкг/мл |
|
Натрия оксибутират |
126,09 |
0,1 – 0,6 |
491,29 |
24 |
Установлено, что разработанная методика достаточно чувствительна для определения натрия оксибутирата в диапазоне фармакокинетических концентраций в моче пострадавшего или умершего (0,1-0,6 мг/мл, в некоторых случаях до 1,6 мг/мл в зависимости от принятой дозы и индивидуальных особенностей организма [6,7]). Для модельных растворов в диапазоне концентраций 0,1 – 0,6 мг/мл при использовании разработанной нами методики также наблюдалась линейная зависимость оптической плотности от концентрации натрия оксибутирата, уравнение имеет вид:
А = 0,100 + 0,392·С,
где А – оптическая плотность (величина светопоглощения) раствора,
С – концентрация исследуемого раствора.
Расчётная величина коэффициента корреляции (R2) также близка к единице (0,98), что позволяет применять разработанную нами методику определения натрия оксибутирата в моче для целей химико-токсикологического и судебно-химического анализа.
Заключение
Разработана методика спектрофотометрического определения натрия оксибутирата в водном растворе в диапазоне концентраций 0,1 – 0,6 мг/мл. Подобраны оптимальные значения рН, концентрации реагентов, температура и время реакций на этапах методики. Данная методика применима для определения натрия оксибутирата в модельных растворах для целей химико-токсикологического и судебно-химического анализа. Возможно применение данной методики для мониторинга эффективности экстракции натрия оксибутирата из биологических объектов для целей дальнейших исследований.
Рецензенты:
Гришин А.В., д.фарм.н., профессор, заведующий кафедрой фармации ГБОУ ВПО «Омская государственная медицинская академия» Минздрава России, г. Омск.
Огай М.А., д.фарм.н., доцент кафедры фармацевтической технологии с курсом биотехнологии ГБОУ ВПО «Омская государственная медицинская академия» Минздрава России, г. Омск.
Библиографическая ссылка
Попова А.П., Гончаров Д.С., Чернышева О.В., Лукша Е.А. ОПРЕДЕЛЕНИЕ ГАММА-ГИДРОКСИМАСЛЯНОЙ КИСЛОТЫ И ЕЁ ПРЕКУРСОРОВ В РАСТВОРАХ МЕТОДОМ СПЕКТРОФОТОМЕТРИИ // Современные проблемы науки и образования. 2014. № 3. ;URL: https://science-education.ru/ru/article/view?id=13766 (дата обращения: 15.01.2026).



